HPLC法测定金芩芍注射液中绿原酸·黄芩苷和芍药苷的含量
2018-08-27刘发全宋亚伟丁在亮
刘发全,宋亚伟,吴 昊,张 莉,丁在亮
(安徽省兽药饲料监察所,安徽合肥 230091)
金芩芍注射液收载于《兽药质量标准》2017年版(中药卷)[1],主要有金银花、黄芩、白芍3味中药材。金银花性寒,味甘,入肺、心、胃经,具有清热解毒、疏散风热、凉血止痢、降血降火、消咽利膈之功效,所含有绿原酸为主要药理活性成分[2],主治畜禽风热感冒、热毒血痢、痈疽疔毒,对多种致病细菌、病毒有抑制作用,具有增强免疫力、护肝、消炎、解热、止血,用于预防和治疗呼吸道感染、肺炎、痢疾、肿溃疡、丹毒等症。黄芩性寒,味苦,入心、肺、胆、大肠经,具有清热燥湿、凉血安胎、解毒的功效,所含有黄芩苷为主要药理活性成分[3],主治畜禽温热病,具有抗菌、解热、镇静、利胆、抗炎抗变态反应,用于上呼吸道感染、肺热咳嗽、湿热黄胆、肺炎、痢疾、咳血、目赤、胎动不安、痈肿疖疮等症。芍药性微寒,味微苦,入心、肺、肝经,具有养血滋阴、止痛护肝的功效,所含有芍药苷为主要药理活性成分[4],用于促进畜禽新陈代谢,提高肌体免疫力,具有显著的镇痛、镇静、抗惊厥作用。金芩芍注射液是将15份金银花、7份黄芩、6份白芍中药经蒸馏、水煎、醇沉制成纯中药兽用制剂,其具有疏散风热、清热解毒、抗菌保肝、解热退烧的功能,主要用于治疗动物外感风热、温病初起[5],其质量标准主要规定检测活性成分绿原酸的含量,而黄芩、白芍主要活性成分黄芩苷和芍药苷也起很大作用,但标准未规定其含量检测方法。笔者利用高效液相色谱仪(HPLC),采用梯度洗脱法,同时测定了组方中金银花、黄芩、白芍中的活性成分绿原酸、黄芩苷、芍药苷含量,为完善该制剂的质量标准提供参考。
1 材料与方法
1.1材料
1.1.1主要仪器。美国Agilent公司高效液相色谱仪,型号HP 1100,配四联梯度泵、在线脱气机、二极管阵列紫外检测器(DAD)、自动进样器和柱温箱;十万分之一天平,德国赛多利斯,感量0.01 mg,型号BS21S。
1.1.2主要试剂。绿原酸对照品(批号Z0261407,含量97.3%)、芍药苷对照品(批号Z0261706,含量96.3%)、黄芩苷对照品(批号Z0271705,含量96.8%),均购自中国兽医药品监察所;金芩芍注射液(合肥爱瑞特生物制药有限公司提供,批号20171001、20171002、20171003);乙腈、甲醇均为色谱纯,美国FISHER Chemical公司;磷酸,分析纯,上海试剂公司;色谱用水为一级水,符合GB/T 6682中用水规定。
1.2方法
1.2.1对照品溶液的制备。精密称取绿原酸25.91 mg、芍药苷25.35 mg、黄芩苷24.85 mg对照品于100 mL容量瓶,加50%甲醇溶解,制成储备液,分别精密量取绿原酸、芍药苷、黄芩苷储备液5 mL于50 mL容量瓶混合,加50%甲醇定溶,制成工作液。
1.2.2供试品溶液的制备。精密量取金芩芍注射液1 mL置50 mL容量瓶,分别加水、乙腈各10 mL混合,凉至室温,加水定容至刻度,经0.45 μm滤膜过滤,取续滤液,即得。
1.2.3色谱分析条件。色谱柱:Waters公司Symmetry C18(4.6 mm×250 mm,5 μm);流动相:以乙腈为流动相A,以0.025 mol/L磷酸溶液为流动相B,四元梯度泵在线配制,按表1规定进行梯度洗脱;流速1.0 mL/min;测定波长230 nm;柱温30 ℃;进样量10 μL。
1.2.4方法学考察。
1.2.4.1系统适用性试验。分别吸取对照品溶液及供试品溶液各10 μL,在“1.2.3”色谱条件下,注入液相色谱仪进行测定,记录色谱图,考察系统适应性。
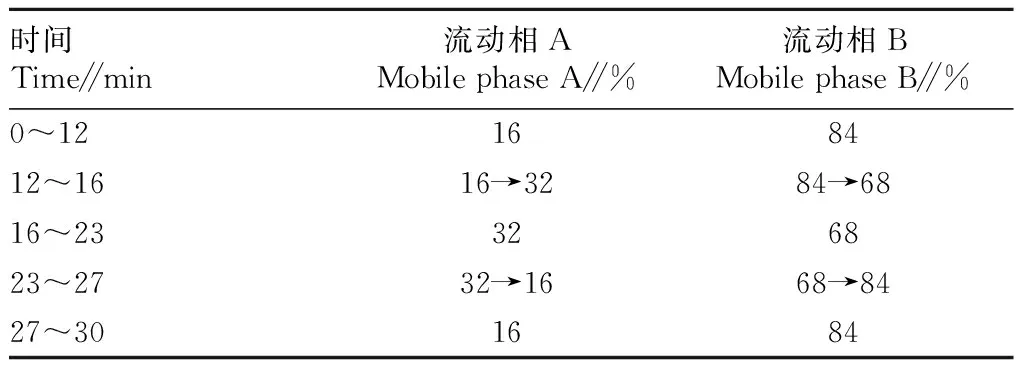
表1 梯度洗脱程序
1.2.4.2线性关系的考察。HPLC自动进样器吸取工作液2、5、10、10、20、40 μL注入HPLC仪,记录色谱图,以进样浓度X(μg/mL)为横坐标、峰面积Y为纵坐标绘制标准曲线,计算线性回归方程。
1.2.4.3精密度试验。取对照品工作液,按“1.2.3”色谱条件连续进样6次,测定对照品工作液中绿原酸、芍药苷、黄芩苷的峰面积的RSD值。
1.2.4.4稳定性试验。取供试品溶液,在室温下放置1、6、12、24、48 h后,按“1.2.3”色谱条件,注入液相色谱仪进行测定,进样量10 μL,测定峰面积积分值,计算RSD。
1.2.4.5重复性试验。取同一批号的样品按“1.2.2”方法制备供试品溶液6份,按“1.2.3”色谱分析条件,进样量为10 μL,测定峰面积,计算平均含量和RSD。
1.2.4.6加样回收试验。取同一批号样品6份,精密加入分别与样品中绿原酸、芍药苷、黄芩苷含量相等的对照品,按“1.2.2”方法制备供试品溶液,再按“1.2.3”色谱条件测定,进样量为10 μL,测定峰面积,计算平均回收率和RSD。
1.2.5样品测定。取金芩芍注射液,每批按“1.2.2”方法制备3份平行样,按“1.2.3”色谱条件注入HPLC,测定样品中绿原酸、芍药苷、黄芩苷的峰面积,通过标准曲线计算样品含量。
2 结果与分析
2.1方法学考察
2.1.1系统适用性试验。图1、2表明,按“1.2.3”此条件下,绿原酸、芍药苷、黄芩苷的保留时间分别为5、10、20 min左右,对照品溶液色谱主峰保留时间与供试品保留时间一致,分离度大于1.5,理论塔板数大于5 000。
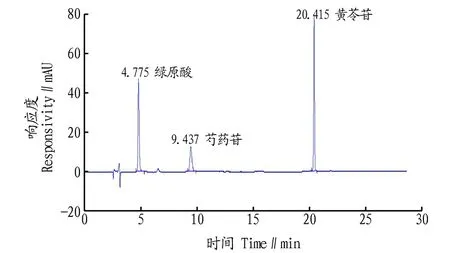
图1 对照品色谱图Fig.1 Chromatogram of reference substance
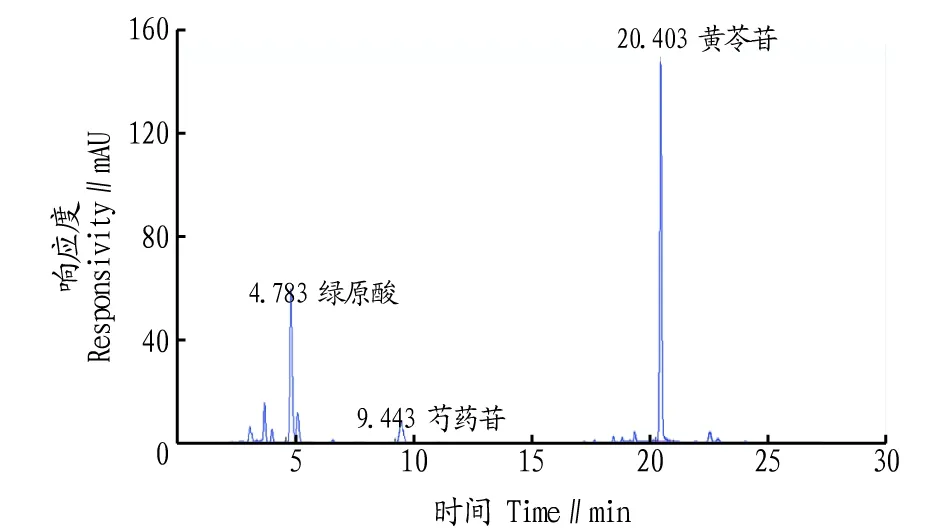
图2 样品色谱图Fig.2 Chromatogram of sample
2.1.2线性关系的考察。按“1.2.4.2”方法操作,计算线性回归方程,见表2。结果表明,绿原酸在2.52~126.05 μg/mL、芍药苷在1.47~73.78 μg/mL、黄芩苷在4.81~250.55 μg/mL呈良好的线性关系。
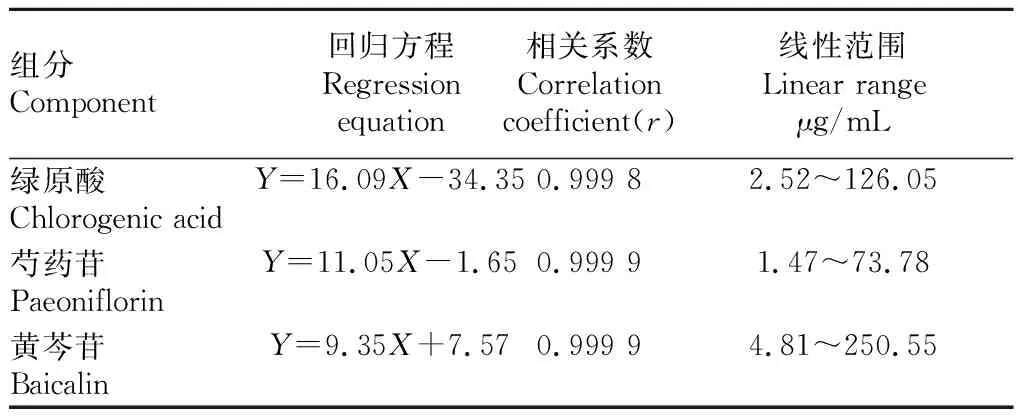
表2 回归方程和线性范围
2.1.3精密度试验。按“1.2.4.3”方法操作,计算得出绿原酸、芍药苷、黄芩苷峰面积的RSD分别为0.34%、0.46%、0.53%(n=6),保留时间的RSD均小于1%,表明在此试验条件下精密度良好。
2.1.4稳定性试验。按“1.2.4.4”方法操作,计算得出绿原酸、芍药苷、黄芩苷峰面积的RSD分别为0.44%、0.68%、0.86%(n=5),表明试样在48 h内稳定。
2.1.5重复性试验。按“1.2.4.5”方法操作,计算得出样品中绿原酸、芍药苷、黄芩苷峰面积的RSD分别为0.31%、0.42%、0.50%(n=6),保留时间的RSD均小于2%,表明该方法重复性良好。
2.1.6加样回收试验。按“1.2.4.6”方法操作,平均回收率为98.0%~102.8%,RSD为1.00%~1.15%,表明该方法准确、可靠,可用于金芩芍注射液中绿原酸、芍药苷、黄芩苷含量测定。
2.2样品含量测定由表3可知,金芩芍注射液中绿原酸、芍药苷、黄芩苷含量分别为3.51、2.45、3.74 mg/mL。
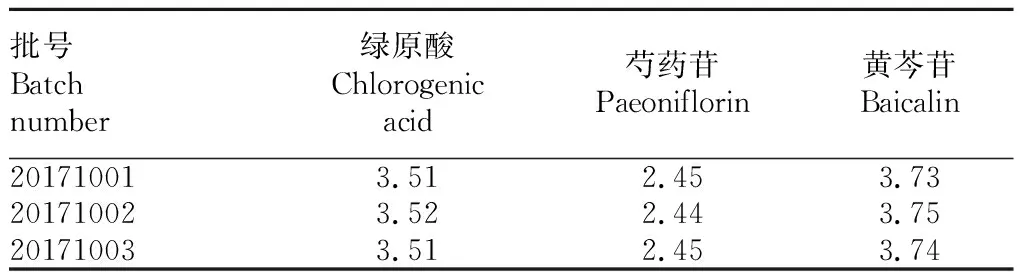
表3 样品含量测定结果(n=3)
3 结论与讨论
(1)有文献报道用甲醇、磷酸溶液作为流动相[6-8],经试验发现,绿原酸、芍药苷、黄芩苷3种成分分离度达不到要求,杂质有干扰。以乙腈、0.025 mol/L磷酸溶液进行梯度洗脱能够缩短分析周期,增加灵敏度,提高分离度同时使峰型得到改善,减少拖尾和杂质干扰。
(2)经二极管阵列紫外检测器(DAD)全波长扫描,绿原酸、黄芩苷分别在327、278 nm有最大的吸收,《兽药质量标准》2017年版(中药卷)规定采用327 nm测定金芩芍注射液中绿原酸含量,芍药苷在此波长处几乎没有吸收,芍药苷在230 nm处有最大吸收,黄芩苷、绿原酸在230 nm处有次吸收,根据处方金银花和黄芩投料比例较高,所以选择230 nm为测定波长。
(3)该研究建立了HPLC同时测定金芩芍注射液中绿原酸、芍药苷和黄芩苷的含量方法,通过试验发现,该方法精密度高、重复性好、操作简便,适用于金芩芍注射液的质量控制,为标准的提高提供依据。
