纤维状材料对模拟高放废液中钯的吸附行为
2018-08-24杨欣欣徐源来池汝安
杨欣欣,徐源来,马 晨,郭 格,周 芳,池汝安
纤维状材料对模拟高放废液中钯的吸附行为
杨欣欣1, 2,徐源来1, 2,马 晨1, 2,郭 格1, 2,周 芳1, 2,池汝安1, 2
(1. 绿色化工过程教育部重点实验室(武汉工程大学),武汉 430074;2. 武汉工程大学 化工与制药学院,武汉 430074)
为从高放废液中分离富集钯Pd(II),考察纤维状吸附材料Smopex®−102 FG对Pd(II)的静态吸附行为,研究HNO3浓度、接触时间、初始金属离子浓度、温度对Pd(II)吸附行为的影响,并考察吸附过程的动力学和热力学。结果表明:在研究条件下,Smopex®−102 FG对Pd(II)的吸附分配系数d随HNO3浓度的减小而逐渐增加,在HNO3浓度为0.001 mol/dm3时,分配系数d为142.0 cm3/g。Smopex®−102 FG吸附Pd(II)的动力学过程迅速,20 min即达到平衡状态,且平衡吸附率()皆在70%以上,吸附动力学符合拟一阶和拟二阶动力学模型,理论平衡吸附量与实验值(e=19.82 mg/g)基本吻合。Weber−Morris粒内扩散模型表明,Pd(II)在纤维状吸附材料Smopex®−102 FG的表面和颗粒内的扩散共同控制吸附速率。与此同时,随着初始金属离子浓度的增大,Smopex®−102 FG对Pd(II)的平衡吸附量呈线性增加,而其对Pd(II)的吸附率却随之减小,吸附过程遵循Freundlich等温吸附模型,为优惠吸附。从热力学实验结果可知,该吸附是自发吸热过程,温度升高有利于吸附过程的进行。静态吸附实验表明,纤维状吸附材料Smopex®−102 FG对钯离子表现出良好的吸附性能,是一种适用于处理高放废液中Pd(II)的吸附材料。
钯;纤维状吸附材料;高放废液;静态吸附;动力学;热力学
乏燃料循环流程产生的高放废液中含有约15%(质量分数)的铂族金属(Platinum group metals,PGMs)[1],如何从高放废液中有效分离铂族金属一直是国际核科学与技术前沿领域的热点和难点问题。基于减少放射性废物总量、充分利用稀有贵金属资源并解决乏燃料后处理流程中Pd离子沉淀堵塞管道[2]等技术难题,急需从高放废液中分离铂族金属。
另外Pd、Rh、Ru等铂族裂片元素中大多数为半衰期很短的核素[3],经过一定的衰减就可应用于一般工业。铂族金属的自然储量很有限[4−5],在我国属于急缺矿产,我国铂族金属的自然储量仅是世界的0.3%[6]。铂族金属由于其独特的物理、化学性质使得其在现代工业和国防建设中占据举足轻重的地位。随着社会经济的迅猛发展,各个行业对铂族金属的需求量与日俱增[7]。目前,针对铂族金属分离的主要方法有沉淀[8]、电解[9]、溶剂萃取[10−14]、离子交换[15−16]、分子识别技术[17]、萃取色层[18−19]等方法。萃取色层法因产生的二次废物极少,故在放射性废物处理领域有极大优势,与溶剂萃取法相比,萃取色层法具备操作简单、设备紧凑以及有机溶剂使用量少等诸多优点。本文作者针对高放废液中铂族金属含量较高的Pd离子,运用萃取色层法,通过静态批次实验,考察Pd(II)在纤维状吸附材料Smopex®−102 FG上的吸附行为,确定从模拟高放废液中分离Pd(II)的最佳工艺,并计算出吸附过程的动力学和热力学等参数。
1 实验
1.1 主要仪器和试剂
实验所用的主要仪器设备有:原子吸收分光光度计(SOLAAR.M6,美国热电);紫外可见分光光度计(UV−2450,日本岛津仪器有限公司);恒温摇床(MMS−1,东京理化器械株式会社);电子分析天平(EL204,梅特勒−托利多仪器(上海)有限公司);循环—水式多用真空泵(SHZD(III),河南省予华仪器有限公司)。
实验所用的试剂有:纤维状吸附材料Smopex®−102 FG(购买于日本和光纯药工业株式会社),使用前无预处理;硝酸钯(购于阿拉丁,分子式:PdN2·O6·2H2O,18.09%);钯标准溶液;盐酸、硝酸等试剂均为分析纯;实验所用水为超纯水。
1.2 实验方法
采用批次实验法,考察硝酸浓度、接触时间、初始金属离子浓度、温度对静态吸附过程的影响规律,并计算吸附过程中的动力学、吸附等温线、热力学等基本参数。所有的静态吸附实验均在恒温摇床上进行。将0.1 g纤维状吸附材料Smopex®−102 FG与5 cm3含有不同Pd(II)浓度或酸度的硝酸溶液混合于10 cm3玻璃瓶中(固液比恒定为1 g:50 cm3),在恒温摇床上振荡规定时间,真空抽滤,将固体相和液体水相分离开。以原子吸收分光光度计、紫外可见分光光度计分析水相中Pd(II)浓度。Smopex®−102 FG对Pd(II)的吸附分配系数d(cm3/g)、吸附率(%)和吸附量(mmol/g)的计算公式如下:
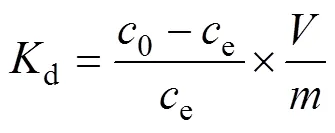
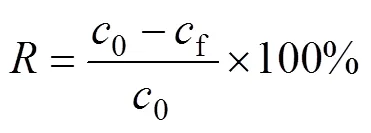
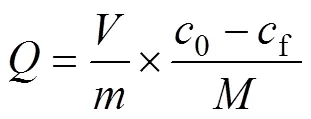
式中:0、f和e分别为吸附前、吸附后以及达到吸附平衡时液相中Pd(II)的浓度,mg/dm3;为吸附材料的质量,g;为用于吸附实验的含Pd(II)溶液的体积,cm3;为Pd的相对分子质量,106.4 g/mol。
2 结果与讨论
2.1 吸附材料的表征
图1(a)和(b)所示分别为不同放大倍数下纤维状吸附材料Smopex®−102 FG的SEM像,图1(c)所示为Smopex®−102 FG的官能团结构式(丙烯酸)。从SEM像中可以清晰地观察到Smopex®−102 FG的形貌呈规则紧密的棱柱状,长度大约为400 um,且形态均匀。Smopex®−102 FG是接枝聚合的聚烯烃类纤维官能团修饰的吸附材料,与一般的玻璃粉状的吸附剂相比较,它在实际应用中不需要特殊的搅拌器,也不会在搅拌过程中影响过滤。因为此吸附材料是纤维状的,所以它的活性官能团均向外伸展,这一优良特性促使其能有效的捕捉水相中的目标金属离子。

图1 纤维状吸附材料Smopex®−102 FG的SEM像和硅团结构式
2.2 HNO3浓度对吸附的影响
HNO3浓度范围为0.001~5 mol/dm3,Pd(II)的初始浓度为5 mmol/dm3,温度为25 ℃,振荡时间为24 h,纤维状吸附材料Smopex®−102 FG对Pd(II)的吸附分配系数d随HNO3浓度的变化如图2所示,在HNO3浓度为0.001 mol/dm3时,Smopex®−102 FG对Pd(II)的吸附分配系数d为142.0 cm3/g。但随着HNO3浓度的增大,d值呈减小趋势。引起这一现象的原因,从吸附材料方面来看[20]:当HNO3浓度值较高时,溶液中必然存在大量的H+,这就使Smopex®−102 FG上的羧基质子化生成—COOH,从而减弱了Smopex®−102 FG与Pd(II)的螯合能力,同时溶液中过多的H+也可能与Pd(II)发生竞争吸附,占据吸附材料上更多地活性位点,当HNO3浓度减小时,羧基更易电离生成—COO−而带负电荷,有利于Pd(II)的吸附;从吸附质Pd(II)方面来看[21],金属离子随HNO3浓度的不断增大,水化程度降低,离子半径减小,表面电势也发生变化,导致Pd(II)与—COOH或—COO−的结合能力也发生相应的变化。以上这些方面的因素分析可能是造成Smopex®−102 FG对Pd(II)的吸附能力在高硝酸浓度下降低的原因。从图2可以看出当HNO3浓度增大到2 mol/dm3时,Smopex®−102 FG对Pd(II)几乎无吸附作用,故高的HNO3浓度不利于吸附过程的进行,但当HNO3浓度过小时,考虑到Pd(II)易沉淀,因此以下实验均采用在0.01 mol/dm3HNO3介质中进行。
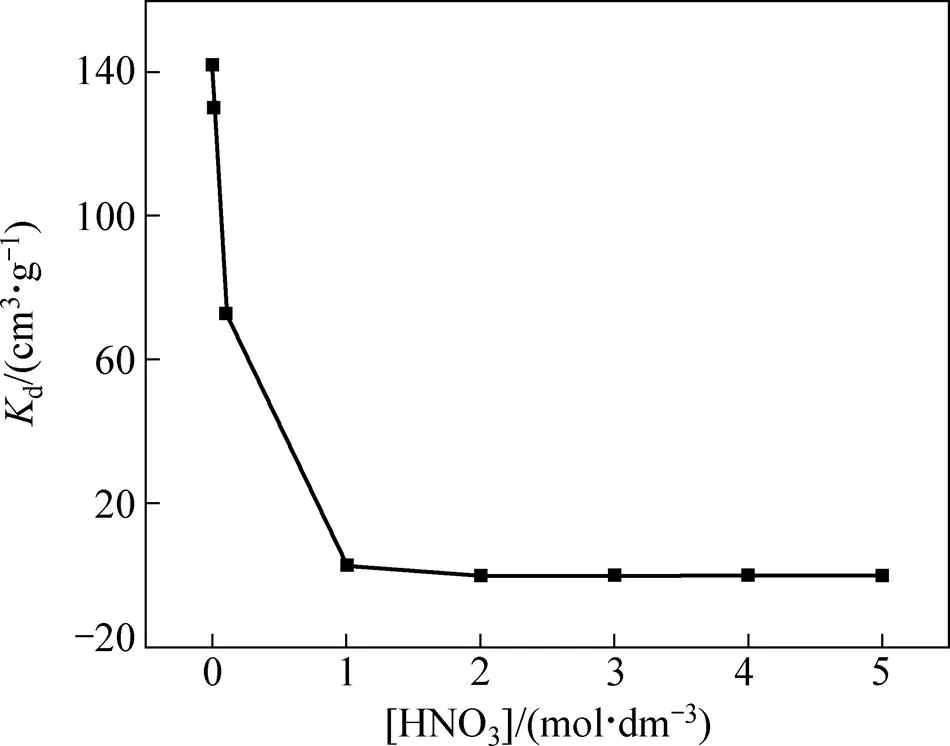
图2 HNO3浓度对纤维状吸附材料Smopex®−102 FG吸附Pd(II)的影响
2.3 吸附动力学研究
2.3.1 接触时间对吸附的影响
接触时间为24 h,温度为25 ℃,Pd(II)的初始浓度为5 mmol/dm3,以Smopex®−102 FG对Pd(II)的吸附率对时间做图,以确定Smopex®−102 FG对Pd(II)的最佳吸附平衡时间,如图3所示,在1~10 min 内Smopex®−102 FG对Pd(II)的吸附率随时间增加而不断增大,这可能是由于在吸附的初始阶段,Smopex®−102 FG的表面存在大量的活性基团,溶液中的Pd(II)能够迅速与吸附材料表面的活性位点结合而被吸附,而在10 min之后,吸附率出现了略微下降的趋势,这可能是由于溶液中H+和Pd(II)之间存在竞争吸附的缘故,当吸附时间到达20 min时,Smopex®−102 FG对Pd(II)的吸附基本趋于平衡,平衡吸附率皆在70%以上,且将吸附时间延长至24 h对吸附率也没有明显影响,这可能是随着吸附时间的延长,Smopex®−102 FG吸附的Pd(II)越来越多,导致其表面的活性位点几乎都被占据,后期的吸附主要是Pd(II)由吸附材料Smopex®−102 FG的外表面向内部扩散的过程,阻力不断增大,吸附速率随之降低,吸附逐渐趋于平衡状态。
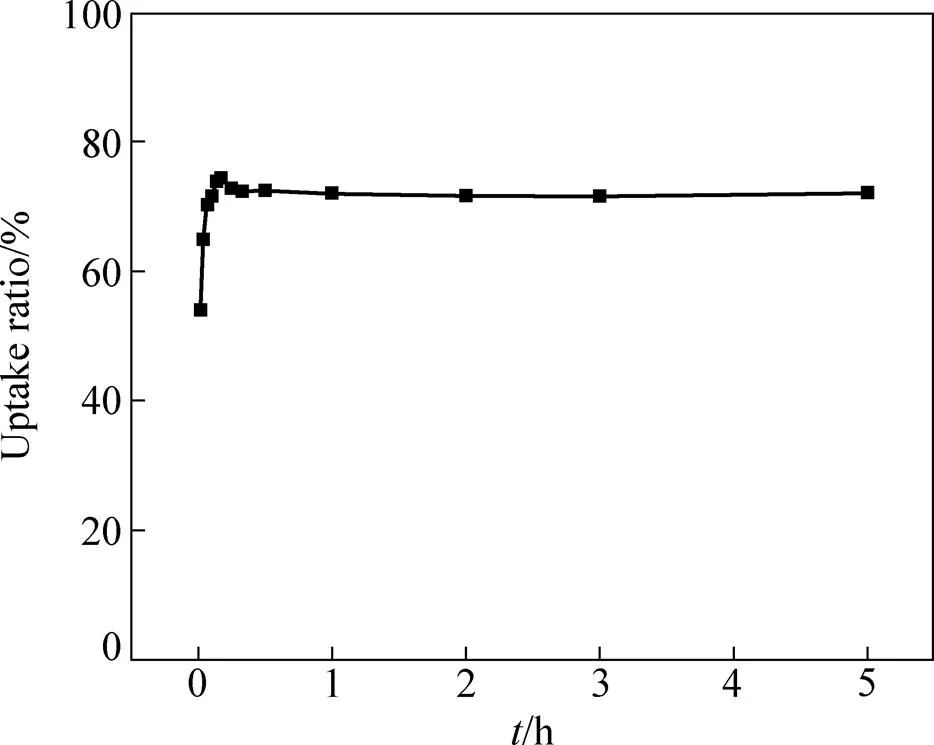
图3 时间对纤维状吸附材料Smopex®−102 FG吸附Pd(II)的影响
2.3.2 吸附动力学模型
动力学研究不但可以预测吸附剂和吸附质之间的动态相互作用、吸附质的迁移规律,而且从获得的动力学数据中可以对吸附机理有一个更深刻的理解。分别采用拟一阶动力学模型[22](见式(4))和拟二阶动力学模型[23−25](见式(5))以及Weber and Morris粒内扩散模型[26−28](见式(6))对Smopex®−102 FG吸附Pd(II)的动力学过程进行模拟。如图4(a)、(b)和(c)所示,具体数据见表1。
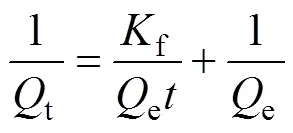
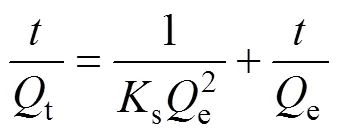

式中:为吸附时间,min;e、t分别为吸附达到平衡时以及时刻Smopex®−102 FG对Pd(II)的吸附量,mg/g;f为拟一阶吸附速率常数,min−1;s为拟二阶吸附速率常数,g/(mg·min);id为粒内扩散速率常数,mg/(g·min0.5);是与边界层、厚度相关的常数,mg/g。
从以上吸附动力学模型的模拟结果可以看出,拟一阶吸附动力学模型和拟二阶吸附动力学模型都具有较高的线性相关性,但与拟一阶吸附动力学拟合结果相比,拟二阶动力学方程的线性相关性更好,其线性相关系数2=0.9999,而且通过拟二阶吸附动力学方程计算出的理论平衡吸附量e=19.74 mg/g与实验值e=19.82 mg/g更为接近,说明拟二阶吸附模型能更真实的描述纤维状吸附材料Smopex®−102 FG吸附Pd(II)的动力学行为,则Smopex®−102 FG的吸附能力与其表面上的活性位点数量成正比,此吸附为化学吸附反应过程。
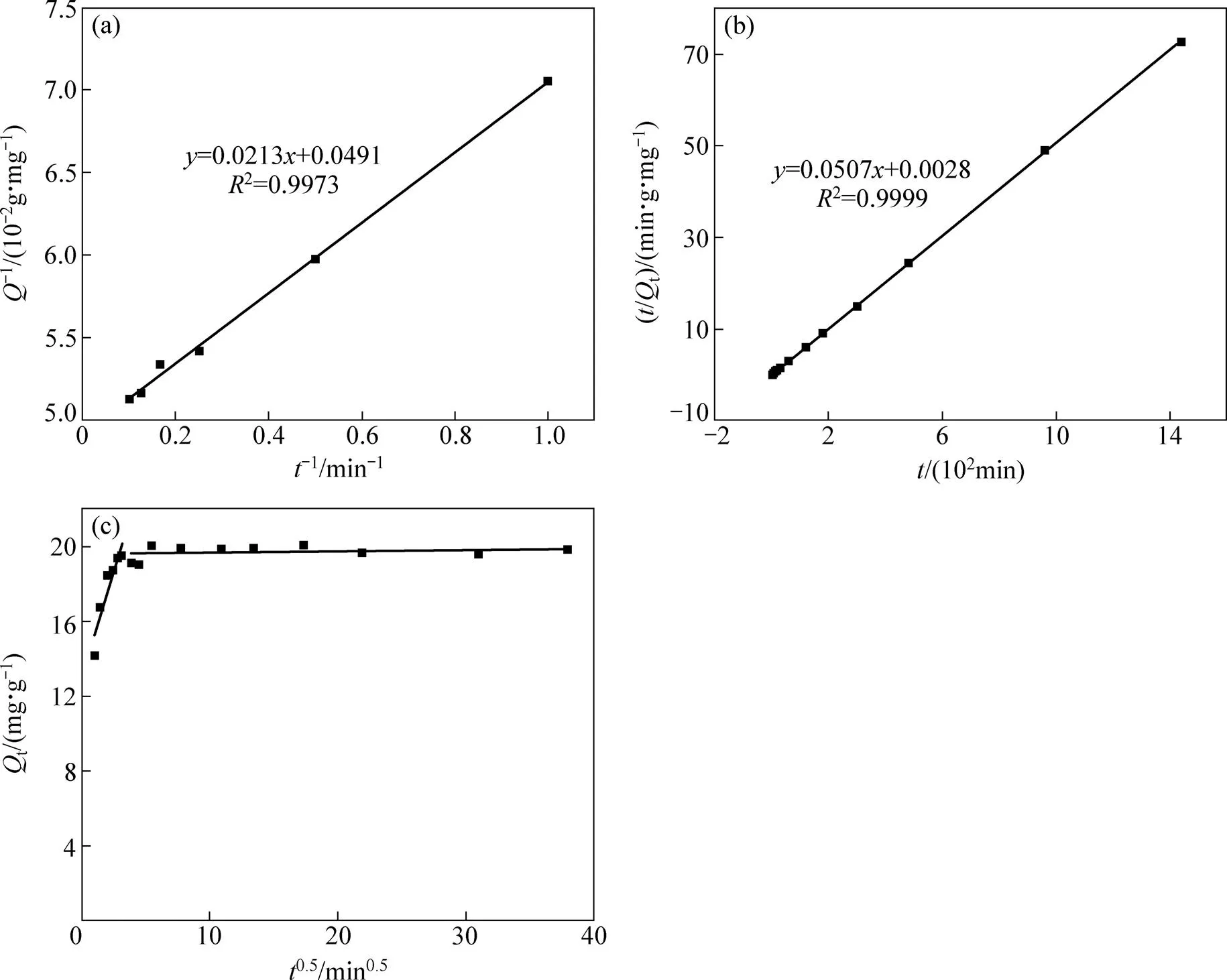
图4 拟一阶、拟二阶吸附动力学拟合曲线以及Weber and Morris粒内扩散模型

表1 动力学模型拟合参数
拟二阶动力学方程不能确定吸附机理,而粒内扩散模型可以用来描述Pd(II)的吸附过程,如图4(c)所示,图形由两条斜率不同的直线组成,显然两条直线分别代表了吸附的两个过程,第一阶段的直线表明Pd(II)扩散到吸附材料Smopex®−102 FG的表面,即为Pd(II)的表面扩散过程,第二阶段的直线表示Pd(II)在吸附材料Smopex®−102 FG内部空隙扩散,即Pd(II)的颗粒内扩散过程。第一阶段直线的斜率(id1=2.288 mg/(g·min0.5))远远大于第二阶段直线斜率(id2=0.0069 mg/(g·min0.5)),表明Pd(II)的表面扩散过程进行的很迅速,而第二阶段的直线基本接近水平,说明此吸附在短时间内就达到平衡,且延长时间对吸附量几乎无影响,这与先前得出的结论是一致的。现假设控制此吸附过程的唯一步骤是颗粒内扩散,那么第二阶段的拟合直线必会通过坐标原点,而从图4(c)中可以看出,直线显然没有通过原点,说明颗粒内扩散过程并不是控制Smopex®−102 FG吸附Pd(II)的唯一步骤,而是由表面扩散和颗粒内扩散共同控制的。
2.4 吸附等温线
2.4.1 初始金属离子浓度对吸附的影响
接触时间为24 h,温度为25 ℃,Pd(II)初始浓度范围为2.5~45 mmol/dm3,纤维状吸附材料Smopex®−102 FG对不同初始浓度的Pd(II)溶液进行吸附实验,Smopex®−102 FG在不同初始浓度下对Pd(II)的平衡吸附量以及对Pd(II)的吸附率如图5所示。从图5中可以看出,随着溶液中初始Pd(II)浓度的不断增大,Smopex®−102 FG对Pd(II)的平衡吸附量呈线性增加趋势,且即使当溶液中初始钯离子浓度达45 mmol/dm3时,Smopex®−102 FG对钯离子的吸附依然没有达到饱和状态,由此可见纤维状吸附材料Smopex®−102 FG对钯离子的饱和吸附量较高;另一方面,吸附材料对Pd(II)的吸附率随溶液中初始Pd(II)浓度的不断增大而降低,由此可见,当溶液中Pd(II)浓度较小时,Smopex®−102 FG可较好地吸附Pd(II)。
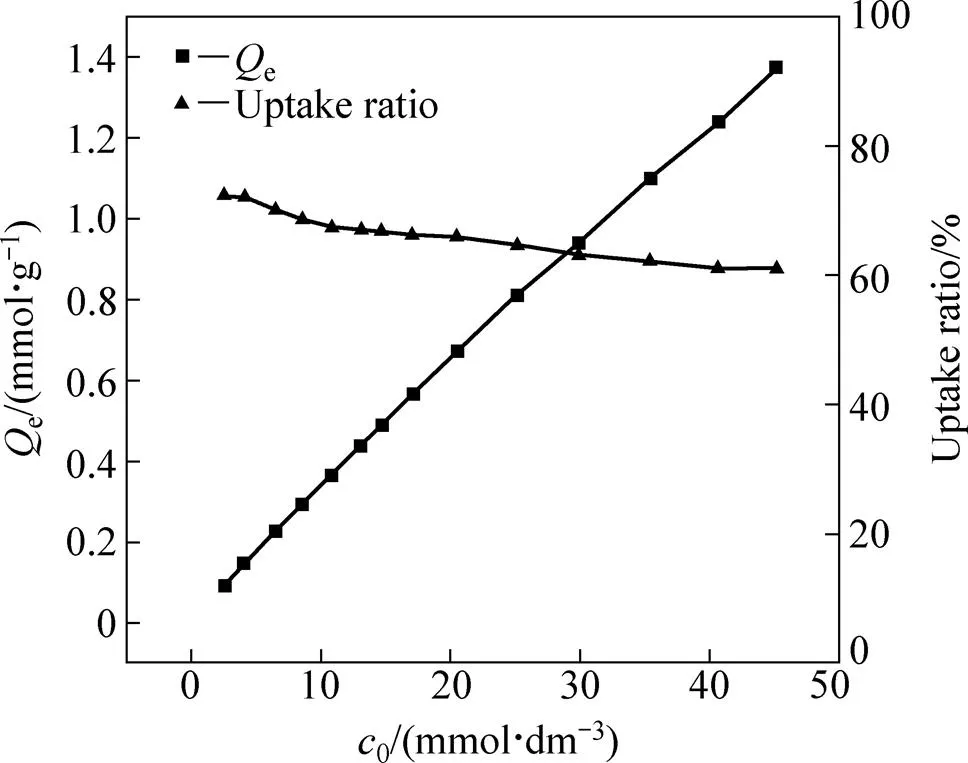
图5 初始金属离子浓度对纤维状吸附材料Smopex®−102 FG吸附Pd(II)的影响
2.4.2 Pd(II)的Freundlich、Langmuir等温吸附模型
采用Langmuir等温吸附模型(见式(7))和Freundlich等温吸附模型[29](见式(8))对等温吸附过程进行拟合,如图6(a)和(b)所示,具体结果见表2。
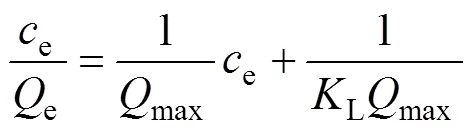
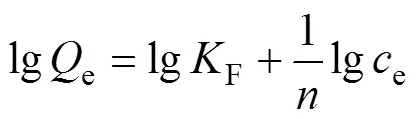
式中:e、max分别为吸附达到平衡时Smopex®−102FG对Pd(II)的吸附量以及Smopex®−102 FG对Pd(II)的理论最大吸附量,mmol/g;e为吸附平衡时液相中Pd(II)的浓度,mmol/dm3;L为Langmuir常数,dm3/mmol;F为Freundlich常数,mmol/g;1/为与吸附能力强弱相关的Freundlich指数常数。
Langmuir等温吸附模型是一个假设吸附发生在均一的表面上,且被吸附的分子之间无相互作用的理想吸附模型;而Freundlich模型是一种主要用于非均质表面吸附的典型多分子层吸附模型。从图6和表2可以看出,Freundlich模型对等温吸附实验数据的拟合结果远优于Langmuir等温吸附模型,其线性相关系数2=0.9990。Smopex®−102 FG对Pd(II)的吸附遵循Freundlich等温吸附模型。1/是与吸附强度相关的参数,当1/小于1时,有利于吸附过程的进行;同时值也常用来判断吸附的优惠性,当大于1时,则为优惠吸附。显然,Smopex®−102 FG对Pd(II)的吸附为优惠吸附。
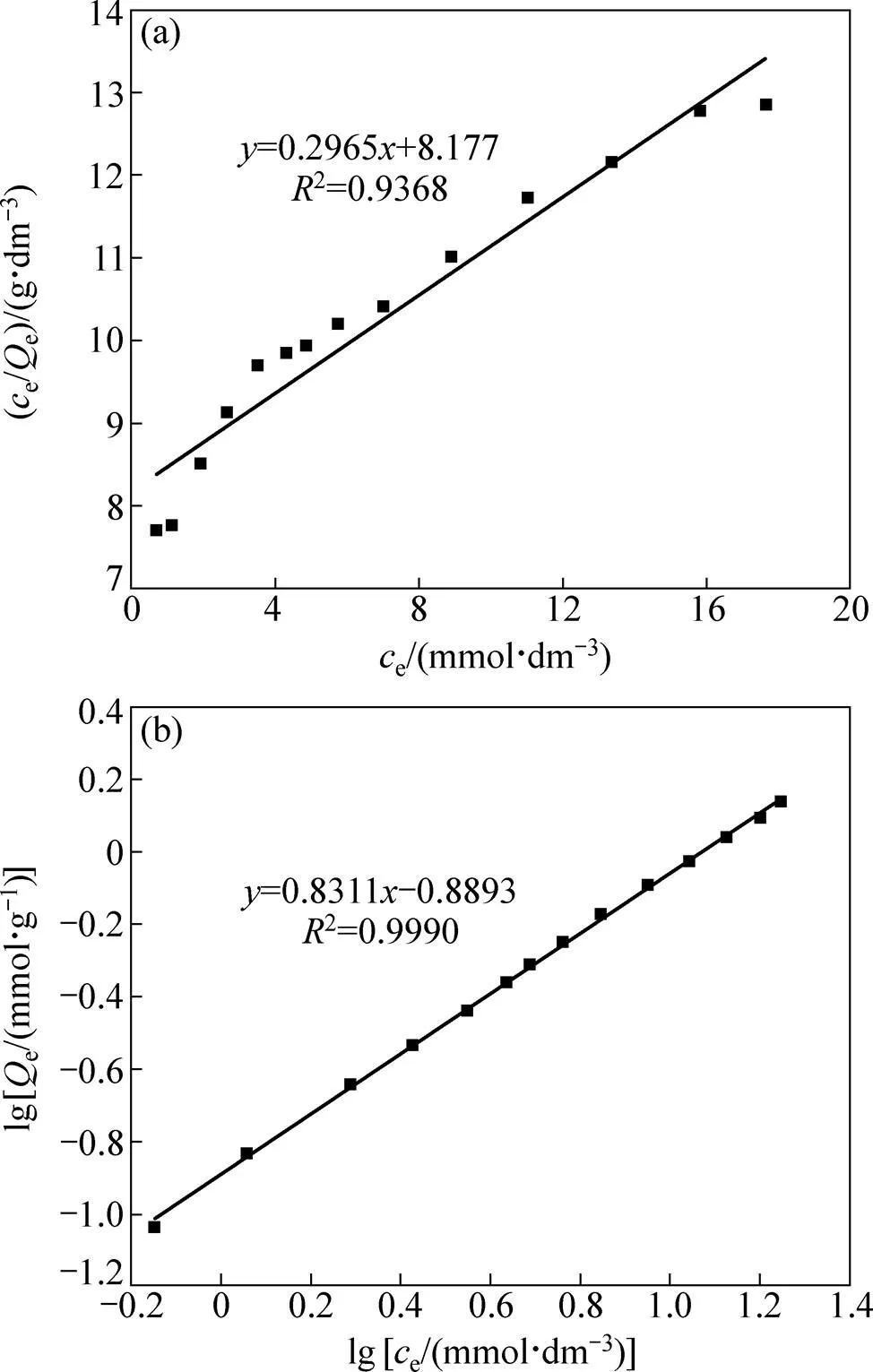
图6 Langmuir和Freundlich等温吸附模型
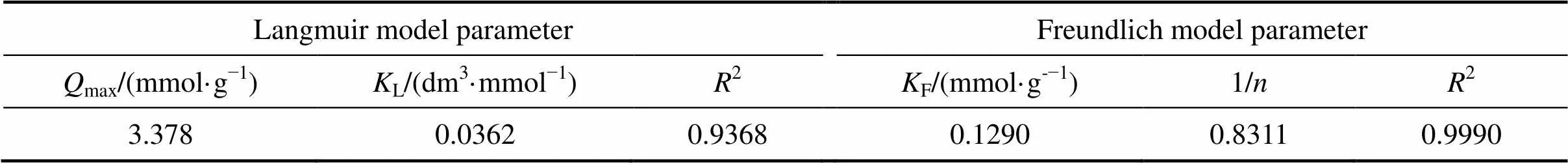
表2 纤维状吸附材料Smopex®−102 FG对Pd(II)的等温吸附方程模拟参数
2.5 吸附热力学研究
接触时间为24 h,Pd(II)初始浓度为5 mmol/dm3,为确定温度对吸附过程的影响,分别在288、293、298、303、308、313、318和323 K温度下进行静态吸附实验。运用范特霍夫方程[30](见式(9))对此热力学过程进行拟合,以lnd对−1作图如图7所示。

式中:Kd为吸附达平衡状态时的分配系数,cm3/g;∆SΘ为吸附过程的熵变,J/(mol·K);∆HΘ为吸附过程的焓变,kJ/mol;R为气体常数,R=8.314 J/(mol·K),T为热力学温度,K。
从图7中可以看出,随着温度的升高,纤维状吸附材料Smopex®−102 FG对Pd(II)的吸附分配系数增加,所以此吸附过程是吸热的。为了对吸附过程的热力学性质有一个更直观的了解,需计算出几个与热力学相关的参数:∆Θ、∆Θ以及∆Θ。∆Θ和∆Θ是根据图7拟合直线的斜率和截距分别求出的;∆Θ是判断一个反应是否自发进行最基本的判据,若∆Θ小于0,说明在给定的温度下,该反应是自发进行的,∆Θ由式(10)[31]计算得到:
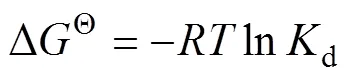
式中:∆Θ为吸附过程的吉布斯自由能变,kJ/mol。吸附过程的热力学参数总结于表3中,从表3中可以看出,∆Θ小于0,说明纤维状吸附材料Smopex®−102 FG对Pd(II)的吸附过程是自发进行的,∆Θ=2.057 kJ/mol,焓变为正值意味着此吸附是一个吸热过程,升高温度有利于吸附进行,但从图7中可以看出,直线斜率较小,说明温度变化对吸附分配系数影响不大,故在常温下Smopex®−102 FG也可较好的吸附Pd(II),∆Θ=47.23 J/(mol·K),表明吸附过程的熵变是增大的。
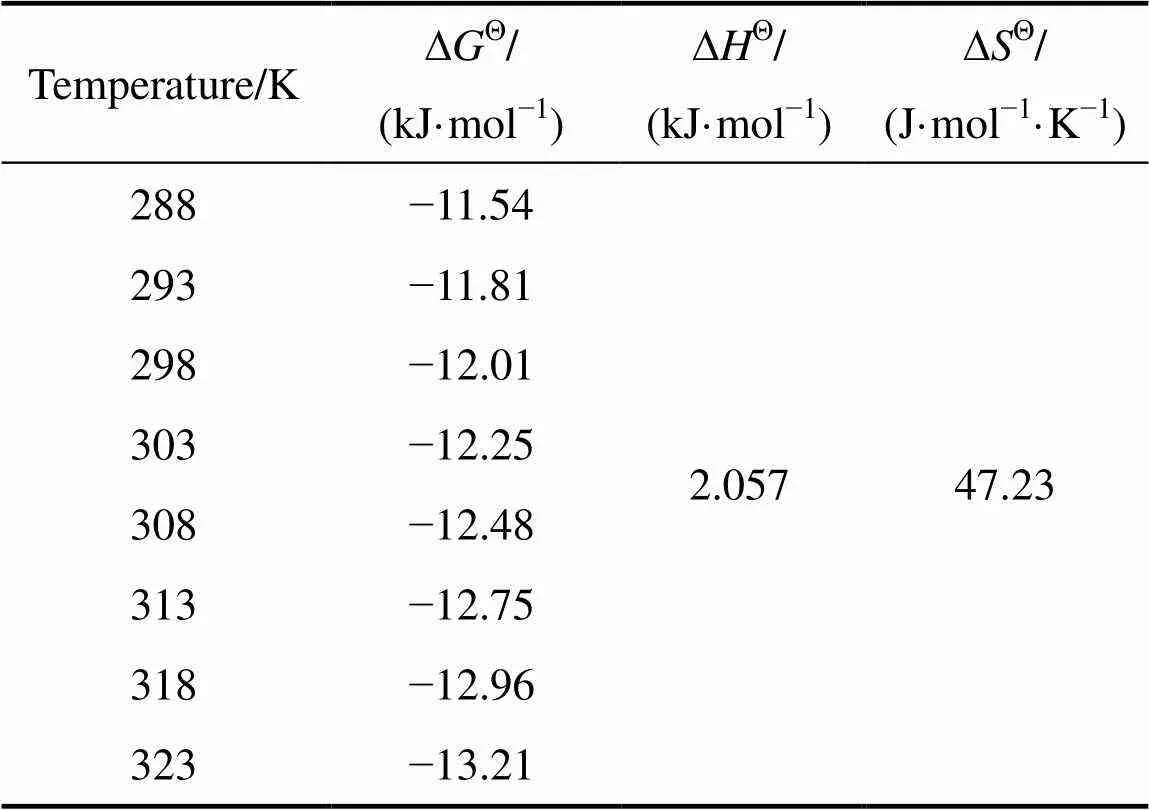
表3 吸附热力学参数
3 结论
1) 纤维状吸附材料Smopex®−102 FG对Pd(II)的吸附性能随HNO3浓度的减小而逐渐增加,在HNO3浓度为0.001 mol/dm3时,Smopex®−102 FG对Pd(II)的吸附分配系数d为142.0 cm3/g,此吸附为一个快速吸附过程,20 min即可达到吸附平衡,平衡吸附率皆在70%以上,且延长吸附时间对平衡吸附率没有明显影响;随着Pd(II)初始浓度的增大,纤维状吸附材料Smopex®−102 FG对Pd(II)的平衡吸附量不断增加,但其对Pd(II)的吸附率却随之降低,因此Smopex®−102 FG更适用于对低浓度Pd(II)的吸附;温度升高,Smopex®−102 FG对Pd(II)的吸附能力增加。
2) 动力学研究表明:纤维状吸附材料Smopex®−102 FG对Pd(II)的吸附行为符合拟一阶和拟二阶动力学模型,分别通过拟一阶、拟二阶动力学方程计算出的理论平衡吸附量为20.33 mg/g、19.74 mg/g与实验值19.82 mg/g非常接近;但拟二阶动力学模型拟合的线性相关性更高(2=0.9999),且理论平衡吸附量与实验值也更加吻合。因此,使用拟二阶动力学模型来描述Smopex®−102 FG吸附Pd(II)的动力学行为更为合适。Smopex®−102 FG的吸附能力与其表面上的活性位点数量成正比,此吸附为化学吸附反应过程;Weber−Morris粒内扩散模型表明:粒内扩散速率常数id1远远大于id2,说明Pd(II)的表面扩散过程进行得很快,更充分地说明此吸附的动力学过程迅速这一事实;粒内扩散模型的拟合直线不通过坐标原点,说明颗粒内扩散不是控制纤维状吸附材料Smopex®−102 FG吸附Pd(II)的唯一步骤,而是由表面扩散和粒内扩散联合控制的。
3) 由等温吸附模型的拟合结果可知,Smopex®−102 FG对Pd(II)的吸附符合Freundlich等温吸附模型,线性相关系数2=0.9990,且大于1,说明此吸附为优惠吸附。热力学数据∆Θ小于0,∆Θ大于0,说明反应过程是吸热自发进行的,升高温度有利于吸附过程的进行,但温度对吸附分配系数影响不大,故在常温下Smopex®−102 FG就可实现对Pd(II)的高效吸附。
4) 本研究为从高放废液中分离出钯离子的工业化生产提供了一种可供选择的新思路和技术指导。
[1] ANDO Y, TAKANO H. Estimation of LWR spent fuel composition[R]. Japan: JAERI-Research 99-004, 1999.
[2] ITO T, KIM S Y, XU Yuan-lai, HITOMI K, ISHII K, NAGAISHI R, KIMURA T. Adsorption behaviors of platinum group metals in simulated high level liquid waste using macroporous (MOTDGA-TOA)/SiO2-P silica-based absorbent[J]. Separation Science and Technology, 2013, 48(17): 2616−2625.
[3] 韦悦周. 国外核燃料后处理化学分离技术的研究进展及考察[J]. 化学进展, 2011, 23(7): 1272−1288. WEI Yue-zhou. Progress and discussion on chemical separation technologies for nuclear fuel reprocessing developed abroad[J]. Progress in Chemistry, 2011, 23(7): 1272−1288.
[4] MOWAFY E A, Mohamed D, Alshammari A. Extraction and separation of selected platinum-group and base metal ions from nitric acid solutions using thiodiglycolamides(TDGA) as novel extractants[J]. Separation Science and Technology, 2015, 50(15): 2352−2359.
[5] Gupta B, Singh I. Extraction and separation of platinum, palladium and rhodium using Cyanex 923 and their recovery from real sample[J]. Hydrometallurgy, 2013, 134/135: 11−18.
[6] 王淑玲. 铂族金属资源的现状及对策研究[J]. 中国地质, 2001, 28(8): 23−28. Wang Shu-ling. Platinum group metals resources present situation and countermeasure research[J]. Chinese Geology, 2001, 28(8): 23−28.
[7] Lee S H, Yoo J H, Kim J H. Ion exchange characteristics of rhodium and ruthenium from a simulated radioactive liquid waste[J]. Korean Journal of Chemical Engineering, 2004, 21(5): 1038−1043.
[8] Dakshinamoorthy A, Dhami P S, Naik P W, Dudwadkar N L, Munshi S K, Dey P K, Venugopal V. Separation of palladium from high level liquid waste of PUREX origin by solvent extraction and precipitation methods using oximes[J]. Desalination, 2008, 232(3): 26−36.
[9] Ozawa M, Suzuki S, Takeshita K. Advanced hydrometallurgical separation of actinides and rare metals in nuclear fuel cycle[J]. Solvent Extraction Research and Development, 2010, 17: 19−34.
[10] Gandhi M R, Yamada M, Kondo Y, Shibayama A, Hamada F. Rapid and selective extraction of Pd(II) ions using the SCS type pincer ligand 1,3-bis(dimethylthiocarbamoyloxy)benzene,and its Pd(II) extraction mechanism[J]. RSC Advances, 2016, 6(2): 1243−1252.
[11] Cieszynska A, Wisniewski M. Extraction of palladium(II) from chloride solutions with Cyphos®IL 101/toluene mixtures as novel extractant[J]. Separation and Purification Technology, 2010, 73(2): 202−207.
[12] Yin Chun-yang, Nikoloski A N, Wang Mei-wen. Microfluidic solvent extraction of platinum and palladium from a chloride leach solution using Alamine 336[J]. Minerals Engineering, 2013, 45: 18−21.
[13] Jha M K, Gupta D, Lee J C, Kumar V, Jeong J. Solvent extraction of platinum using amine based extractants in different solutions: A review[J]. Hydrometallurgy, 2014, 142: 60−69.
[14] Khogare B T, Anuse M A, Piste P B, Kokare B N. Development of a solvent extraction system with 4-heptylaminopyridine for the selective separation of platinum(IV) from catalysts, anticancer injections and water samples[J]. Analytical Methods, 2016, 8(10): 2156−2163.
[15] Tanaka S, Harada A, Nishihama S, Yoshizuka K. Selective recovery of platinum group metals from spent automobile catalyst by integrated ion exchange methods[J]. Separation Science and Technology, 2012, 47(9): 1369−1373.
[16] Nikoloski A N, Ang K L. Review of the application of ion exchange resins for the recovery of platinum-group metals from hydrochloric acid solutions[J]. Mineral Processing and Extractive Metallurgy Review, 2014, 35(6): 369−389.
[17] 贺小塘, 韩守礼, 吴喜龙, 王 欢, 王咏梅. 分子识别技术在铂族金属分离提纯中的应用[J]. 贵金属, 2010, 31(1): 53−56, 69. He Xiao-tang, Han Shou-li, Wu Xi-long, Wang Huan, Wang Yong-mei. Application of molecular recognition technology in platinum group metals refining process[J]. Precious Metals, 2010, 31(1): 53−56, 69.
[18] Xu Yuan-lai, Kim S Y, Ito T, Tokuda H, Hitomi K, Ishii K. Chromatographic separation of platinum group metals from simulated high level liquid waste using macroporous silica-based adsorbents[J]. Journal of Chromatography A, 2013, 1312: 37−41.
[19] KIM S Y, XU Y, ITO T, WU Y, TADA T, HITOMI K, KURAOKA E, ISHII K. A novel partitioning process for treatment of high level liquid waste using macroporous silica-based adsorbents[J]. Journal of Radioanalytical and Nuclear Chemistry, 2013, 295(2): 1043−1050.
[20] 刘宛宜, 杨璐泽, 于 萌, 刘 淼. 聚丙烯酸盐-丙烯酰胺水凝胶的制备及对重金属离子吸附性能的研究[J]. 分析化学, 2016, 44(5): 707−715. Liu Wan-yi, Yang Lu-ze, Yu Meng, Liu Miao. Preparation of poly(acrylate-acrylamide) hydrogel and its adsorption performance to heavy metal ions[J]. Chinese Journal of Analytical Chemistry, 2016, 44(5): 707−715.
[21] 周 琨, 徐宇亮, 李业琛. 带羧基乳液浸渍纸对重金属离子的吸附性能研究[J]. 离子交换与吸附, 2005, 2l(2): 174−178. Zhou Kun, Xu Yu-liang, Li Ye-chen. Studies on heavy metal adsorption of acrylic emulsion impregnated paper[J]. Ion Exchange and Adsorption, 2005, 2l(2): 174−178.
[22] Bai Fei-fei, Ye Gang, Chen Guang-jin, Wei Ji-chao, Wang Jian-chen, Chen Jing. Highly selective recovery of palladium by a new silica-based adsorbent functionalized with macrocyclic ligand[J]. Separation and Purification Technology, 2013, 106: 38−46.
[23] 王 亮, 谢水波, 杨金辉, 曾涛涛, 刘金香. 氧化石墨烯/二氧化硅复合材料对铀(Ⅵ)的吸附性能[J]. 中国有色金属学报, 2016, 26(6): 1264−1271. WANG Liang, XIE Shui-bo, YANG Jin-hui, ZENG Tao-tao, LIU Jin-xiang. Adsorption properties of graphene oxide/silica composite materials for uranium(VI)[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(6): 1264−1271.
[24] 徐 辉, 祁光霞, 孙应龙, 王 煜, 韩小元, 梁 威, 雷雪飞, 张瑞荣, 王 毅. 氨基膦酸改性硅胶吸附分离铂和钯[J]. 原子能科学技术, 2016, 50(7): 1159−1165.Xu Hui, Qi Guang-xia, Sun Ying-long, Wang Yu, Han Xiao-yuan, Liang Wei, Lei Xue-fei, Zhang Rui-rong, Wang Yi. Sorption and separation of platinum and palladium from aqueous solution by aminophosphonic acid functionalized silica[J]. Atomic Energy Science and Technology, 2016, 50(7): 1159−1165.
[25] Xu Yuan-lai, Kim S Y, Ito T, Tada T, Hitomi K, Ishii K. Adsorption properties and behavior of the platinum group metals onto a silica-based (Crea + TOA)/SiO2-P adsorbent from simulated high level liquid waste of PUREX reprocessing[J]. Journal of Radioanalytical and Nuclear Chemistry, 2013, 297: 41−48.
[26] 苏文鹏, 杨益琴, 蒋玲玉, 周 浩, 周永红. 杉木树皮吸附重金属离子性能和动力学研究[J]. 林产化学与工业, 2014, 34(4): 9−15. Su Wen-peng, Yang Yi-qin, Jiang Ling-yu, Zhou Hao, Zhou Yong-hong. Adsorption performance of heavy metal ions by fir bark and its kinetic[J]. Chemistry and Industry of Forest Products, 2014, 34(4): 9−15.
[27] 成芳芳, 孔庆山, 纪 全, 夏延致. 海藻酸纤维对水溶液中Fe3+的吸附动力学研究[J]. 合成纤维工业, 2010, 33(2): 1−4. Cheng Fang-fang, Kong Qing-shan, Ji Quan, Xia Yan-zhi. Adsorption kinetic studies of Fe3+onto alginic acid fiber from aqueous solution[J]. China Synthetic Fiber Industry, 2010, 33 (2): 1−4.
[28] Wang Xiao-liang, Yuan Li-yong, Wang Yan-fei, Li Zi-jie, Lan Jian-hui, Liu Ya-lan, Feng Yi-xiao, Zhao Yu-liang, Chai Zhi-fang, Shi Wei-qun. Mesoporous silica SBA-15 functionalized with phosphonate and amino groups for uranium uptake[J]. Science China Chemistry, 2012, 55(9): 1705−1711.
[29] WANG Yun-yan, YAO Wen-bin, WANG Qing-wei, YANG Zhi-hui, LIANG Li-fen, CHAI Li-yuan. Synthesis of phosphate-embedded calcium alginate beads for Pb(II) and Cd(II) sorption and immobilization in aqueous solutions[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(8): 2230−2237.
[30] Xu Yuan-lai, Kim S Y, Ito T, Tokuda H, Hitomi K, Ishii K. Adsorption behavior of platinum group metals onto a silica-based (Crea+Dodec)/SiO2-P extraction resin from simulated high level liquid waste[J]. Separation Science and Technology, 2015, 50(2): 1−7.
[31] LONG Ya-ling, YU Jin-gang, JIAO Fei-peng, YANG Wei-jie. Preparation and characterization of MWCNTs/LDHs nanohybrids for removal of Congo red from aqueous solution[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(10): 2701−2710.
Adsorption behavior of Pd onto fibrous adsorbent from simulated high level liquid waste
YANG Xin-xin1, 2, XU Yuan-lai1, 2, MA Chen1, 2, GUO Ge1, 2, ZHOU Fang1, 2, CHI Ru-an1, 2
(1. Key Laboratory of Green Chemical Process (Wuhan Institute of Technology), Ministry of Education, Wuhan 430074, China; 2. School of Chemical Engineering & Pharmacy, Wuhan Institute of Technology, Wuhan 430074, China)
Adsorption behavior of Pd(II) on fibrous Smopex®−102 FG adsorbent was investigated in order to separate and enrich Pd(II) from simulated high level liquid waste. Effects of HNO3concentration, contact time, initial metal ions concentration and temperature on adsorption of Pd(II) using Smopex®−102 FG were investigated in HNO3solution, as well as the adsorption characteristics from both kinetics and thermodynamics. The results show that distribution coefficient (d) of Pd(II) increases with the decrease of HNO3concentration anddis 142.0 cm3/g in 0.001 mol/dm3HNO3solution. Pd(II) is absorbed with a rapid kinetics, and reached equilibrium state within 20 min, uptake ratio of Pd(II) is more than 70%. Adsorption behavior is fitted well with the kinetics model of pseudo-first-order and pseudo-second-order, controlled by the combination of film diffusion and intraparticle diffusion. Value of theoretical equilibrium adsorption capacity is similar to measured (e=19.82 mg/g). At the same time, the equilibrium adsorption amount increases but uptake ratio decreases with the increase of initial metal ion concentration. This adsorption process can be described well by Freundlich isothermal model which is a favorable adsorption. From adsorption thermodynamic parameters, it is a spontaneous endothermic process and high temperature is better for adsorption. Fibrous Smopex®−102 FG adsorbent will be a promising adsorbent using in partitioning of palladium from high level liquid waste.
palladium; fibrous adsorbent; high level liquid waste; static adsorption; kinetics; thermodynamics
Project(51404172) supported by the National Natural Science Foundation of China; Project (2013CFB317) supported by the Natural Science Foundation of Hubei Province, China
2017-06-23;
2018-01-06
XU Yuan-lai; Tel: +86-027-87194980; E-mail: xuyuanlai@163.com
10.19476/j.ysxb.1004.0609.2018.07.19
1004-0609(2018)-07-1453-09
TQ028.3;TL241.1
A
国家自然科学基金资助项目(51404172);湖北省自然科学基金资助项目(2013CFB317)
2017-06-23;
2018-01-06
徐源来,特聘教授,博士;电话:027-87194980;E-mail:xuyuanlai@163.com
(编辑 何学锋)
