纤维素降解菌的分离筛选及对中药废弃物的固相发酵研究
2018-08-23上官亦卿贾凤安
常 帆,上官亦卿, 吕 睿, 丁 浩, 贾凤安
(陕西省微生物研究所 微生物代谢产物研究中心,陕西 西安 710043)
木质纤维素(Lignocellulosic biomass)是一类高分子结构复杂的生物质[1],其中纤维素、半纤维素和木质素是木质纤维素类物质的主要的三种组分,其中纤维素分子通过氢键形成牢固的网状结构,有些与木质素交联在一起,难以转化利用。现已发现自然界中包括细菌、真菌、放线菌等多种微生物对木质纤维素类物质有降解作用[2-4],而利用不同微生物组成功能菌系联合降解木质纤维素类物质是当今研究的热点[5-6]。中药废弃物(Chinese medicinal herbal residues)主要来源于中药材的加工、炮制、提取等过程[7-8],非入药部位通常归为废料简单丢弃或焚烧。而中药废弃物中富含木质纤维素类物质,同时还含有多糖类、蛋白质、脂类、黄酮类、生物碱以及多种微量元素等大量可再利用的营养成分[9],利用固相发酵手段发挥微生物对木质纤维素类的生物降解作用,增加中药废弃物活性成分的释放,充分利用中药药渣的生物质资源,是解决提高中药废弃物精细高值化利用的新思路。本研究筛选到16株对纤维素有降解效果的菌株,对8株有明显作用的菌株的纤维素酶活性进行了初步研究,并以中药废弃物为基质,利用5株细菌、3株真菌固相发酵检验其降解木质纤维素的效果,为之后的菌系构建和联合降解提供研究基础,同时为利用中药废弃物生产生物有机肥料和微生物饲料提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 中药废弃物:来源于陕西中医医院;土壤样本:来源于陕西省微生物研究所采自陕西境内各种生境的土壤;引物为北京六合华大基因科技有限公司合成。
1.1.2 培养基(g/L) ①营养琼脂培养基(NA):牛肉膏3.0,蛋白胨10.0,NaCl5.0,琼脂15.0, pH 7.3;②富集液体培养基:滤纸片20 g,(NH4)2SO41.4,K2HPO42.0,MgSO40.3,MnSO41.6,CaCl20.3,FeSO45.0 mg/L,ZnCl21.7 mg/L,pH 5.5;③赫奇逊固体培养基:KH2PO4l.0,MgSO4·7H2O 0.3,NaCl 0.1,FeCl20.01,CaCl2·H2O 0.1,NaNO32.5,琼脂15.0。倒平板后在平板上覆盖灭菌圆形滤纸片;④羧甲基纤维素培养基:CMC-Na 15.0,K2HPO4l.0,NH4NO3l.0,MgSO4·7H2O 0.5,NaCl 0.5,琼脂15.0;⑤刚果红培养基:CMC-Na 2.0,(NH4)2SO42.0,K2HPO41.0,MgSO4·7H2O 0.5,刚果红0.4,琼脂15~20,pH 7.0。以上使用试剂均为分析纯,上述培养基及材料均经过121 ℃灭菌30 min后待用。
1.2 方法
1.2.1 纤维素降解菌的生物富集及筛选 称取5 g土壤样品,加入富集液体培养基中,30 ℃ 180 r/min振荡培养富集2 d。富集培养后样品进行梯度稀释后从10-3~10-7倍的稀释液中各取0.1 mL,涂布于羧甲基纤维素培养基,30 ℃ 180 r/min培养3 d,每隔24 h观察菌落生长情况。然后挑取对羧甲基纤维素培养基中滤纸能够降解的菌落,-80 ℃保存。将菌种接种于NA中活化后点接于羧甲基纤维素培养基上,30 ℃培养2~4 d,0.5 g/L刚果红染色5 min,1 mol/L 的NaCl溶液7~10 mL脱色30 min。以透明圈的直径计算CMC酶的相对活性。利用3,5-二硝基水杨酸法(DNS法)测定β-葡聚糖苷酶活力(CMCase)。以1 mg酶每分钟催化纤维素水解生成葡萄糖微克数定为一个活力单位。计算方法如下:

N:酶液稀释倍数;T:糖化所用时间;1:反应酶液mL数。
1.2.2 纤维素降解菌的鉴定 对获得菌株纯培养后,提取DNA,然后进行PCR扩增。菌株的分子生物学鉴定:对获得的菌株纯培养后进行菌落 PCR。鉴定细菌所用的特异性通用引物27f (5′-AGAGTTTGATCCTTGGCTCAG-3′)和 1492r (5′-ACGGTTACCTTACGACTT-3′)进行菌落PCR扩增 16S rDNA基因。反应体系(25 μL):2×PCR 缓冲液12.5 μL,无菌水11 μL,引物各1 μL,模板挑肉眼可见单克隆。PCR扩增条件:94 ℃预变性10 min ,94 ℃变性1 min,50 ℃退火45 s,72 ℃延伸1.5 min,35个循环,72 ℃延伸3 min,PCR产物于4 ℃下存放。反应产物琼脂糖凝胶电泳检测合格后,送六合华大基因公司测序。鉴定真菌所用的特异性引物NL1 (5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩增26S rRNA基因反应体系(50 μL):2×PCR Buffer 25 μL,无菌水22 μL,引物各1 μL,模板菌体肉眼可见。PCR扩增条件:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,35个循环后72 ℃延伸3 min,产物于4 ℃下存放。反应产物琼脂糖凝胶电泳检测合格后,送六合华大基因公司测序。
1.2.3 降解细菌固态发酵中药废弃物的效果实验 上述筛选到的微生物按5%的比例接种于NA中,培养2~5 d,在中药废弃物中添加5%的豆粕作为补充氮源,将种子液按10%比例分别接种于中药废弃物中。取若干塑料盒,并在其侧面开设通风孔,确保中间的位置可以插入温度计。取适量中药废弃物,接入菌体后,进行浅盘发酵,每间隔一天分别读取堆体温度、pH、含水量。上述实验结果均利用Office Excel 2010和GraphPad Prism 5软件作图并分析。
2 结果与分析
2.1 纤维素降解菌的筛选
将初筛获得的菌株进行刚果红染色(图1),可以发现有菌株产生了明显的透明圈,且透明圈大小不一,提示不同菌株对纤维素降解效果有强弱。
以细菌透明圈直径平均值/菌落直径平均值>2 cm、真菌透明圈直径平均值/菌落直径平均值>1 cm为标准,筛选得到7株高效纤维素降解细菌(表1)。可以看到7株细菌对纤维素降解效果较强,其中1#、2#、5#、8X01、13X03效果较好,除1#外透明圈直径平均值/菌落直径平均值均高于3(1#为2.92),透明圈直径和菌落直径均较大;同时真菌的降解效果较弱,多数真菌随菌丝体长势降解纤维素,透明圈直径平均值/菌落直径平均值接近1;其中7z02、8z02、18z02菌株分泌纤维素酶类至固体培养基中,降解效果较明显。说明细菌利用培养基中纤维素并生长旺盛,而真菌因生长周期的缘故降解较慢。
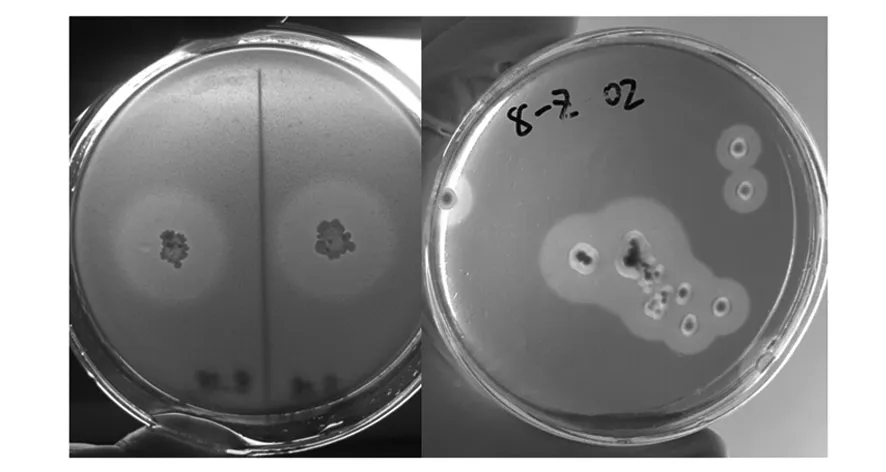
图1 纤维素降解细菌、真菌的筛选Fig.1 Degradation of cellulose degradation bacteria and fungi
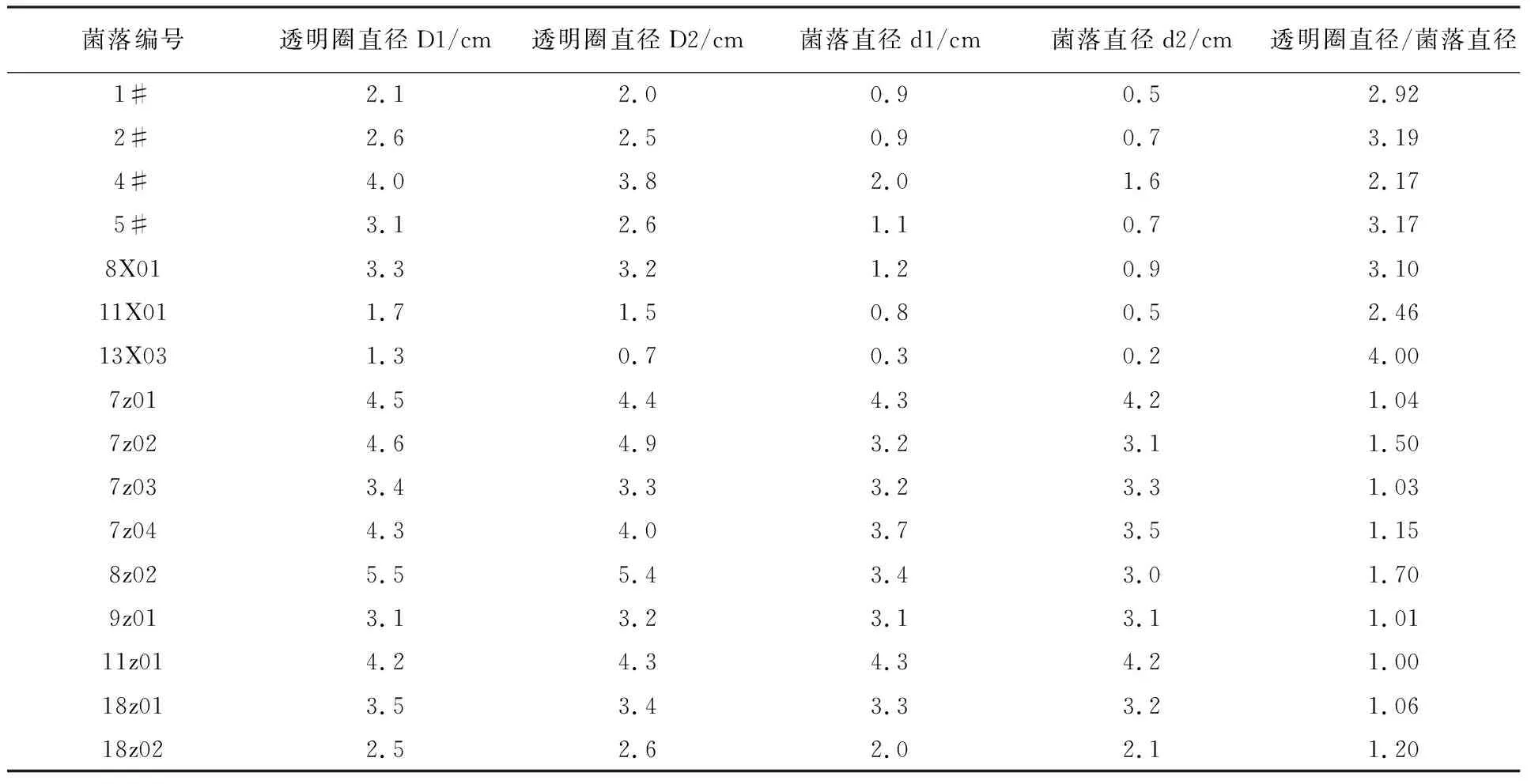
菌落编号透明圈直径D1/cm透明圈直径D2/cm菌落直径d1/cm菌落直径d2/cm透明圈直径/菌落直径1#2.12.00.90.52.922#2.62.50.90.73.194#4.03.82.01.62.175#3.12.61.10.73.178X013.33.21.20.93.1011X011.71.50.80.52.4613X031.30.70.30.24.007z014.54.44.34.21.047z024.64.93.23.11.507z033.43.33.23.31.037z044.34.03.73.51.158z025.55.43.43.01.709z013.13.23.13.11.0111z014.24.34.34.21.0018z013.53.43.33.21.0618z022.52.62.02.11.20
2.2 纤维素降解菌的复筛
在赫奇逊培养基中培养不同时间,利用DNS法检测不同菌株在不同时间的纤维素酶活性,在540 nm的光吸收值对标准曲线计算,即可确定还原糖产生的量,用以确定以下酶活力单位。可以发现,与初筛结果相似,细菌在培养初期就展现较高的CMCase活性,而随着培养时间的增加,不同菌株展现出不同的产纤维素酶能力,其中细菌1#、2#、5#、13X03随着培养时间的增加酶活不断增加;而细菌4#、11X01随着培养时间达到4 d后,酶活开始下降;细菌8X01在培养2 d后酶活一直持续在一定水平。4 d时1#菌CMCase酶活最强,达到1 560.5 u/mL。发现细菌1#、2#、5#和13X03在生长过程中,纤维素酶活力一直在升高,在4 d时1#和5#的CMC酶活性明显高于其他菌株。而菌株在培养过程中CMCase的变化也提示在降解纤维素类物质的过程中应发挥不同菌株的特性联合降解。

图2 细菌CMCase活性随培养时间的变化Fig.2 The results of bacterial CMCase activity changes with culture time
图3为真菌培养时CMCase活性变化情况。因真菌生长周期较长等因素,影响真菌产纤维素能力,但5 d后各真菌纤维素酶产酶活性均高于3 d,其中7z02、8z02、18z02三株真菌在5 d时表现出较高的酶活力和较快的产酶变化率。

图3 真菌CMCase活性随培养时间的变化Fig.3 The results of fungalCMCase activity changes with culture time
2.3 纤维素降解菌的鉴定
将酶活较高的不同菌株(细菌:1#、2#、5#、8X01、13X03;真菌:7z02、8z02、18z02)PCR产物送华大基因测序,得到不同的测序序列,用Blast程序比对,得到序列同源性达到99%的鉴定结果,见图4。
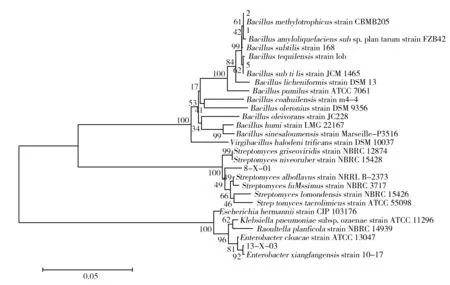
图4 降解纤维素细菌系统进化树Fig.4 Phylogenetic tree of lignocellulolyticbacteria
由图4可知,1#、2#、5#均为Bacillus属,其中1#、2#可能为Bacillusmethylotrophicus,而5#可能为Bacillussubtilis。因Bacillus属种间进化关系非常相近,所以需要利用脂肪酸代谢、DNA杂交等手段进一步确定其进化关系。Bacillus降解纤维素类物质的相关报道很多[10-11],部分是由肠道系统分离得到的[12],本研究由土壤中分离到纤维素降解菌,因缺乏腐殖质的新造土壤为原生环境,利用潜力较大。8X01菌株经鉴定为Streptomyces属,可以看到其与Streptomycesgriseovifidis和Streptomycesniveoruber聚为一簇,提示可能属于其中的一种;报道发现Streptomyces属除产生多种抗生素外,还能产生纤维素酶类物质[13],在原始森林土壤中也发现大量Streptomyces属放线菌,提示在腐殖质丰富的基质中放线菌也拥有潜在的作用。13X03菌株与Enterobacter属最为接近,Enterobacter属与Klebsiella属有较近的亲缘关系,Raoultella属是Klebsiella属的分支;Enterobacter属对纤维素半纤维素类物质的降解作用相关研究早有报道[14-15],Manfredi 等[16]在昆虫肠道中分离出45株具有较强降解能力的菌株,发现Enterobacter属是降解菌中比较大的一个类群。且Enterobacter属已被应用于构建纤维素发酵菌系[17]的相关研究中。
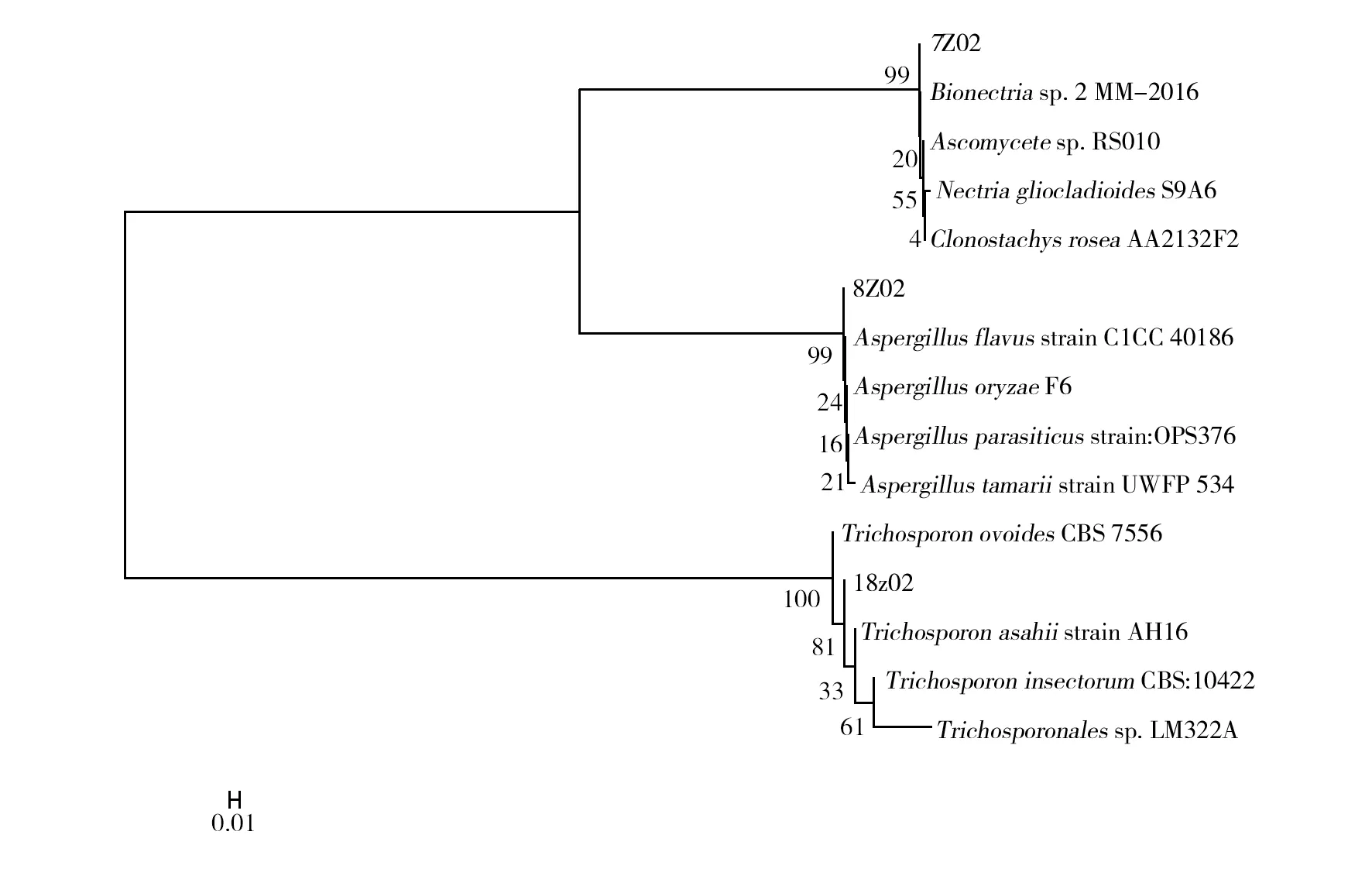
图5 降解纤维素真菌系统进化树Fig.5 Phylogenetic tree of lignocellulolyticfungus
真菌鉴定结果见图5,由图5可以看出7z02与Ascomycete属、Nectria属较为接近,Ascomycete属具有分泌纤维素酶的能力[18-19],是纤维素降解菌系的主要类群之一,Nectria属不仅能分泌纤维素酶类,还能利用氨基酸进行代谢[20]。8z02经鉴定建树发现其与Aspergillus属最接近,亲缘关系达到99%以上;曲霉对纤维素降解的研究是近年来的研究热点[21-22],其中利用曲霉[23]降解纤维素的机制和提高降解效率研究是当今重点问题。本研究中筛选出的8z02菌株降解效率较强,同时能长时间维持较高的纤维素酶活性,有一定的开发利用价值。18z02菌株与Trichosporon属亲缘关系达99%以上,Trichosporon属报道发现其与其他细菌、真菌组成降解菌系联合降解纤维素类物质[24],并能富集蛋白。
2.4 降解细菌固态发酵中药废弃物的效果
利用分离出的有纤维素降解能力的微生物,不同细菌、真菌单独添加10%(体积分数)后对中药药渣发酵腐熟的效果不同。细菌对中药废弃物发酵过程中温度、pH的变化见图6。可以看到发酵的4 d,相比中药废弃物在自然腐熟(CK组),接入降解功能菌株的堆体均有不同程度的升温,其中1#和13X03菌株达到48 ℃,pH也下降至6.3。但4 d后堆体温度均开始下降,同时pH变化波动较小,说明细菌对中药废弃物腐熟过程作用较小,在前期首先利用中药废弃物中速效C、N源快速生长。

图6 细菌固相发酵中药废弃物温度和pH变化Fig.6 Temperature and pH changes of bacterial Chinese medicinal herbal residuessolid fermentation
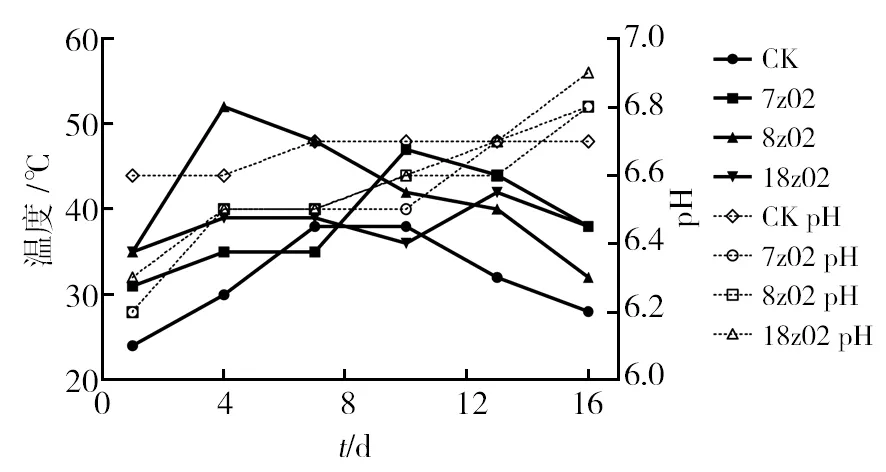
图7 真菌固相发酵中药废弃物温度和pH变化Fig.7 Temperature and pH changes of fungal Chinese medicinal herbal residuessolid fermentation
利用真菌分泌的纤维素酶系和自身菌丝体的延伸作用,真菌对纤维素类物质降解效果要远大于细菌。从图7可见,不同菌株对于固态发酵纤维素类含量较多的中药废弃物效果是不同的。中药废弃物在自然腐熟的状态下(CK组),温度缓慢上升,7~10d达到最高温度28 ℃,之后自然下降至22 ℃。相对于CK组,8z02的曲霉属菌株在发酵4 d时堆体温度可达到52 ℃,是筛选到的纤维素降解菌株中最高的,之后缓慢下降,16 d时仍保持堆体温度达32 ℃,同时pH缓慢上升至6.8,与发酵过程氧气消耗较快,堆体进入氨化过程有关。7z02菌株发酵后期10 d时温度达到47 ℃,发酵腐熟后期16 d仍保持38 ℃。18z02菌株虽发酵温度上升较慢发酵最高温度较低,但在发酵中后期其他堆体温度下降的情况下仍能上升至42 ℃。pH在发酵过程中均有不同程度的上升,这与堆体未进行翻堆,堆体内部缺氧造成的氨化作用有关,应在腐熟过程中进行翻堆作业并保持通风。固相发酵过程中堆体温度和pH是发酵腐熟的关键,本研究发现不同菌株对堆体发酵温度的作用各有差异,提示可利用其建立发酵菌系,提高腐熟效率。
堆体温度在一定程度上可以反映出微生物菌剂对堆肥进程的影响,随着时间的增加,有机物渐渐降解,微生物数量下降,代谢活动减弱,堆体温度也逐渐达到室温,堆肥进入腐熟阶段。pH是堆肥中微生物生长的关键影响因素之一。在整个堆肥进程中,堆料的pH值增加,可能表示堆料中有机物易降解蛋白含量较大,被微生物利用分解为碱性氨气,导致氨气大量释放所致;堆料的pH值下降,可能表示堆料中有大量有机质的分解产生有机酸,有机酸的大量积累导致堆料pH值逐渐降低。
3 讨 论
目前我国中药材年产量约7 500万t[9],而生产加工过程中产生的中药固体废弃物近50%~70%[7]。通过微生物的发酵作用,转化中药废弃物是实现中药废弃物高值化利用的有力手段;基于生物发酵技术的中药废弃物开发,是解决中药废弃物造成的生态环境问题和中药资源开发合理化应用的新方式。但由于微生物发酵过程中对菌株或菌群的筛选、中药废弃物来源多样性和发酵工艺的稳定性、安全性等问题,仍需要更深层次的探索。本研究筛选到8株对木质纤维素类物质有明显降解效果的菌株,经鉴定分别为在木质纤维素降解中能单独或配合发挥较强作用的菌株,在单独固相发酵中药废弃物过程中发挥了显著作用,对发酵过程中堆体温度和pH等参数提高明显,对加速中药废弃物转化腐熟起到关键作用。同时发现不同的微生物对堆体腐熟效果也有区别,在后续的研究中应利用其各自优势形成降解细菌-真菌的微生态菌系,增强降解效应。