应用ELISA和ELFA定量检测牛奶中葡萄球菌肠毒素A方法的建立
2018-08-23沈菊泉胡洁云严维凌
沈菊泉, 欧 杰, 林 露, 陈 敏, 王 婧, 胡洁云, 严维凌*
(1.上海市食品研究所,上海 200235; 2.上海海洋大学 食品学院,上海 201306;3.上海市疾病预防控制中心,上海 200336)
金黄色葡萄球菌(Staphylococcusaureus,以下简称金葡菌)在全球范围内都是一种常见的食源性致病菌,其产生的肠毒素(Staphylococcal enterotoxins,SEs)是主要的致病因子,迄今为止已发现有超过20种的葡萄球菌肠毒素。葡萄球菌肠毒素分子量约为26~30 kDa的蛋白质,具有耐热、耐酸和耐蛋白酶等特点[1-3]。在已发现的肠毒素中,肠毒素A(SEA)最常见[2-4]。 包括中国和欧盟在内的多数国家和地区,相关标准对食品中的葡萄球菌肠毒素仅需进行定性检测[5-6],因此目前商业化的肠毒素检测试剂盒也都只有定性检测功能。然而,随着食品安全定量风险评估研究的深入,需要对肠毒素产生的剂量进行定量已成为趋势,即从定性研究逐步发展到定量研究,特别是近年来发现的具有高产毒能力的金葡菌菌株[7],可能对研究由金葡菌引起的重大食源性疾病爆发具有重要的意义,肠毒素的定量检测方法则成为开展相关研究必须具备的技术手段。在目前尚无成熟的定量检测方法被开发出来之前,利用已有的定性检测方法特别是商业化试剂盒,建立方便可靠的定量检测手段,不失为一种应急的途径。 目前,葡萄球菌肠毒素的检测方法有分子生物学方法(PCR、RT-qPCR、LAMP)[8-9]、免疫学方法和色谱质谱法等。分子生物学方法仅能检测是否具有肠毒素基因,并不能证明是否有肠毒素的表达;色谱质谱法在大分子蛋白质检测上尚存在许多难点,因此该方法虽有前途但目前还不成熟;生物传感器法[10]也已有报道可用于葡萄球菌肠毒素的检测。迄今为止,基于免疫学原理开发的肠毒素检测技术是相对最为成熟的方法,国内外已经有很多的研究报道[11-15],但真正的商业化产品却不多。目前市场上可供应的产品主要有基于双抗体夹芯ELISA方法的Tecra SEs SET、Ridascreen SET和TRANSIA PLATE,基于酶联荧光(ELFA)原理的Vidas SET2以及基于乳胶凝集原理的SET-RPLA[15]。其中双抗体夹芯ELISA和ELFA的检测结果以颜色或荧光强度表示,其颜色或荧光强度在一定范围内与底物浓度相关,因此在原理上有可能建立起定量检测方法。然而到目前为止,虽然对于这两种方法用于肠毒素定性检测的验证和比较已经有相关的报道[16],但对于这两种方法在用于肠毒素定量检测方面的研究及分析比较,国内外至今尚无这方面的研究报道。为了方便快捷地建立起食品中葡萄球菌肠毒素的定量检测手段,本研究选择了基于双抗体夹芯ELISA原理的Tecra SEs SET和基于ELFA方法的Vidas SET2这两种肠毒素检测试剂盒,分析研究两者用于定量检测肠毒素A(SEA)的可行性,这两种试剂盒都符合AOAC相关标准[17-18],可以定性检测食品中是否存在A、B、C1、C2、C3、D和E这七种常见肠毒素(但不能进行分型)。实验对这两种试剂盒在定量检测SEA时的检出限、校正曲线范围和回收率等指标进行了分析比较,为有关实验室建立肠毒素定量检测手段提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 产肠毒素A(SEA)的金黄色葡萄球菌株SA14966,保藏于上海市食品研究所。
1.1.2 培养基 LB培养基,北京陆桥技术股份有限公司。
1.1.3 试剂及仪器 全脂牛奶(950 mL装,光明优倍);高纯度葡萄球菌肠毒素A(SEA)标准品(AT101,Toxin Technology公司); Tecra SEs SET葡萄球菌肠毒素微孔板法试剂盒(3M公司);Vidas SET2葡萄球菌肠毒素检测试剂盒(Biomérieux公司);Multiskan FC酶标仪(ThermoFisher公司);全自动荧光免疫分析仪(mini Vidas, Biomérieux公司);5430R高速离心机(Eppendorf公司);H-2050R高速冷冻离心机(湘仪公司)。
1.2 方法
1.2.1 校正曲线的绘制及检出限的确定 肠毒素A标准品配置成浓度为50 μg/mL的母液,冻藏,使用时用一级超纯水进一步稀释定容成100 ng/mL的工作母液备用。①Tecra SEs SET法:根据Tecra SEs SET的使用说明[17],牛奶无需预处理,可直接加反应液显色检测。因此本研究直接采用全脂牛奶作为基质,加入毒素工作母液配置成毒素浓度为0、0.25、0.50、1.0、2.5、5.0、10 ng/mL等7个浓度水平的标准溶液。待测样品按说明书要求分别添加反应液及相关程序操作,反应物用酶标仪检测(414±10)nm处的吸光度(AV值),重复6次。根据检测结果绘制校正曲线。②Vidas SET2法:根据Vidas SET2使用说明[18],牛奶需除蛋白质后再上机检测。本研究按要求使用5 mol/L HCl调整全脂牛奶pH值至4.0,于18~25 ℃静置15~30 min,将悬浊液于18~25 ℃采用3 000~5 000 g离心15 min,将上清液通过浸湿的棉花压出,使用1 mol/L氢氧化钠调整滤液pH至7.5~8.0之间。将经预处理获得的滤液作为基质,加入毒素工作母液配置成毒素浓度为0、0.125、0.25、0.50、1.0、2.5和5.0 ng/mL等7个浓度水平的标准溶液,然后按使用说明的要求送入mini Vidas检测。检测结果为样品和标准物质相对荧光值的比值,以TV值表示,重复6次。根据检测结果绘制校正曲线。根据校正曲线,计算出AV或TV值达到阳性临界值所需的SEA浓度,即为检出限。
1.2.2 加标回收率检测 ①Tecra SEs SET法:根据校正曲线及临界AV值推算出检出限。以全脂牛奶为基质,加入肠毒素工作母液配置成检出限、2.5倍检出限、10倍检出限浓度的待测样品,按使用说明要求分别添加反应液及相关程序操作,反应物用酶标仪检测(414±10)nm处的吸光度(AV值),重复6次,其平均值与加标浓度的比值即为回收率。②Vidas SET2法:以全脂牛奶为基质,加入肠毒素工作母液配置成检出限、2.5倍检出限、10倍检出限浓度的待测样品,参照1.2.1中②的方法预处理后,用mini Vidas检测,所获TV值代入校正曲线公式获得实际检测浓度,重复6次,其平均值与加标浓度的比值即为回收率。
1.2.3 肠毒素A阳性样品的制备和检测 ①菌种活化培养:将冻藏的产肠毒素A(SEA)的金黄色葡萄球菌株(SA14966)菌液解冻,取0.1 mL菌液加入50 mL已经灭菌的LB培养基中,振荡培养,划线分离后置于(37±1) ℃培养箱中培养24 h得到单菌落。②菌种原液制备:从单菌落挑取一环接种于灭菌的LB 培养基中,100 r/min、(37±1) ℃培养,16~18 h;吸出50 mL菌液离心(10 000 r/min,(4±0.1) ℃,20 min);弃上清液后,细胞沉淀加入冷的50 mL灭菌的0.1 mol/L磷酸钾缓冲液(K2HPO4-KH2PO4,pH=7)混匀;离心(10 000 r/min,(4±0.1) ℃,20 min);弃上清液;上述操作再重复一次得到菌种原液[19]。③肠毒素A阳性样品检测:将金黄色葡萄球菌菌液接种于经灭菌的全脂牛奶中,初始浓度约为103cfu/mL,置于(37±1) ℃环境下培养18、24和30 h,分别用Tecra SEs SET和Vidas SET2检测肠毒素浓度,重复3次。
2 结果与分析
2.1 Tecra SEs SET(ELISA方法)对SEA标准溶液检测结果
采用Tecra SEs SET葡萄球菌肠毒素检测试剂盒对SEA标准溶液检测,结果见图1。

图1 采用Tecra SEs SET获得的SEA浓度与吸光度的校正曲线Fig.1 Calibration curve of SEA concentration vs Absorbance value using Tecra SEs SET
图1显示在0~10 ng/mL肠毒素(SEA)浓度范围内,Tecra SEs SET试剂盒检测结果的吸光度与SEA浓度呈良好的线性关系,相关系数r=0.997,拟合的线性回归方程:SEA(ng/mL)=5.600 1×AV-0.328 5。在该浓度范围内,实验的精密度良好,7个浓度水平所测得的AV值的变异系数均小于5.0%。TECRA SEs SET对阳性样品判断的AV临界值为0.2,即只有当AV≥0.2的样品才能判断为肠毒素阳性。根据校正曲线公式计算,AV=0.2时的SEA浓度为0.79 ng/mL,即0.79 ng/mL为该方法的检出限,因此实际应用于牛奶中肠毒素A定量检测时标准曲线的有效范围为0.79~10 ng/mL。根据检出限,以全脂牛奶的基质,配置成肠毒素A浓度为0.80、2.5和10 ng/mL的待测样品做加标回收率实验,结果表明(表1),肠毒素的加标回收率均符合GB/T27404-2008规定的要求。
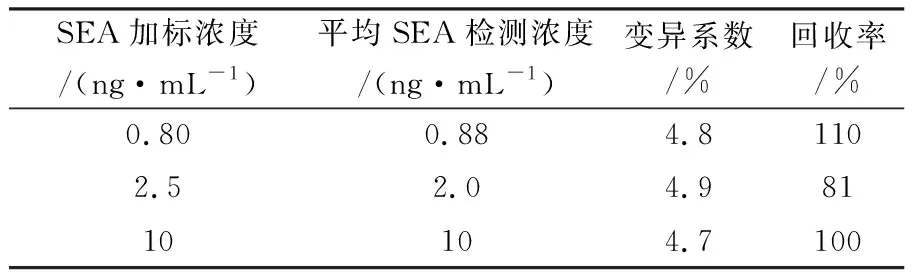
表1 Tecra SEs SET的加标回收率(n=6)
2.2 Vidas SET2(ELFA方法)对SEA标准溶液检测结果及加标回收率
采用Vidas SET2对SEA标准溶液检测结果见图2。
图2显示在0~5.0 ng/mL肠毒素A(SEA)浓度范围内,Vidas SET2检测结果(TV值)与SEA的浓度的关系,可以看出TV值与SEA的浓度在该范围内并不总是呈良好的线性关系。在0~1.0 ng/mL浓度范围的TV值与SEA的浓度的相关系数r=0.998,相关性良好,拟合的线性回归方程:SEA(ng/mL)=0.848 8×TV-0.023 9;0~2.5 ng/mL浓度范围的相关系数r=0.983,相关性略低,但对于痕量检测,可以接受;而0~5.0 ng/mL浓度范围的r=0.930,无法接受。重复性试验显示精密度良好,7个浓度水平所测得的TV值变异系数均小于5.0%。Vidas SET2葡萄球菌肠毒素检测试剂盒对阳性样品判断的TV临界值为0.13,当TV≥0.13的样品才能判断为肠毒素阳性。根据0~1.0 ng/mL浓度范围的线性回归方程,TV=0.13时的SEA浓度为0.09 ng/mL,即检出限为0.09 ng/mL,这与Hennekinne等[16]的研究结果0.062 5 ng/mL接近,因此应用于定量检测时校正曲线的有效范围为0.09~1.0 ng/mL。根据检出限,肠毒素A浓度为0.10、0.25 ng/mL和1.0 ng/mL的待测样品做加标回收率实验,结果表明(表2),肠毒素的加标回收率均符合GB/T27404-2008规定的要求。

图2 采用Vidas SET获得的SEA浓度与TV值的关系(n=6)Fig.2 The Calibration curve of SEA concentration vs Absorbance value using Vidas SET(n=6)实线:TV值的变化趋势线;虚线1:SEA浓度范围为0~1.0 ng/mL的校正曲线;虚线2:SEA浓度范围为0~2.5 ng/mL的校正曲线;虚线3:SEA浓度范围为0~5.0 ng/mL的校正曲线Solid line with:was the trend of the test value,dash line1 was the calibration curve at the SEA concentration ranged from 0-1.0 ng/mL, dash line2 was the calibration curve at the SEA concentration ranged from 0-2.5 ng/mL, dash line3 was the calibration curve at the SEA concentration ranged from 0-5.0 ng/mL
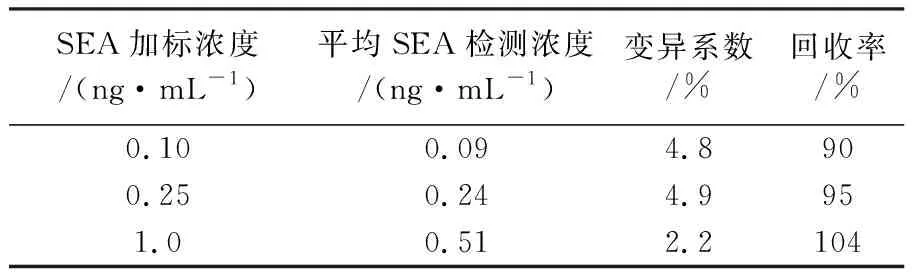
SEA加标浓度/(ng·mL-1) 平均SEA检测浓度/(ng·mL-1)变异系数/%回收率/%0.100.094.8900.250.244.9951.00.512.2104
2.3 阳性样品的检测结果及比较
将产肠毒素A的金黄色葡萄球菌菌株接入牛奶中于(37±1) ℃环境下培养,分别在18、24和30 h时测定肠毒素A(SEA)的浓度(n=3),结果见图3。在18和24 h时,SEA浓度低于Tecra SEs SET的检测限,仅能被Vidas SET2检出,在18和24 h时检出浓度分别为(0.48±0.01)和(0.55±0.02) ng/mL。在30 h时,SEA可以同时被Tecra SEs SET和Vidas SET2检出,采用Tecra SEs SET检出的浓度为(1.72±0.08) ng/mL,Vidas SET2检出的浓度为(1.59±0.03) ng/mL,两者十分接近。

图3 采用Terca SEs SET和Vidas SET2对牛奶中葡萄球菌肠毒素A(SEA)浓度的检测结果(n=3)Fig.3 The SEA concentration in milk during incubation detected by Terca SEs SET and Vidas SET2(n=3)
3 讨 论
研究结果显示,Terca SEs SET和Vidas SET2两种肠毒素定性试剂盒用于牛奶中葡萄球菌肠毒素A的定量检测,无论在精密度、回收率以及校准曲线方程的相关系数等都基本满足《GB/T27404-2008 实验室质量控制规范 食品理化检测》的要求。由于这两种试剂盒都是商业化产品,相关实验室可以方便快捷地利用它们建立起SEs的定量检测条件。Tecra SEs SET只需配套酶标仪,对检测设备硬件投入要求低,Vidas SET2需要配套全自动荧光免疫分析仪,但检测耗材相对便宜。根据实验结果可以发现Tecra SEs SET有更广的线性范围,而Vidas SET2则具有更高的灵敏度,其检出限和校正曲线范围要比Terca SEs SET低一个数量级,但两者又无缝衔接,因此在定量检测时可以根据样品不同SEA浓度选择合适的试剂盒。
需要特别说明的是,根据Terca SEs SET和Vidas SET2这两种试剂盒的原理[17-18],除了SEA,还可用于定量检测其他六种常见肠毒素。然而,由于这两种试剂盒使用多克隆抗体,不能对这七种肠毒素予以分型[20],因此仅能在食品中只有其中一种肠毒素且类型已知的情况下才能用于定量检测。另外,免疫学方法虽然具有灵敏度高、特异性强等优点,但依然存在假阳性或假阴性的缺点,如果食品中残留大量的与试剂盒标记的酶(如过氧化物酶或碱性磷酸酶等)相同的酶,很有可能导致假阳性;同时某些食品加工过程如加热可引起肠毒素凝聚,造成其与抗体的反应性降低,但其生物活性可能依然保留,由此导致假阴性的出现[15]。鉴于免疫学方法存在缺陷,近几年各国科学家开始探索采用色谱结合质谱方法检测肠毒素并取得了一些进展[21-22],虽然该方法的检测硬件条件比免疫学方法要求高,且目前技术尚不成熟,但这仍然是发展趋势。
