高能脉冲氙光致眼组织损伤防护方法研究*
2018-08-22严伟明张千里薛军辉张作明
龙 盘 严伟明 陈 涛 王 喆 张千里 薛军辉 张作明
(1.空军军医大学航空航天临床医学教研室,西安 710032)(2.空军军医大学基础医学院,西安 710032)
移动式高能氙光消毒机利用惰性气体氙气产生强紫外脉冲,在极短的时间内释放出极高能量的原理,达到消毒和净化空气的效果。该设备由于具有杀菌效率高,时间短,冷灭菌等优势,目前已被应用于动物房传递窗消毒。但是高能脉冲光对动物的视觉系统的安全性还不甚清楚,本实验主要通过系列视觉相关检查对其安全性以及防护方法进行评估。
1 材料与方法
1.1 材料
1.1.1材料: 移动式高能氙光消毒机(MX-3600)由西安富康空气净化设备有限公司生产。高能氙光消毒机外径尺寸为515 mm×515 mm×880 mm(长×宽×高),脉冲氙灯(XENEX,美国)10 inch,波长100~400 nm,频率1~10 Hz。单次脉冲能量为207 J(约为紫外灯的50.000倍)。
1.1.2实验动物:60只SD大鼠,体质量200~250 g,购自第四军医大学动物实验中心。
1.1.3大鼠固定装置:塑料瓶20个,剪去底盖,侧壁剪开,塑料胶带固定。
1.2 实验分组及处理
随机将SD大鼠(n=60)分为阳性对照组、手术铺单组、薄白色塑料板组、薄棕色塑料板组、厚棕色塑料板组和阴性对照组(n=10)。将移动式高能脉冲氙光消毒机设置工作参数频率1 HZ,时间5 min,大鼠均固定于自制的大鼠固定器,放置高度80 cm,距离消毒机1 m处。重复上述操作,每日2次,连续暴露5 d后,观察系列指标。
1.3 观察指标
1.3.1裂隙灯观察:SD大鼠于高能脉冲氙光照射5 d后,于结膜囊内滴20 μL荧光素钠(1%),用2 mL生理盐水缓慢冲洗。然后将SD大鼠置于裂隙灯钴蓝灯模式下拍摄,拍摄角度35°,调整焦距使得焦点落于角膜平面上。拍摄时按照角膜损伤评分方法进行评分,将角膜分为四个象限,每个象限单独积分,之后加起来。评分方法如下,0分:角膜无荧光素钠着染,干净透明;1分:角膜有点状荧光素钠着染,但是着染点小于30个;2分:角膜有点状荧光素钠着染大于30个,或者点状损伤融合成片状;3分:角膜有大片荧光素钠着染。
1.3.2全视野闪光视网膜电图(ffERG):大鼠于末次高能脉冲光照射后暗适应12 h,于红光环境下进行视网膜电图检测。操作方法简述如下,大鼠常规腹腔注射麻醉后(3 mL/kg体质量1%戊巴比妥钠+50 μL 100%速眠新),托比卡胺散瞳后,将大鼠置于操作台上固定,正极为角膜银电极,负极为脸颊针电极,尾巴针电极接地,按照罗兰电生理操作系统进行操作。操作标准为国际电生理标准的五项检查。
1.3.3相干光断层成像扫描(OCT)和眼底彩照检测:大鼠常规麻醉后,托比卡胺散瞳后,将大鼠放置于特制的鼠台,采用ISOCT眼科超显微成像系统(optoprobe, Canada)对大鼠视网膜进行断层扫描。之后采用OPTO-III视网膜成像系统(optoprobe, Canada)进行眼底彩照的拍摄。
1.3.4病理检测:小心摘取眼球之后,放置于制备的眼球固定液中,固定24 h后,脱水包埋制备蜡块,于石蜡切片机切片(4 μm),烤片脱水之后进行角膜和视网膜HE病理染色,于光学显微镜下观察(DP71, Olympus, Japan),每张切片观察3个位置取平均值进行统计。
1.4 统计方法
2 结果
2.1 裂隙灯(钴蓝光)观察大鼠角膜荧光素钠着染
荧光素钠可以使上皮缺损的角膜着色,实验结果显示阴性对照组角膜干净透明,无荧光素钠着染,阳性对照组角膜有点状、树枝状、片状荧光素钠着染;手术铺单组角膜有点状、片状荧光素钠着染;白色薄塑料板组角膜有点状、树枝状荧光素钠着染;棕色薄塑料板组和棕色厚塑料板组角膜干净透明,未见明显荧光素钠着染,见图1A。阳性对照组,手术铺单组和白色薄塑料板组角膜荧光素钠染色评分大于阴性对照组(P<0.05);棕色薄玻璃板组和棕色厚玻璃板组角膜荧光素钠染色评分和阴性对照组相比无统计学意义(P>0.05),见图1B。

图1 角膜荧光素钠染色及评分(n=10)注:A,角膜荧光素钠染色;B,角膜荧光素钠染色评分;a,阳性对照组;b,手术铺单组;c,白色薄塑料板组;d,棕色薄塑料板组;e,棕色厚塑料板组;f,阴性对照组;点状荧光素钠着染(黑色箭头),树枝状荧光素钠着染(黄色箭头),片状荧光素钠着染(红色箭头);*P<0.05, a, b, c, d, evs fFig.1 Corneal fluorescein sodium staining and grading(n=10)Note:A, Corneal fluorescein sodium staining; B. The score of corneal fluorescein sodium staining; a, positive control group; b. surgical drapes group;c, thin white plastic sheet group; d, thin brown plastic sheet group; e, thick brown plastic sheet group; f, negative control group; The dot fluoresceinsodium (black arrow), the dendritic fluorescein sodium (yellow arrow), the fluorescein sodium dye (red arrow); *P<0.05, a, b, c, d, evs f
2.2 全视野闪光视网膜电图(ffERG)
感光细胞对于强光损伤是非常敏感的, ffERG用来评估高能脉冲氙光对视网膜尤其是感光细胞的损伤。各组典型ffERG波形图见图2。

图2 各组典型视网膜电图表现注:A, 暗视3.0反应;B,OPs波;C,明视3.0反应a,阳性对照组;b,手术铺单组;c,白色薄塑料板组;d棕色薄塑料板组;e棕色厚塑料板组;f,阴性对照组 Fig.2 Typical retinal electrogram of each groupNote:A, dark-adaptation 3.0 response; B, OPs wave; C, light-adaptation 3.0 response. a, positive control group; b. surgical drapes group; c, thin white plastic sheet group; d, thin brown plastic sheet group; e, thick brown plastic sheet group; f, negative control group
2.2.1暗视3.0反应:阳性对照组和手术铺单组暗视3.0反应的b波振幅显著小于阴性对照组(P<0.05),阳性对照组和手术铺单组暗视3.0反应b波的峰时值延长(P<0.05);白色薄塑料板组,棕色薄塑料板组和棕色厚塑料板组暗视3.0反应b波幅值和峰时值与阴性对照组相比无统计学差异(P> 0.05),见图3。

图3 暗视3.0反应b波幅值和峰时值(n=10)注:A,阳性对照组;B,手术铺单组;C,白色薄塑料板组;D,棕色薄塑料板组;E,棕色厚塑料板组;F,阴性对照组*P<0.05, A, B, C, D, Evs F;**P<0.01, A, B, C, D, E vs FFig.3 The amplification b wave (dark-adaptation 3.0 response) and the peak time of b wave (n=10)A, positive control group; B. surgical drapes group; C, thin white plastic sheet group; D, thin brown plastic sheet group; E, thickbrown plastic sheet group; F, negative control group; *P<0.05, A, B, C, D, Evs F;**P<0.01, A, B, C, D, E vs F
2.2.2Ops波:阳性对照组和手术铺单组∑OPs1-4与阴性对照组相比显著降低(P<0.05);白色薄塑料板组、棕色薄塑料板组和棕色厚塑料板组∑OPs1-4与阴性对照组相比差异无统计学差异(P>0.05),见图4。

图4 各组∑OPs1-4幅值(n=10)注:A,阳性对照组;B,手术铺单组;C,白色薄塑料板组;D棕色薄塑料板组;E棕色厚塑料板组;F,阴性对照组*P<0.05, A, B, C, D, Evs FFig.4 The amplification of ∑OPs1-4 (n=10)Note:A, positive control group; B. surgical drapes group; C, thin whiteplastic sheet group; D, thin brown plastic sheet group; E, thick brownplastic sheet group; F, negative control group;*P<0.05, A, B, C, D, Evs F
2.2.3明视3.0反应:阳性对照组和手术铺单组与阴性对照组相比明视3.0反应b波振幅降低(P<0.05),峰时值延长(P<0.05);白色薄塑料板组,棕色薄塑料板组和棕色厚塑料板组明视3.0反应b波幅值和峰时值与阴性对照组相比无统计学差异(P> 0.05),见图5。
2.3 相干光断层成像(OCT)
阳性对照组和各防护组的视网膜全层厚度与阴性对照组相比无统计学差异(P>0.05);而阳性对照组和手术铺单组外核层厚度与阴性对照组相比变薄(P<0.05),见图6。
2.4 眼底彩照
眼底彩照结果显示阳性对照组及各防护组眼底未见明显异常,见图7。

图5 明视3.0反应b波振幅和峰时值(n=10)注:A,阳性对照组;B,手术铺单组;C,白色薄塑料板组;D棕色薄塑料板组;E棕色厚塑料板组;F,阴性对照组;*P<0.05, A, B, C, D, Evs FFig.5 The amplification b wave (light-adaptation 3.0 response) and the peak time of b wave (n=10)Note:A, positive control group; B. surgical drapes group; C, thin white plastic sheet group; D, thin brown plastic sheet group;E, thick brown plastic sheet group; F, negative control group; *P<0.05, A, B, C, D, Evs F

图6 视网膜全层和外核层厚度注:a,阳性对照组;b,手术铺单组;c,白色薄塑料板组;d,棕色薄塑料板组;e,棕色厚塑料板组;f,阴性对照组**P<0.01, a,b, c, d, e vs fFig.6 The thickness of whole retinal and outer nuclear layer (ONL)Note:a, positive control group; b. surgical drapes group; c, thin white plastic sheet group; d, thin brown plastic sheet group;e, thick brown plastic sheet group; f, negative control group; **P<0.01, a,b, c, d, e vs f
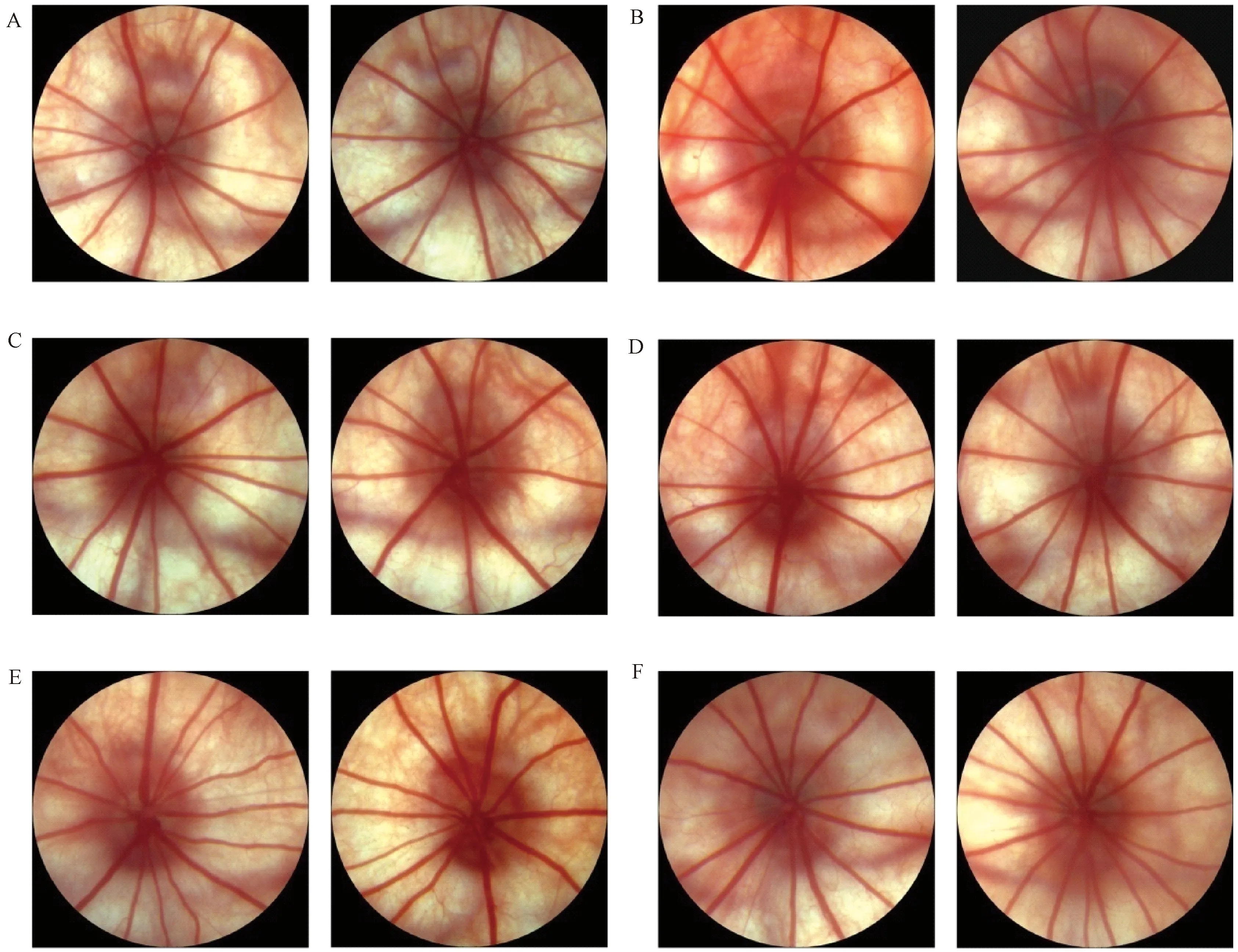
图7 眼底彩照注:A:阳性对照组;B,手术铺单组;C,白色薄塑料板组;D棕色薄塑料板组;E棕色厚塑料板组;F,阴性对照组Fig.7 Fundus photographNote:A, positive control group; B. surgical drapes group; C, thin white plastic sheet group; D, thin brown plastic sheet group; E, thick brown plastic sheet group; F, negative control group
2.5 病理改变
2.5.1角膜:角膜HE染色显示阳性对照组可见角膜上皮层粗糙,基底层细胞增生活跃,基质层网状结构断裂皱褶,基质交联纤维变细;各防护组和阴性对照组角膜病理结构未见明显改变,见图8。
2.5.2视网膜:视网膜HE染色结果与OCT相一致,阳性对照组和手术铺单组与阴性对照组相比视网膜外核层细胞层数减少(P<0.05),见图9~10。
3 讨论
SPF级动物是各种生物学实验的标准使用动物,而关于SPF级动物饲养设施建设的重要的一个环节就是消毒灭菌[1]。传递窗作为外界环境与动物房洁净室之间的传递通道,在防止病原微生物进入洁净环境起到重要作用。目前常用的传递窗消毒设备为紫外灯,由于其消毒时间长以及消毒效率低,给实际应用带来诸多不便[2]。高能脉冲氙光由于其具有消毒效率高(杀菌率>99%),消毒时间短(1 min),冷消毒(不产生热量)等一系列优点[3-4],其可能将取代传统的物理和化学杀菌手段。但是,生物安全性等问题也随着而来。
高能脉冲氙光瞬间释放的超高能量,以及高能量电离空气产生臭氧对动物是否安全?尤其是动物眼部组织成为困扰工作人员的一个问题。本研究发现,高能脉冲氙光最大照射时间5 min/次,2次/d,持续5 d后,会对动物的角膜和视网膜产生一定程度的损伤,相关研究也表明强紫外线可造成视网膜功能的急性损伤,这种损伤往往恢复较快[5],这种损伤类似于雪盲以及电弧性眼损伤等,往往1~2 d就会恢复[6]。实验发现末次照射7 d后视网膜功能可以基本恢复正常(数据未给出),为什么恢复时间晚于一般的强紫外线损伤呢?估计是否由于其产生紫外线的能量太强,白化大鼠缺乏视网膜色素上皮的保护,使得感光细胞由于局部能量过大产生凋亡[7];亦或者是其产生的臭氧对视网膜的结构和功能造成一定影响,这还有待于进一步探索验证。

图10 视网膜外核层细胞层数量(n=5)注:A,阳性对照组;B,手术铺单组;C,白色薄塑料板组;D棕色薄塑料板组;E棕色厚塑料板组;F,阴性对照组*P<0.05, A, B, C, D, Evs FFig.10 The number of retinal ONL cell layers (n=5)Note:A, positive control group; B. surgical drapes group; C, thin white plastic sheet group; D, thin brown plastic sheet group; E, thick brown plastic sheet group; F, negative control group;*P<0.05, A, B, C, D, Evs F
同时,实验中我们发现手术铺单、白色薄塑料板、棕色薄塑料板和棕色厚塑料板对高能脉冲氙光眼部损伤均具有一定的防护作用,其中手术铺单防护作用较弱。由于紫外线对眼睛的损伤主要与波长,强度,照射时间,光照方式有关[8-9]。高能脉冲氙光主要产生短波长的紫外线,短波长的紫外线由于波长短,能量大,衍射性差,对眼睛的损伤主要是角膜,但是由于其短时间释放能量巨大,大约为到达地面太阳光强度的100 000倍,部分能量会通过光通路而作用于相应的视网膜区域从而部分损伤视网膜。同样的,对于高能脉冲氙光的防护也就相对比较容易,主要考虑两个问题:1. 高能脉冲氙光的穿透力;2. 周围墙壁的反射。针对于第一个问题,我们发现厚度为3 mm的白色塑料板就足以防护高能脉冲氙光的损伤,且深色的材料的防护效果要优于浅色的材料。针对第二个问题,我们建议全面防护动物的眼组织或者用疏松且容易吸收脉冲光的材料进行墙壁布置。
综上,高能脉冲氙光作为一种新型的动物房消毒设备,具备一系列消毒优点,但是其对动物的眼睛的安全性具有一定影响,在使用过程中,操作人员需要做好动物防护。
