人脑胶质瘤组织中EGFRvⅢ蛋白表达及其对细胞增殖的影响
2018-08-22孙文栋佟建洲张向前石凤云李连进范经世
孙文栋 佟建洲 张向前 石凤云 李连进 范经世
人脑胶质瘤是颅脑外科常见的恶性肿瘤之一,多种基因的调控其的发生发展[1]。表皮生长因子受体突变体Ⅲ(EGFRvⅢ)是表皮生长因子受体(EGFR)最常见的突变类型,在很多肿瘤组织中均呈现高表达,与恶性肿瘤的发生发展密切相关[2]。本研究探讨了人脑胶质瘤组织中EGFRvⅢ的表达情况及其对胶质瘤U87细胞增殖的影响,现报告如下。
1 材料与方法
1.1 一般资料
选取2014年3月至2016年9月本院收治的人脑胶质瘤患者54例,均经病理活检确诊,并符合2007年WHO肿瘤分级标准[3]中的Ⅳ级标准,其中男性28例,女性26例;年龄29~67岁,平均年龄(48.7±2.5)岁。所有患者术前均未接受抗肿瘤药物治疗,本研究经我院医学伦理委员会审批同意且患者及家属知情同意。采集患者胶质瘤组织和癌旁组织(距肿瘤组织边缘2~3 cm),以生理盐水冲洗后于液氮中迅速冷冻,然后置于超低温冰箱保存。
1.2 方法
1.2.1 EGFRvⅢ在不同组织中的表达情况 取2~3 g胶质瘤组织和癌旁组织,分别加入磷酸盐缓冲溶液(PBS)进行组织匀浆,制成悬液,采用ELISA法测定悬液中EGFRvⅢ的表达量;采用免疫组化法(IHC)测定组织中EGFRvⅢ表达情况:将保存的胶质瘤组织和癌旁组织进行石蜡包埋,制成切片后,按照IHC试剂盒说明书操作:切片置于65 ℃水浴锅中过夜脱蜡,于37 ℃水浴锅中经胃蛋白酶消化30 min,加柠檬酸缓冲液进行抗原修复,加阻断剂作用10 min,用非免疫血清封闭后滴加抗EGFRvⅢ抗体,室温过夜,滴加生物素标记的二抗作用10 min,加链霉菌抗生物素蛋白-过氧化酶反应10 min,加DAB显色,在光学显微镜下观察染色情况以PBS替代一抗作为阴性对照。染色强度评分标准:无色为0分、浅黄色为1分、深黄色为2分、棕褐色为3分;每张切片随机选择5个高倍镜视野(×400)观察阳性细胞率,阳性细胞评分标准:阳性细胞率<10%为0分,11%~25%为1分,26%~50%为2分,51%~75%为3分,≥76%为4分;IHC评分=染色强度评分×阳性细胞评分,其中0~4分为EGFRvⅢ低表达,5~12分为EGFRvⅢ高表达。
1.2.2 细胞培养及转染方法 胶质瘤U87细胞株用含10%胎牛血清的DMEM培养基,于37 ℃含5% CO2培养箱中培养,并接种于12孔培养板中进行转染。利用转染试剂Lipofectamine 2 000将EGFRvⅢ的siRNA和阴性对照(NC)的siRNA分别转染到胶质瘤U87细胞中,分别称为EGFRvⅢ-siRNA组和NC-siRNA组,培养24 h后进行相关指标的测定。
应用转染试剂Lipofectamine 2 000将重组质粒pcDNA4to-EGFRvⅢ和空载体对照质粒pcDNA4to分别转染到胶质瘤U87细胞中,培养36 h后加入氨苄青霉素50 μg/mL,继续培养2周,分别命名为U87-EGFRvⅢ细胞和U87-control细胞。
1.2.3 CCK-8法测定EGFRvⅢ-siRNA组和NC-siRNA组中胶质瘤U87细胞的增殖能力 取2组细胞以5 000个/孔接种于96孔板,每组设3个重复,同时设空白对照孔,分别培养24、48、72、96 h后弃去培养基,加入不含胎牛血清的不完全培养基,再加入10 μL CCK-8试剂,继续培养2 h后,用酶标仪测定OD450 nm值。
1.2.4 蛋白质印迹法(WB)检测U87-EGFRvⅢ和U87-control细胞中EGFRvⅢ表达量 收集稳定转染质粒的U87-EGFRvⅢ细胞和U87-control细胞,并提取细胞蛋白。取50 μg/孔蛋白上样,进行SDS-PAGE后转膜,加5%脱脂牛奶于室温下封闭过夜,加入抗EGFRvⅢ抗体和抗β-actin抗体,4 ℃反应4 h,加入辣根过氧化物酶标记的二抗,室温反应30 min;加入显色剂,用凝胶成像分析系统检测信号,EGFRvⅢ蛋白的相对表达量=EGFRvⅢ蛋白条带灰度值/内参照β-actin蛋白条带灰度值。实验重复3次。
1.2.5 裸鼠实验 选取无特定病原体4~6周龄雌性Balb/c裸鼠10只,分为U87-EGFRvⅢ组和U87-control组,每组5只。分别在背部皮下注射稳定转染质粒的U87-EGFRvⅢ和U87-control细胞,1×106个细胞/只,共饲养8周,以游标卡尺测量肿瘤最大直径(a)和最小直径(b),计算肿瘤体积V=a×b2/2(cm3),每2周测量1次。8周后剥离已成瘤裸鼠的皮下肿瘤并称重。
1.3 统计学方法

2 结果
2.1 胶质瘤组织及癌旁组织中EGFRvⅢ的表达情况
胶质瘤组织中EGFRvⅢ表达量、阳性细胞率、染色强度评分、IHC评分均高于癌旁组织,且2组间差异显著(P<0.01),见表1。
2.2 EGFRvⅢ-siRNA组和NC-siRNA组胶质瘤U87细胞培养不同时间OD450 nm比较
2组细胞在培养24~96 h时的OD450 nm值逐渐升高,但EGFRvⅢ-siRNA组细胞在培养24、48、72、96 h的OD450 nm值均显著低于NC-siRNA组,2组间差异显著(P<0.05或P<0.01),见表2。
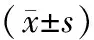
表1 胶质瘤组织及癌旁组织中EGFRvⅢ表达情况
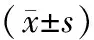
表2 EGFRvⅢ-siRNA组和NC-siRNA组胶质瘤U87细胞培养不同时间的OD450 nm比较
注:与NC-siRNA组比较,*为P<0.05,**为P<0.01。
2.3 U87-EGFRvⅢ和U87-control细胞中EGFRvⅢ表达情况
U87-control细胞中EGFRvⅢ蛋白的相对表达量为(0.09±0.01),显著低于U87-EGFRvⅢ细胞中的(0.73±0.19),2组间差异显著(P<0.01)。
2.4 裸鼠实验结果
2组裸鼠实验成瘤率均为100%。U87-control组和U87-EGFRvⅢ组肿瘤体积及肿瘤质量分别为(0.09±0.03)cm3和(0.51±0.24)cm3,(0.39±0.20)g和(1.12±0.15)g,U87-EGFRvⅢ组肿瘤体积及肿瘤质量显著大于U87-control组(P<0.01)。
3 讨论
人脑胶质瘤预后比较差,平均生存期仅26~52周[4]。因此,人脑胶质瘤的治疗仍是神经外科领域的难点之一,据人脑胶质瘤的发病机制寻找新的治疗靶点具有重要的临床实用价值。
EGFR包括胞外区、跨膜区和胞内区,可介导细胞增殖、分化及黏附等活动[5]。EGFR的过度表达与其基因突变或重排有关,伴有EGFR基因重排的人脑胶质瘤患者中有50%的患者存在EGFR突变,EGFRvⅢ是其最常见的突变类型[6]。EGFRvⅢ是由EGFR胞外区801 bp的2~7外显子缺失所致的外显子1和外显子8相连,在结合处形成1个新的氨基酸,致使在EGFR胞外区形成1个新的抗原决定簇,产生1种特异性的肿瘤细胞表面标志物[7-8]。EGFRvⅢ在没有与配体结合的情况下亦可对细胞核内多种基因的表达和细胞生长分化产生调控作用,属于配体非依赖性受体[9-10]。所以EGFRvⅢ可作为治疗肿瘤疾病的新靶点。曹玉婷等[11]研究发现,抗EGFR单克隆抗体对乳腺癌细胞的生长具有良好的抑制作用;也有相关研究表明[12-13],EGFR抗体在治疗人脑胶质瘤中取得了一定的治疗效果。本研究结果显示,胶质瘤组织中EGFRvⅢ表达量、阳性细胞率、染色强度评分、IHC评分高于癌旁组织,说明EGFRvⅢ在胶质瘤组织中表达量较多,癌旁组织表大量相对较少,提示EGFRvⅢ可能与肿瘤的发展有一定联系;本研究中EGFRvⅢ-siRNA组细胞在培养24~96 h的OD450 nm值显著低于NC-siRNA组,提示通过靶向抑制EGFRvⅢ后可降低胶质瘤细胞U87的增殖能力;U87-EGFRvⅢ细胞中EGFRvⅢ的相对表达量显著高于U87-control细胞;U87-EGFRvⅢ组肿瘤体积及肿瘤质量均显著大于U87-control组。说明高表达的EGFRvⅢ能诱导胶质瘤U87细胞的增殖,且可促进胶质瘤U87细胞的成瘤能力,可能与EGFRvⅢ可诱导白细胞介素-8、转化生长因子-α等刺激性细胞因子的表达上调,导致肿瘤细胞自发性生长有关[14-15]。
综上所述,EGFRvⅢ在胶质瘤组织中表达量较多,且能诱导胶质瘤U87细胞的增殖。高表达的EGFRvⅢ可促进胶质瘤U87细胞的成瘤能力,通过靶向抑制EGFRvⅢ后可降低胶质瘤U87细胞的增殖能力,EGFRvⅢ与胶质瘤的发生、发展密切相关。
