新疆奶牛子宫内膜炎大肠杆菌进化 分群及耐药特性研究
2018-08-21孟庆玲伍晔晖王熙凤蔡扩军王登峰才学鹏
马 帅,乔 军,孟庆玲*,伍晔晖,王熙凤,郭 晶,蔡扩军,王登峰,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003; 2.乌鲁木齐市动物疾病控制与诊断中心,新疆 乌鲁木齐 830063; 3.新疆畜牧科学院 兽医研究所,新疆 乌鲁木齐 830000; 4.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
奶牛子宫内膜炎是奶牛饲养过程中常见的产科病,主要由于奶牛产后子宫内膜受损后受外来微生物的入侵,致使奶牛子宫黏膜发生炎症,可降低奶牛繁殖率,影响奶牛生产性能[1-2]。该病在奶牛场普遍存在,因地理位置和饲养模式的不同,不同奶牛场子宫内膜炎的发病率也存在较大的差异,我国奶牛子宫内膜炎的发病率为20%~50%[3]。
病原学调查发现,大肠杆菌是引起奶牛子宫疾病最常见的病原菌之一[4]。Sheldon等[5]认为,从产后奶牛子宫中分离的大肠杆菌主要集中在A群和B1群,而A群和B1群的大肠杆菌是与宿主共生的大肠杆菌。目前,防治奶牛子宫内膜炎的主要方法是大量使用抗菌药物。然而,随着抗菌药物的大量使用,大肠杆菌极易产生耐药性,甚至成为人和动物体内耐药决定因子的“贮藏库”。同时,耐药性大肠杆菌可以通过可移动元件中的转座子、质粒等将耐药基因进行水平转移,导致耐药性广泛扩散[6]。
奶牛子宫内膜炎严重制约着奶牛业的发展,新疆作为我国重要的奶牛养殖基地之一,受到了严重威胁。为了探究新疆地区奶牛子宫内膜炎大肠杆菌分离株的系统分群和耐药特性,本研究对其进行系统进化分群、耐药特性及携带质粒分析,以了解新疆地区奶牛子宫内膜炎大肠杆菌的耐药水平及多重耐药质粒的传播,为临床合理用药提供科学依据。
1 材料和方法
1.1 临床样品采集
2016年9月至2017年8月从新疆石河子、奎屯、塔城、乌鲁木齐等地区规模化奶牛场采集患有临床型子宫内膜炎奶牛子宫分泌物样品。样品采集时用干净温水清洗奶牛外阴后用75%乙醇棉球擦拭干净,使用直肠检查法触压子宫壁,弃除最初流出阴道内的子宫黏液,收集中间或后面流出的黏液于灭菌离心管中,放入冰盒带回实验室进行细菌分离培养。
1.2 试剂与菌株
16种药敏纸片和头孢他啶/克拉维酸(CZV,30/10 μg)、头孢噻肟/克拉维酸(CXV,30/10 μg)均购于杭州微生物试剂有限公司;伊红美蓝、麦康凯、MH药敏试验培养基和LB营养琼脂培养基购于北京奥博星生物技术有限公司;DNA Marker、PCR反应试剂、pMD19-T购于宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒购于天根生化科技(北京)有限公司;受体菌株E.coliDH5α由石河子大学动物科技学院寄生虫实验室提供;大肠杆菌质控菌ATCC25922购自中国兽医药品监察所。
1.3 大肠杆菌分离鉴定
用灭菌接种环沾取少量样品接种到液体LB中,在水平摇床培养8 h;然后在伊红美蓝培养基上划线培养,置于37 ℃细菌培养箱12~16 h;挑取平板上呈现紫黑色且有金属光泽的单菌落,划线于麦康凯培养基上,置于37 ℃细菌培养箱12~16 h;挑取平板上的单菌落,参照文献[7]中16S rDNA测序法进行扩增和测序比对。采用引物16S-F:5′-GCGGACGGGTGAGTAATGT-3′;16S-R:5′-TCATCCTCTCAGACCAGCTA-3′,引物由北京六合华大基因科技股份有限公司合成。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,32个循环;72 ℃延伸10 min。
1.4 大肠杆菌系统进化分群
按照TIANGEN公司基因组DNA提取试剂盒的操作步骤提取分离菌株的基因组DNA。设计并合成的相关引物(表1)与四重PCR反应条件及判定标准均参照文献[8]:首先使用四重PCR方法检测chuA、yjaA、TspE4.C2和arpA4种基因的存在和缺失,然后根据所获得的4种基因型对大肠杆菌分离株进行系统分群,由于部分分离株需要经过C群特异性引物或E群特异性引物进一步检测,操作时分别添加内部trpA对照引物用于控制DNA模板,所以第二步分别都是双重PCR。50 μL PCR反应体系:PCR Mixture 19 μL,ddH2O 19 μL,模板DNA 4 μL,上、下游引物各1 μL。同时对扩增结果进行测序验证。

表1 大肠杆菌分群引物
1.5 药物敏感性试验
根据CLSI中的K-B法对已分离鉴定过的大肠杆菌进行16种药物的敏感性试验,首先将分离株分别接种至1 mL LB液体培养基中,置于37 ℃摇床培养12~16 h,再用灭菌生理盐水将细菌浓度调至0.5麦氏浊度,取200 μL均匀涂布于MH药敏试验培养基上,然后用灭菌镊子夹取药敏纸片贴在培养基表面,将贴好药敏纸片的平板倒置在37 ℃细菌培养箱内培养16~24 h,大肠杆菌ATCC25922作为质控菌。结果判定按照抗菌药物敏感性试验执行标准进行,即同一株细菌对3类或3类以上的抗菌药物耐药则判定为多重耐药,并分析不同进化群与耐药性之间的关系。
1.6 产超光谱β-内酰胺酶的检测
根据CLSI推荐的大肠杆菌产超光谱β-内酰胺酶(ESBLs)的检测方法与判定标准进行,选取对头孢噻肟或头孢他啶任意一种药物耐药的分离株,判断为可疑产ESBLs大肠杆菌;表型验证试验按照CLSI中的K-B纸片扩散法执行,药敏纸片使用头孢他啶/克拉维酸和头孢他啶、头孢噻肟/克拉维酸和头孢噻肟2对药敏纸片。判定标准:只要其中1对未加克拉维酸药敏纸片的抑菌环直径比加了克拉维酸药敏纸片的抑菌环直径小5 mm,即可判定是阳性菌株。
1.7 耐药基因检测
耐药基因检测PCR体系为20 μL:ddH2O 10 μL,PCR Mixture 7 μL,模板DNA 2 μL,上下游引物各0.5 μL。耐药基因引物参照文献[9-15]设计,见表2。

表2 耐药基因引物序列
1.8 大肠杆菌产ESBLs耐药质粒分析
1.8.1 质粒提取与鉴定 随机挑选15株产ESBLs的大肠杆菌,均为多重耐药菌株,分别接种在5 mL含头孢氨苄(LEX,质量浓度为30 mg/mL)的LB培养基中,置于37 ℃水平摇床培养8~12 h,然后按质粒小量提取试剂盒的操作方法提取质粒,并对提取的质粒DNA进行电泳检测。
1.8.2 耐药质粒的转化与筛选 将成功提取的大肠杆菌质粒作为转化对象,吸取5 μL质粒转入E.coliDH5α中吹打混匀,冰上放置30 min,在42 ℃水浴锅中热激90 s后迅速冰浴5 min,再加入1 mL无抗性LB,置于37 ℃水平摇床培养1 h,取100 μL菌液涂布到含有LEX质量浓度为30 mg/mL的LB琼脂平板上,置于37 ℃温箱中培养12~16 h。
1.8.3 质粒的耐药性传递鉴定 提取转化子的质粒并与原菌株质粒进行琼脂糖凝胶电泳比对。按照CLSI中的K-B法对转化子进行药物敏感性试验,并用空白的E.coliDH5α作对照,判定结果按照抗菌药物敏感性试验执行标准进行。
2 结果与分析
2.1 大肠杆菌的分离与鉴定
从奶牛临床样品中共分离到210株大肠杆菌。大肠杆菌在麦康凯培养基上生长出圆形、光滑的红色菌落,在伊红美蓝培养基上形成带有金属光泽的紫黑色菌落;革兰氏染色镜检呈现红色,两端钝圆,呈散在分布的阴性短杆状菌(图1)。用引物扩增16S rDNA后,PCR产物经琼脂糖凝胶电泳检测,均出现了202 bp的目的条带(图2)。测序结果与GenBank上的大肠杆菌16S rDNA序列比对,同源性均为99.43%。

图1 大肠杆菌革兰氏染色镜检(1 000×)
M:DNA Marker DL2000; 1—6:目的片段图2 大肠杆菌16S rDNA PCR扩增
2.2 大肠杆菌系统进化分群结果
采用新Clermont四重PCR系统分型方法对210株奶牛子宫内膜炎大肠杆菌进行系统进化分析,PCR产物经琼脂糖凝胶电泳可见到arpA(400 bp)、chuA(288 bp)、yjaA(211 bp)、TspE4.C2(152 bp)的目的条带(图3)。其中B1群(101/210;48.1%)数量最多,其次是A群(60/210;28.6%)、C群(27/210;12.9%)、E群(14/210;6.7%)、D群(8/210;3.8%)。

M:DNA Marker DL700; 1:A群(+ - - -); 2:A群(+ - + -); 3:C群(+ - + -); 4:B1群(+ - - +); 5:E群(+ + - -); 6:D群(+ + - -); 7:阴性对照 图3 新Clermont四重PCR系统分型结果
2.3 药物敏感性试验结果
大肠杆菌各群对16种药物呈现不同程度的耐药,其中多重耐药菌株集中在B1群,A群仅对复方新诺明全部敏感,C群、D群和E群对药物的敏感种类多于B1群和A群。所有药物中耐药最严重的是红霉素、氨苄西林、庆大霉素、头孢氨苄、链霉素,耐药率分别为95.2%(200/210)、83.3%(175/210)、73.8%(155/210)、71.9%(151/210)、70.5%(148/210);菌株对诺氟沙星耐药率最低,耐药率为6.2%(13/210),其次是复方新诺明、氯霉素、多西环素,分别为6.7%(14/210)、10.0%(21/210)、10.5%(22/210)。多重耐药性严重,主要集中在对4~10种药物耐药。多重耐药率高达98.6%(207/210),其中耐7种药物以上的菌株占67.6%(142/210)(表3和图4)。
2.4 产ESBLs菌株表型初筛及确证
通过表型初选结果得出126株产ESBLs菌株,占总菌数的60%;对126株初筛菌株进行表型确证(图5),共检测出55株产ESBLs大肠杆菌,占总菌数的26.2%。

表3 大肠杆菌各进化群药敏试验结果
注:括号内的数字是耐药率(%)。
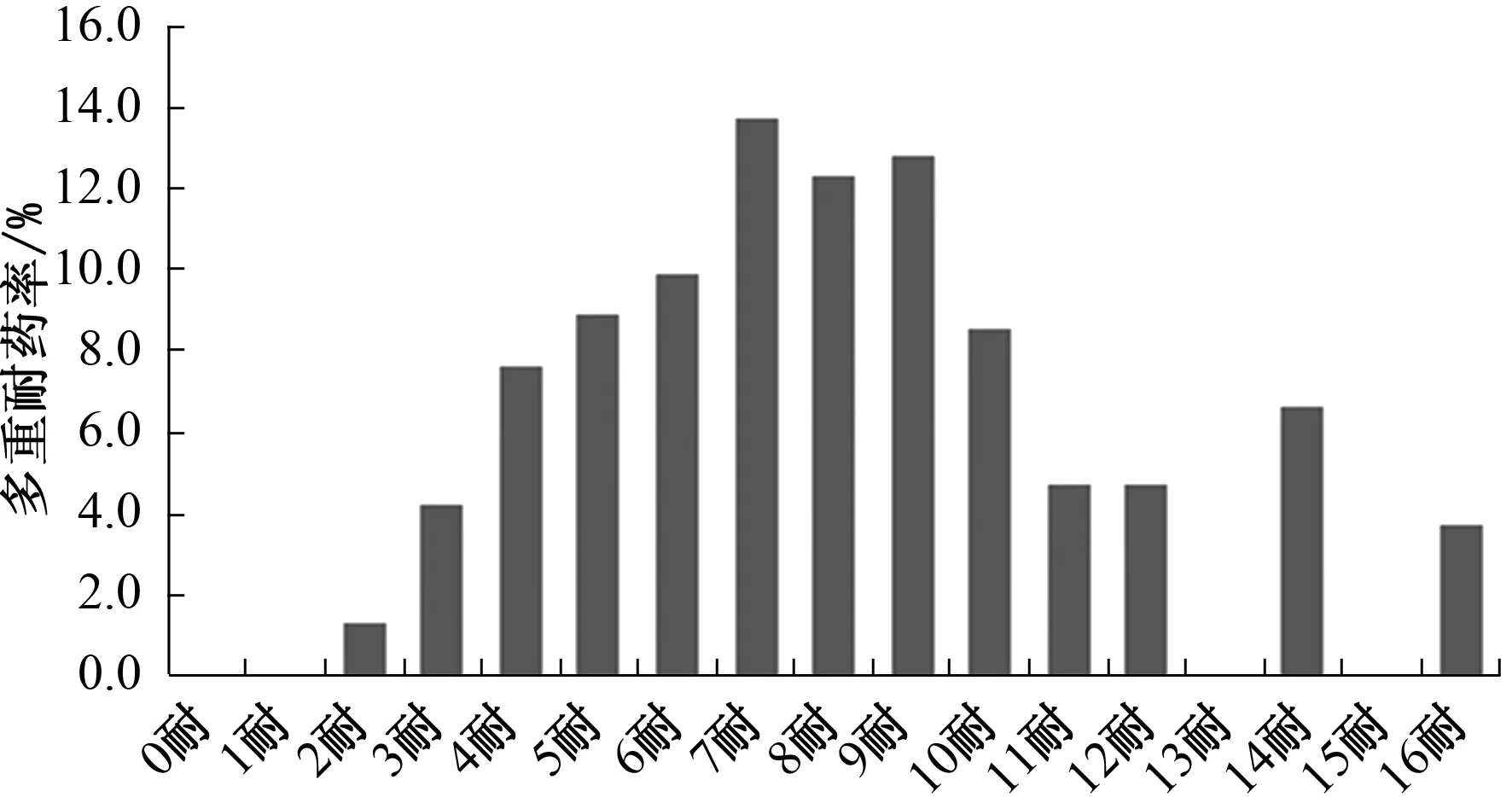
图4 大肠杆菌多重耐药统计

图5 产ESBLs菌株表型确证结果(阳性)
2.5 耐药基因检测结果
对210株大肠杆菌进行相关耐药基因的检测(图6—9)。结果表明,11种耐药基因中,blaTEM和aac(6′)- Ⅰb是最流行的耐药基因,检出率为90.5%(190/210)和88.1%(185/210),其次是ant(3″)-Ⅰa、aacC2 (aac(3)-Ⅱ)、blaCTX-M、aph(3′)-Ⅱa、rmtB、blaSHV,分别为70.0%(147/210)、64.3%(135/210)、58.1%(122/210)、37.6%(79/210)、18.6%(39/210)、11.4%(24/210)。mcr-1、qnrA和qnrS检出率则相对较低,分别为7.1%(15/210)、2.4%(5/210)和1.9%(4/210)。耐药基因的检测结果与耐药表型基本一致。

M:DNA Marker DL2000; 1—4:目的基因; 5:阴性对照图6 blaTEM基因PCR产物电泳

M:DNA Marker DL2000; 1—4:目的基因; 5:阴性对照图7 blaCTX-M基因PCR产物电泳
M:DNA Marker DL2000; 1—4:目的基因; 5:阴性对照图8 blaSHV基因PCR产物电泳
M:DNA Marker DL2000; 1—4:分别为ant(3″)-Ⅰa、aph(3′)-Ⅱa、aacC2 (aac(3)-Ⅱ)、aac(6′)-Ⅰb基因; 5:阴性对照图9 ant(3″)-Ⅰa、aph(3′)-Ⅱa、aacC2 (aac(3)-Ⅱ)、aac(6′)-Ⅰb基因PCR产物电泳
2.6 大肠杆菌产ESBLs耐药质粒分析
选取的15株产ESBLs大肠杆菌均能分离出质粒。质粒转化后,有8株菌在含LEX的固体LB培养基上生长出少量菌落,其他菌株没有菌落生长,总转化率为53.3%。提取转化成功后的转化子质粒并与原菌株质粒进行电泳检测,通过质粒电泳图谱发现转化子含有原菌株部分或全部的质粒条带,且
多数原菌株质粒与转化子质粒都有23.13 kb的条带(图10),将提取的转化子质粒再次转入到E.coliDH5α中,得到了相同的转化子,同时3次连续转化后的结果均相同。
E.coliDH5α作为基因工程菌,对所有抗菌药物不产生抗性,因此耐药质粒转化后,转化子所表现的耐药性是耐药质粒的抗性水平。对8株携带有ESBLs质粒的转化子进行药物敏感性试验,试验结果与供体菌比较可知,8株转化子对16种供试药物的耐药率与供体菌具有一定的相似性,转化子不仅对部分β-内酰胺类药物产生耐药性,对其他供试药物也表现出与供体菌类似的耐药性,并且均表现出对3种及以上药物耐药(表4)。供体菌和转化子对氨苄西林、庆大霉素、头孢氨苄的转移率均为100%,其他药物的转移率则相对较低(表5),表明通过转化,质粒可以携带1个至数个耐药基因,可以将供体菌的耐药性部分或全部转移。

M:λDNA/HindⅢ Marker; 1—8:原菌株质粒; 1-1—8-1:转化子质粒图10 转化子质粒与原菌株质粒电泳图谱表4 供体菌与转化子的耐药表型

菌株供体菌转化子1STR-GEN-AMP-AMI-CTX-EM-LEXSTR-GEN-AMP-LEX2STR-GEN-AMP-LEX-CAZ-KAN-POL-DOX-EMGEN-AMP-LEX3GEN-AMP-LEX-DOX-CAZ-EMGEN-AMP-LEX-DOX4GEN-AMP-LEX-STR-EM-CTX-TET-KAN-NORGEN-AMP-LEX-CTX5GEN-AMP-LEX-EM-KAN-NOR-AMI-POL-EMGEN-AMP-LEX-POL6GEN-AMP-LEX-AMI-STR-CTX-KAN-NOR-CTX-CAZ-EMGEN-AMP-LEX-AMI-CAZ-KAN7GEN-AMP-LEX-KAN-AMI-CAZ-EMGEN-AMP-LEX-KAN-AMI-CAZ8GEN-AMP-LEX-CTX-KAN-AMI-STR-EMGEN-AMP-LEX-AMI-STR

表5 供体菌与转化子对16种抗菌药物的耐药情况
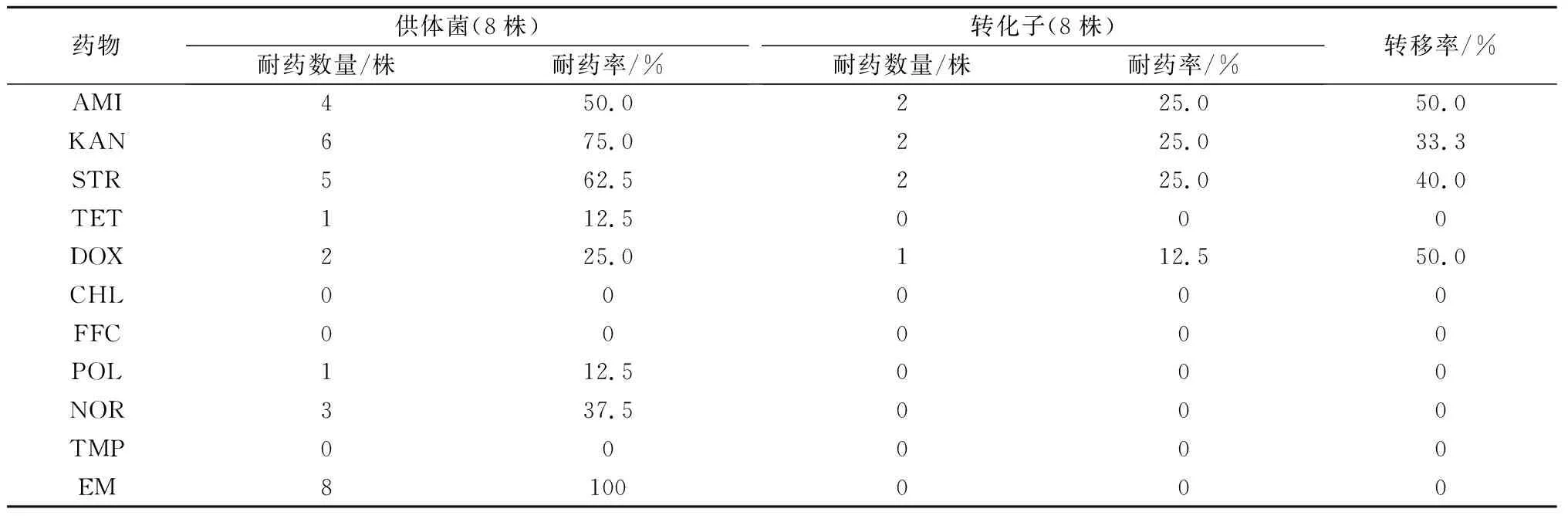
续表5 供体菌与转化子对16种抗菌药物的耐药情况
3 结论与讨论
大肠杆菌是奶牛子宫内膜炎重要的致病菌之一,对奶牛产业造成严重的经济损失。Clermont等[8]使用四重PCR系统分群方法将大肠杆菌分为A、B1、B2、C、D、E、F和cladeⅠ8个进化群。根据大肠杆菌系统发育研究结果,肠外致病性大肠杆菌主要分布在B2和D群,而共生性大肠杆菌则集中在B1和A群[16]。本研究将210株分离株共分成B1群(48.1%)、A群(28.6%)、C群(12.9%)、E群(6.7%)和D群(3.8%)5个群,且多重耐药菌株主要集中在B1群,A群仅对复方新诺明敏感。与曾莉[17]报道的3种不同来源大肠杆菌分为A群(45%)、B1群(16%)、F群(14%)、D群(6%)、C群(3%),未检出E群和B2群的进化结果相比,本试验分离大肠杆菌主要集中在A群,检测出E群而未检测出B2群。王一昊[3]对产后奶牛子宫内膜炎大肠杆菌系统发育分析发现,主要为B1群,其次是A群和D群,没有分离到B2群,并推断A群可能是主要的致病菌,而B1群是原住大肠杆菌或潜在的条件致病菌。Iranpour等[18]发现,分离自医院病人尿路感染的大肠杆菌中B2群(39.3%)分布最多,其次是未分型成功(27.1%)、E群(9.3%)、C群(6.4%)、clade Ⅰ 群(6.4%)、B1群(5%)、F群(2.9%)和D群(2.9%)。本试验中各进化群检出率与以上报道存在差异性,可能是由于地理位置和菌株来源的不同所造成。
药敏试验结果显示,分离株对大环内酯类、氨基糖苷类、β-内酰胺类耐药率较高,而对其他类药物耐药率较低。产ESBLs大肠杆菌占到总数的26.2%。多重耐药菌株主要集中在4~10耐,多重耐药率高达98.6%。Malinowski等[19]对99株分离自奶牛子宫内膜炎大肠杆菌耐药性进行分析,发现分离株对诺氟沙星最敏感,其次是庆大霉素,敏感率分别为100%和96%。韩淑芳等[20]从山西某奶牛场25份奶样中分离得18株金黄色葡萄球菌,发现对9种抗生素产生普遍耐药性,其中对阿莫西林耐药率最高,达77.8%。冯世文等[21]分析2016年采自25个广西猪场腹泻仔猪的200份样品,分离得103株致病性大肠杆菌,发现2016年广西猪源致病性大肠杆菌以广谱耐药为主,多为11重耐药以上,占74.8%。Laarem等[22]从新鲜的生鸡肉样本中分离出29株大肠杆菌,其中耐四环素的菌株占96.6%。本研究中分离株的药物敏感性试验与前人的研究结果存在差异,可能是因为临床用药及样品来源的不同所致。对blaTEM、blaCTX-M、blaSHV多种耐药基因检测发现,同时在39株携带rmtB基因的大肠杆菌中检测出blaTEM、blaCTX-M基因。在检测的4种氨基糖苷类修饰酶基因中,aac(6′)-Ⅰb分布最多,为88.1%。其他耐药基因检出率较少,但耐药基因之间存在交叉耐药,本试验耐药表型与耐药基因的检出率基本符合。建议临床上选择敏感性高的药物如诺氟沙星、复方新诺明、氯霉素等。Zhao等[23]对内蒙古地区奶牛子宫内膜炎大肠杆菌耐药基因检测,仅检测出blaTEM基因(100%),未发现blaCTX-M、blaSHV。底丽娜[24]报道新疆不同动物源耐药基因检出情况,32株牛源大肠杆菌中blaTEM和rmtB检出率分别为15.63%和50%,其中4株分离株同时带有blaTEM和rmtB基因。与以上研究相比,新疆地区奶牛子宫内膜炎大肠杆菌普遍存在耐药性,且耐药基因检出率较高,耐药问题更严峻,需引起重视。
耐药质粒是导致细菌产生耐药性的一个重要因素,耐药基因可通过耐药质粒转导、转化和结合等方式进行水平传播。有研究报道,产ESBLs基因中的CTX-M、TEM、SHV和氨基糖苷类中的rmtB基因通常由质粒介导,这些基因可同时在同一质粒上,并可通过转化进行传播和扩散[12,25]。本试验对质粒介导的ESBLs基因进行研究,成功获得了8株转化子,转化子含有原供体菌全部或部分质粒条带,均呈现出不同程度的耐药性,对头孢类药物耐药的菌株也对氨基糖苷类药物耐药。
