四环素类药物对鲤细胞色素P450酶系生化指标的影响
2018-08-20李在建刘文强司振书朱明霞
李在建,刘文强,司振书,朱明霞
(聊城大学 农学院,山东 聊城 252000)
四环素类药物是在鱼类上应用比较早的抗菌药物,具有疗效确定、抗菌谱广、方便安全的特点。它们对革兰氏菌、立克次体、螺旋体、支原体等均可产生抑制作用。对淡水鱼养殖中的鱼类赤鳍病、弧菌病、烂尾病及鲤科鱼类痘疮病具有较好的效果,在淡水鱼养殖过程中被大量使用。该类药物在鱼病防治上通常采用口服给药方式,用来治疗鱼类的全身感染或肠道疾病[1]。细胞色素P450是含有血红素的一组蛋白质,是一个由结构和功能相关的基因超家族编码的同工酶所组成的超家族酶系,该酶系主要分布在线粒体和内质网内膜上[2]。其主要生理功能是参与内源性物质和外源性物质的生物转化,在调节外环境与机体的相互作用以及保持机体内环境的稳定中起到至关重要的作用[3-5]。四环素类药物对肝药酶的影响在鱼类上研究较少,为此研究了4种四环素类药物对鲤肝细胞色素P450(CYP450)酶系生化指标的影响,旨在为进一步研究四环素类药物对探针药物在肝微粒体中代谢的影响提供依据。
1 材料和方法
1.1 试验动物
采用体质量为(350±30)g的健康鲤72尾,饲喂不含有抗菌药物的鲤全价饲料并采用循环水养殖,适应性饲养10 d,水的pH值保持在7.0。温控系统控制水池温度在(15±1)℃。
1.2 主要试剂
牛血清蛋白,购于Roche公司;NADPH,购于Roche公司;考马斯亮蓝G250,进口分装;细胞色素C,购于Sigma公司;一氧化碳,购于常州市京华工业气体有限公司;氨基比林、红霉素、二甲基亚砜,购于国药集团化学试剂有限公司;其余试剂为国产化学试剂,分析纯AR。
1.3 主要仪器和设备
低温高速离心机、低温超速离心机,Beckman公司生产;紫外可见分光光度计,尤尼柯(上海)仪器有限公司生产;电子天平(JY2002),上海市精密科学仪器有限公司生产;分析天平(BP211D),德国Sartoraus公司生产;漩涡混悬器,上海沪西分析仪器厂生产;HHS型不锈钢电热恒温水浴锅,武汉市琴台医疗器械厂生产;YKH性液体快速混合器,江西医疗机械厂生产。
1.4 给药处理
将试验鲤鱼随机分为6组,即空白对照组、溶剂对照组(二甲基亚砜)、土霉素(OTC)处理组、四环素(TC)处理组、金霉素(CTC)处理组和多西环素(DOTC)处理组。OTC、TC、CTC处理组按20 mg/kg·bw,DOTC处理组按5 mg/kg·bw,将药物溶于二甲基亚砜,灌入鲤鱼的前肠,对照组不做任何处理,溶剂对照组灌入等剂量的二甲基亚砜,每天一次无回吐者保留试验,连续处理5 d,第5天将鱼处死,制备鱼的肝微粒体,测定鲤的肝微粒体蛋白含量、氨基比林-N-脱甲基酶、肝脏细胞色素P450含量以及酶系的活性。
1.5 肝微粒体的制备
肝微粒体的制备参照文献[6-7],取出鲤肝脏,用生理盐水冲去血渍、滤纸擦干、称量。根据肝质量和体质量计算相对肝质量。微粒体采用差速离心法制备,即靠近肝门静脉处取肝脏4 g,放入小烧杯中,剪碎后按1∶3的比例加入匀浆缓冲液,用玻璃匀浆器在冰水浴中匀浆。匀浆液4 ℃、11 000×g高速离心20 min,上清液4 ℃、105 000×g超速离心60 min,红色沉淀即为肝细胞微粒体组分。将微粒体沉淀取出后用含250 mL/L甘油的KCl-磷酸盐缓冲液悬浮,每克肝加悬浮液1 mL涡旋混匀后分装于冻存管中,-80 ℃存放。
1.6 测定项目与方法
1.6.1 肝微粒体蛋白含量 BSA标准曲线的制备参照文献[8],取8支试管,标号,依次在试管中加入2 mg/mL BSA溶液0、10、20、30、40、50、60、70 μL,各管用超纯水补足至0.1 mL,得到0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mg/mL系列质量浓度的BSA溶液0.1 mL;然后加入5 mL Bradford应用液,立即混匀,25 ℃水浴10 min后,以空白管为对照,用紫外分光光度计在595 nm波长处进行比色,测定各管OD值。以系列质量浓度的牛血清白蛋白为横坐标,OD值为纵坐标,进行线性回归,计算牛血清白蛋白线性回归方程。
微粒体样品中蛋白质含量测定:做标准蛋白质定量的同时,另取试管加入2倍稀释的微粒体悬液0.1 mL,每个样品均做复管,以后操作同上,测定各样品的OD值,依据线性回归方程计算样品中蛋白质含量,并换算成每克肝中所含的微粒体蛋白含量。
1.6.2 细胞色素P450含量 参照文献[9],取微粒体悬液0.3 mL 并加入0.1 mol/L PBS缓冲液5.7 mL(pH值7.4)于试管中,再加入0.1 g/mL连二亚硫酸钠40 μL,立即混匀,静置2 min,等量分装到2个比色杯中,分别作为对照和样本,向样本杯中缓慢通入CO 60 s,稳定2 min,以对照杯调400 nm向500 nm扫描,CYP450含量计算公式如下:
1.6.3 NADPH-细胞色素C还原酶活性 取微粒体悬液0.2 mL并加入0.1 mol/L PBS(含0.1 mmol/L EDTA)缓冲液5.6 mL、5 mg/mL细胞色素C溶液0.2 mL于试管中,混匀,等量分装于对照杯和样品杯。样品杯内加5 mg/mL NADPH溶液20 μL,立即混匀,550 nm处测定吸光度,秒表计时,每30 s测定一次OD值,连续测5 min,计算公式如下:

1.6.4 氨基比林-N-脱甲基酶(AND)活性 甲醛标准曲线的制备:分别取0.1 mmol/L甲醛工作液0、0.1、0.2、0.4、0.8、1.0 mL,各管用超纯水补足至2.0 mL,加入Nash试剂2.0 mL,60 ℃水浴10 min,自来水冷却,以空白管调零,420 nm处测定各管的吸光度,以OD值为纵坐标,甲醛浓度为横坐标,绘制甲醛标准曲线。
AND活性测定参照文献[10],取含250 mL/L甘油的KCl磷酸盐缓冲液(0.15 mol/L KCl、0.1 mol/L PBS,pH值7.4)1.7 mL,加微粒体蛋白悬液0.1 mL,20 mg/mL氨基比林溶液0.1 mL 37 ℃水浴温孵2 min后,测定管加10 mmol/L NADPH溶液0.1 mL,空白管加蒸馏水0.1 mL 37 ℃水浴30 min。各管均加150 g/L ZnSO40.35 mL,混匀,冰浴5 min,加饱和Ba(OH)20.35 mL,混匀,放置5 min后3 000 r/min离心5 min。取上清液2.0 mL加Nash试剂2.0 mL,以后操作同甲醛标准曲线制备。根据标准曲线计算酶活性,以甲醛的产生速度表示AND的活性[nmol/(mg·min) ]。
1.6.5 红霉素-N-脱甲基酶(ERND)活性 参照文献[11],在反应体系中,红霉素终浓度为0.4 mmol/L,其余步骤同氨基比林-N-脱甲基酶活性测定。
1.6.6 苯胺-4-羟化酶(AH)活性 4-氨基酚标准曲线的制备:分别取50 μmol/L 4-氨基酚0、0.1、0.2、0.4、0.6、0.8、1.0 mL,用60 g/L的TCA补足至1 mL,加10 mL/L的酚1 mL,混匀,加1 mol/L的碳酸钠1 mL,混匀,室温放置30 min,空白管调零,630 nm处测吸光度。以OD值为纵坐标,4-氨基酚浓度为横坐标,绘制4-氨基酚标准曲线。
AH活性的测定参照文献[12],取1 mmol/L NADPH溶液1 mL和盐酸苯胺溶液0.5 mL,置于10 mL试管内混匀,对照管加0.l mol/L PBS缓冲液(pH值7.4)1.0 mL取代NADPH溶液,37 ℃水浴2 min。各管加0.5 mL微粒体悬液,37 ℃水浴再温孵30 min,加冰冷的200 g/L的TCA 1 mL终止酶反应,冰浴5 min,11 000 r/min离心10 min,取1 mL上清液于另一试管,以后操作同4-氨基酚标准曲线制备,根据OD值和标准曲线计算酶活性,以4-氨基酚的生成速度表示AH的活性[nmol/(mg·min)]。
2 结果与分析
2.1 标准曲线的制定
牛血清蛋白标准曲线(图1):以一系列牛血清蛋白浓度作为横坐标,OD595值为纵坐标绘制标准曲线。得到标准曲线的线性方程:y=0.613x+0.001 9,r=0.999 3。通过标准曲线可知牛血清蛋白质量浓度和OD值线性关系良好,可用于肝微粒体蛋白质量浓度的测定。

图1 牛血清蛋白的标准曲线
甲醛标准曲线(图2):以一系列甲醛浓度作为横坐标,OD420值为纵坐标绘制标准曲线。得到标准曲线的线性方程:y=3.700 1x-0.002 8,r=0.999 4。通过标准曲线可知甲醛浓度和OD值线性关系良好,可用于反应过程中4-氨基酚浓度的测定,间接测定AND活性。
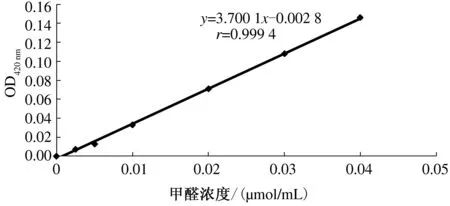
图2 甲醛的标准曲线
4-氨基酚标准曲线(图3):以一系列4-氨基酚系列浓度作为横坐,OD630值为纵坐标绘制标准曲线。得到标准曲线的线性方程:y=0.010 3x-0.003 0,r=0.998 8。通过标准曲线可知4-氨基酚浓度和OD值线性关系良好,可用于反应过程中4-氨基酚浓度的测定,间接测定AH的活性。
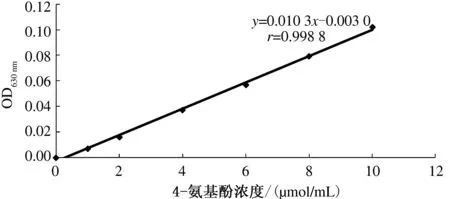
图3 4-氨基酚的标准曲线
2.2 4种四环素类药物对鲤肝微粒体蛋白及CYP450酶系含量的影响
试验结果见表1。空白试验结果表明,该试验具有较好的重复性,可作为鲤肝微粒体酶CYP450酶系的检测方法和用来探讨研究药物对肝微粒体酶CYP450酶系影响的研究方法。
空白对照组CYP450含量为(0.39±0.03)nmol/mg,OTC、TC、CTC和DOTC处理组CYP450含量分别为(0.22±0.02)、(0.28±0.02)、(0.21±0.03)、(0.25±0.03)nmol/mg,与空白对照组相比较具有极显著差异;空白对照组NADPH-细胞色素C还原酶活性与4种四环素类药物的活性差异不显著;空白对照组AND活性为(1.27±0.09)nmol/(min·mg),OTC、TC、CTC和DOTC处理组其活性分别为(0.86±0.09)、(0.79±0.05)、(0.84±0.05)、(0.86±0.06)nmol/(min·mg),与空白对照组相比较差异极其显著;空白对照组ERND活性为(0.85±0.04)nmol/(min·mg),OTC、TC、CTC和DOTC处理组其活性分别为(0.63±0.03)、(0.57±0.02)、(0.49±0.04)、(0.52±0.02)nmol/(min·mg),与空白对照组相比差异极其显著;空白对照组AH活性为(0.034±0.001)nmol/(min·mg),OTC、TC、CTC、DOTC处理组其活性分别为(0.026±0.004)、(0.027±0.003)、(0.025±0.004)、(0.028±0.004)nmol/(min·mg),与空白对照组相比差异显著。

表1 四环素类药物对鲤肝微粒体蛋白及CYP450酶系含量的影响(n=12)
注:*表示与空白对照组具有显著差异(P<0.05), **表示与空白对照组具有极显著差异(P<0.01)。
3 结论与讨论
药物间相互作用可发生在吸收、分布、代谢和排泄4个阶段,代谢性相互作用发生率较高,大约占药物相互作用的40%[13]。在外源化合物的生物转化中CYP450酶系起着非常重要的作用,其活性决定着药物的代谢速率,是药物相互作用的主要原因。药物间相互作用70%是由酶的抑制作用引起的,其中酶抑制作用导致药物相互作用的临床意义大于酶的诱导作用[14]。
空白对照组和溶剂(二甲基亚砜)对照组测得的CYP450酶系的活性差异不显著,说明本次试验选用的溶剂二甲基亚砜对鲤肝微粒体酶CYP450酶系的活性没有影响。空白组数据表明,鲤在冬季水温条件下肝药酶CYP450酶系的含量及活性较其他鱼类和动物的活性偏低[15-16],这可能是鲤的药物代谢速率较其他鱼类慢的原因。通过统计分析可以看出四环素类药物OTC、TC、CTC、DOTC对鲤肝微粒体蛋白含量,细胞色素b5(CYPb5)的活性、NADPH-细胞色素C还原酶活性没有明显的影响,对CYP450含量,AND、ERND的活性具有显著的抑制作用,该研究结果与作者研究的磺胺类药物对鲤CYP450酶系的影响存在一定的差异[17]。试验结果说明四环素类药物在一定程度上能够抑制CYP450酶系的活性,部分药物(与AND、ERND代谢相关)在和四环素类药物联合使用时,其在鲤体内的代谢会明显受到抑制,甚至会由于药物间相互作用出现蓄积现象,进而出现毒性反应。
四环素类药物为广谱抗菌药物,广泛应用于治疗水产动物革兰氏阳性和阴性细菌引起的感染。其主治由弧菌、嗜水气单胞茵等细菌引起的鱼类疾病。能有效地预防和治疗养殖鲤鱼的仔鱼育苗期和商品鱼养成期的腹水病,也可治愈多种细菌性病原造成的和不同地域发生的腹水病[18]。四环素类药物在鲤养殖过程中使用广泛,但本研究结果表明该类药物对鲤CYP450酶系存在一定程度的抑制作用(AND、ERND活性),因此其他药物和四环素类药物在鲤上同时使用时应该格外慎重,防止出现药物蓄积或毒性反应。
综上,CYP450酶的体内试验和临床药物应用试验存在一定的差异。因此,药物与药物之间的相互作用,以及解释药物之间配伍的科学理论依据需要进行更加深入的研究。本试验可为探讨四环素类药物对鲤疾病控制过程中的合理使用提供理论基础。
