相变型纳米红细胞用于多模态成像引导下增强光动力治疗:体外实验
2018-08-20王志刚陈雪莹赵钕君姚元志
张 亮,杨 珂,王 冬,王志刚,王 颖,陈雪莹,赵钕君,姚元志
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所 超声分子影像重庆市重点实验室,重庆 400010;3.重庆医科大学附属儿童医院儿科研究所,重庆 400014;4.重庆大学附属肿瘤医院 重庆市肿瘤研究所 重庆市肿瘤医院超声科,重庆 400030)
光动力治疗(photodynamic therapy, PDT)依靠光敏剂将吸收到的光能转换给氧气并产生单线态氧,从而对靶细胞产生毒性并杀死细胞,达到抗肿瘤治疗的目的[1-2]。PDT的疗效可因肿瘤部位氧气供应不足而下降[3],而绝大多数肿瘤均处于乏氧微环境中[4],且PDT治疗对氧气的消耗及造成的血管封闭效应也会造成肿瘤部位氧含量进一步降低,影响PDT疗效,使得PDT的应用受到极大限制[5]。为解决这一难题,本研究以具有良好溶氧性的全氟己烷(Perfluoropentane, PFP)为核心[6],磷脂双分子层镶嵌脂溶性的光敏剂IR780[7]为外壳,制备一种近红外波段响应的相变型自供氧壳核结构纳米红细胞(nano red blood cells, Nano-RBCs),用于改善肿瘤乏氧微环境,提高PDT疗效。
1 材料与方法
1.1 相变型Nano-RBCs制备 采用一步乳化法制备Nano-RBCs。将12 mg二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidylcholine, DPPC)、4 mg二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(distearoyl phosphoethanolamine-polyethylene glycol 2000, DSPE-mPEG2000)及1 mg IR780碘化物(Sigma公司)溶解于5 ml三氯甲烷(CHCl3)中,55℃旋转蒸发去除CHCl3成膜,以4 ml磷酸盐缓冲液(phosphate Buffer solution, PBS)洗脱磷脂膜,转移至10 ml EP管中。向EP管中加入400 μl PFP(Sigma公司)后,采用Heat System声振仪于冰浴下声振3 min(功率100 W,每震5 s停5 s)。于4 ℃下水洗离心3次(转速3 000 rot/min,每次3 min),以去除未包载的IR780。以PBS重悬至4 ml,置于4 ℃备用。使用前向重悬液中通入高纯氧(纯度≥99%)10 min,即为相变型Nano-RBCs。
1.2 一般性质检测 采用Olympus光学显微镜及Malvern粒径仪,观察相变型Nano-RBCs形态,检测粒径大小,并评价其分布情况。以N,N-二甲基甲酰胺(N,N-dimethylformamide, DMF)将IR780溶解至不同浓度(0.38、0.75、1.50、3.00、6.00 μg/ml),采用Shimadzu UV-2500紫外-可见分光光度计测量其吸收特性,计算IR780的包封率。采用YSI 550A便携式溶氧仪测量相变型Nano-RBCs在脱气水中的氧含量。
1.3 体外多模态成像
1.3.1 超声显像 将相变型Nano-RBCs溶于PBS中,配置为不同浓度(125、250、500 μg/ml)的溶液,注入凝胶模型中;采用ADR-1860激光发射器以808 nm波长激光(强度1.00 W/cm2)辐照不同时间(0、2、4、6 min)。以EC123高频线阵探头在基波和谐波模式下观察凝胶模型中相变型Nano-RBCs超声显影情况,并以DFY-Ⅱ型超声图像定量分析仪(重庆医科大学超声影像学研究所研制)分析各靶区声强值。
1.3.2 光声成像 将2 mg/ml相变型Nano-RBCs的PBS溶液加入凝胶模型中,采用Vevo LAZR光声成像系统进行波长680~970 nm(步长为5 nm)脉冲激光辐照,采集光声信号,寻找光声成像的最佳激发波长。将不同浓度(0.40~2.00 mg/ml)相变型Nano-RBCs的PBS溶液注入凝胶模型中,以最佳激发波长脉冲激光辐照后,采集光声图像并对光声信号值进行定量分析。
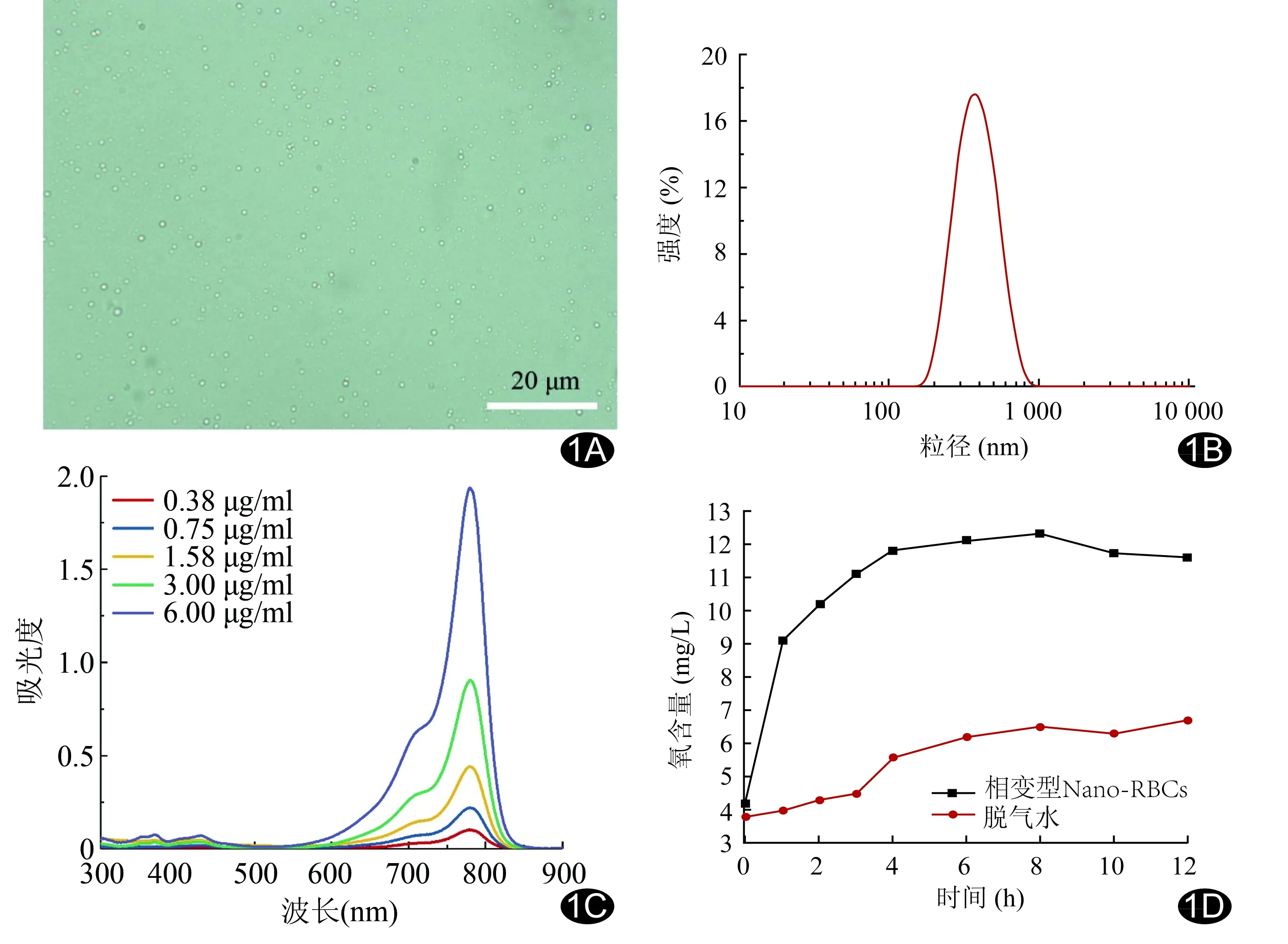
图1 相变型Nano-RBCs基本表征 A.光镜下图像(×1 000); B.粒径分布图; C.不同浓度(0.38、0.75、1.50、3.00、6.00 μg/ml)IR780紫外-可见光的吸收光谱图; D.相变型Nano-RBCs与脱气水的释氧曲线图
1.3.3 荧光成像 配置浓度为0.13、0.25、0.50、1.00、2.00 mg/ml的相变型Nano-RBCs的胎牛血清重悬液,每种浓度分别取100 μl置于96孔板孔洞中。采用IVIS荧光成像系统进行扫描,激发波长745 nm,发射波长820 nm,以系统自带软件沿各管内径勾画ROI,测量荧光信号强度。
1.4 相变型Nano-RBCs载氧对PDT的影响 配置不同IR780浓度(1.00、2.00、3.00、4.00、5.00 μg/ml)的相变型Nano-RBCs及单纯IR780的PBS溶液[均含单线态氧荧光探针(singlet oxygen sensor green, SOSG),浓度10 μmol/L)],每种浓度溶液设置3个样品,置于3 ml比色皿中。以808 nm波长激光(强度1.00 W/cm2)辐照5 min后,采用Spectra Max M2型多功能酶标仪测其荧光值,激发波长488 nm,发射波长525 nm。
1.5 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,采用单因素方差分析比较相变型Nano-RBCs与单纯IR780的单线态氧所致荧光强度的变化。P<0.05为差异有统计学意义。
2 结果
2.1 相变型Nano-RBCs的一般性质 制备的相变型Nano-RBCs外观呈墨绿色的均一圆形(图1A),平均粒径为(372.50±87.30)nm(图1B),分散性好[聚合物分散性指数(polymer dispersity index, PDI)为0.10]。紫外吸光谱可见IR780在780 nm处出现最大吸收峰(图1C),吸光度随浓度的增加而增加,在780 nm处的标准曲线回归方程为:Y=0.2671X-0.0298(R2=0.999)。根据标准曲线回归方程计算IR780的包封率为92.50%。体外释氧曲线示相变型Nano-RBCs可长效释放大量氧气(图1D)。
2.2 相变型Nano-RBCs的体外多模态成像表现 超声显像:相变型Nano-RBCs经激光辐照后呈强回声(图2A),定量分析示相变型其基波和谐波回声强度均随浓度和辐照时间变化,浓度越高、辐照时间越长,超声造影效果越好(图2B)。在680~970 nm波长激光辐照下相变型Nano-RBCs均可表现出光声信号,波长780 nm处光声信号最强(图2C)。光声显像:在780 nm波长辐照下,随相变型Nano-RBCs浓度越高,光声信号越强(图2D、2E),呈线性改变:Y=0.0328X+0.6401(R2=0.9911)。体外荧光成像:随相变型Nano-RBCs浓度增高,荧光强度增强(图2F、2G)。
2.3 相变型Nano-RBCs载氧对PDT的增效 在808 nm波长激光辐照下,相变型Nano-RBCs与单纯IR780的SOSG荧光强度均随浓度增高而增大,且包载PFP的相变型Nano-RBCs的SOSG荧光强度较单纯IR780明显增强(P均<0.05,图3)。
3 讨论
PDT是20世纪70年代末开始形成的一项肿瘤治疗技术[8],是由光能激发光敏剂后引起光化学反应来选择性地破坏肿瘤细胞,具有创伤小、不良反应少、选择性好、可重复治疗等优点[9-10]。其作用基础是光动力效应,这是一种有氧分子参与的伴随生物效应的光敏化反应,主要过程为:以特定波长的光照射使组织吸收的光敏剂受到激发;激发态的光敏剂将能量传递给周围的氧气,生成强活性的单线态氧;单线态氧与相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致细胞受损乃至死亡[11]。氧对PDT具有重要作用。然而,乏氧微环境是实体肿瘤的重要特征,多数实体肿瘤由于细胞代谢旺盛而导致氧含量要远低于正常组织;此外,在PDT过程中也会消耗氧气并破坏、封闭血管,进一步加剧肿瘤的乏氧情况,降低PDT的敏感度。目前改善PDT过程中乏氧情况的方法包括:①间断辐照[12],在激光辐照的间隙,血供恢复,供氧增加,但在血管完全破坏后此法无效;②降低辐照功率[13],虽然可在一定程度上缓解肿瘤组织中氧含量低的问题,但降低辐照功率会使光动力效率随之降低;③高压氧舱[14],能够有效增加肿瘤组织的氧含量,但持续高浓度氧气可引发一些不良反应。
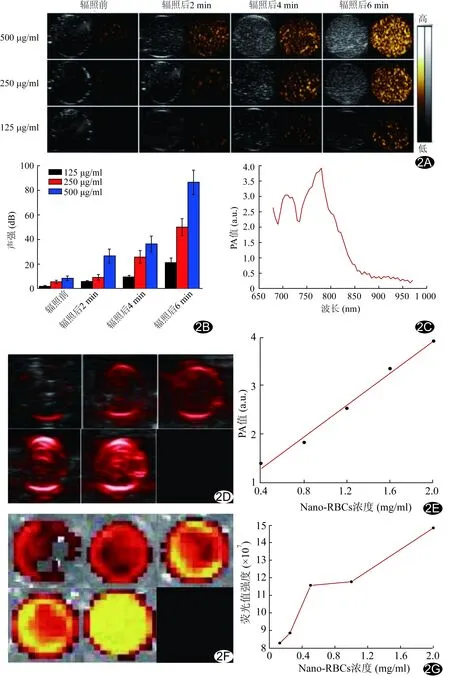
图2 相变型Nano-RBCs的体外多模态成像 A、B.不同浓度(125、250、500 μg/ml)相变型Nano-RBCs光致相变后超声图像(A)及定量分析图(B); C.2 mg/ml相变型Nano-RBCs在680~970 nm波长内光声信号变化; D.不同浓度(0.40~2.00 mg/ml)相变型Nano-RBCs光声成像图(D)及定量分析(E); F、G.不同浓度(0.13、0.25、0.50、1.00、2.00 mg/ml)相变型Nano-RBCs荧光成像图(F)及定量分析(G)
PFP是一种具有高溶氧量且安全、可靠的材料[15]。本研究成功制备出包载富氧PFP和光敏剂IR780的相变型Nano-RBCs,不仅可用于体外多模态显像,且能实现自供氧以增益PDT。一方面,相变型Nano-RBCs核心PFP能直接、长效地为光敏剂提供氧气;另一方面,相变型Nano-RBCs能够在其内溶解的氧分子消耗后自发富集肿瘤组织中的氧气,以维持光动力反应的氧消耗。相变型Nano-RBCs不受肿瘤组织乏氧微环境的限制,有助于克服PDT光动力反应耗氧及血管损伤效应的短板。
IR780脂溶性较好,易包裹于脂质体的磷脂双分子层中。本研究采用一步乳化法制备以PFP为核心、磷脂双分子层和光敏剂为外壳的壳核结构液气相变型Nano-RBCs,其形态均一,分散性好,IR780包封率达92.50%,脂质体粒径呈正态分布,平均粒径(372.50± 87.30)nm。这种大小的纳米粒可通过增强渗透与滞留效应(enhanced permeation and retention effect, EPR)蓄积到实体肿瘤内部。本研究中,紫外吸收光谱显示IR780在近红外区具有强吸收,在780 nm处可见最大吸收峰。此外,本研究发现相变型Nano-RBCs能长效存储并释放大量氧气,从而增强PDT疗效。

图3 Nano-RBCs载氧对PDT的增效 不同IR780浓度(1.00、2.00、3.00、4.00、5.00 μg/ml)下经激光辐照后相变型Nano-RBCs与单纯IR780的SOSG荧光强度对比 (*:P<0.05)
多模态成像通过不同的影像学成像方式将图像进行对比分析,取长补短,获得更丰富的信息对疾病进行诊断[16]。除本身是一种良好的载氧体外,PFP所构建的液气相变型纳米粒也可作为超声分子探针,在超声显像和治疗中发挥重要作用[17-18]。本研究多模态成像中,超声显像结果显示,在激光辐照下PFP可发生液气相变,其回声强度随浓度和辐照时间增加而增强,不仅表明脂质体成功包裹PFP,还表明相变型Nano-RBCs可作为超声造影剂完成对肿瘤的示踪。IR780是一种近红外光敏剂,亦可产生光声信号。本研究体外光声显像实验中,光声信号值在780 nm处出现最大吸收峰,与紫外吸收光谱一致,且光声信号随相变型Nano-RBCs浓度增高而增强,表明IR780被成功包载,相变型Nano-RBCs可用于光声成像。此外,本研究发现,随相变型Nano-RBCs浓度增高,体外荧光成像的荧光强度逐渐越强。本研究结果显示,激光辐照下相变型Nano-RBCs及单纯IR780的SOSG荧光强度均随浓度增高而增大,且相变型Nano-RBCs的SOSG荧光强度明显高于单纯IR780,表明二者均可随浓度增高而产生更多的单线态氧,且相变型Nano-RBCs的单线态氧产量更高。
本研究成功制备出一种能够携氧的近红外响应、可光致相变的纳米级红细胞,并通过体外实验证实其可用于超声/光声/荧光三模态成像,并具有体外增效PDT的功能,有望为多模态显像引导肿瘤治疗的发展提供新的思路。
