MiR-125b对心肌梗死后成纤维细胞的调控机制研究
2018-08-18沈志方许学升孙继兰
沈志方,许学升,孙继兰
在我国,冠状动脉粥样硬化性心脏病(冠心病,CHD)尤其是急性心肌梗死的发病率和死亡率一直居高不下,甚至呈逐年上升趋势[1]。大量研究表明,心肌和细胞外基质因适应不良变化而致心室病理性重构是心肌梗死进展的重要病理过程[2]。在心室重构的过程中往往会积累较多的促炎因子和血管活性因子,促使心脏成纤维细胞(CFs)的增殖和活化,从而导致心肌过度纤维化[3]。因此抑制CFs活化和心室重构,减轻心肌纤维化的发生具有十分重要的临床意义。近些年,微小核糖核酸(miRNAs)在心血管疾病诊断和治疗领域表现出巨大的潜力,参与机体多种生理病理调控过程,包括动脉粥样硬化板块的形成、心肌梗死后血管再生、心室重构等[4,5]。研究发现,miRNA-125b在静止期成纤维细胞中表达上调,抑制成纤维细胞的增殖[6]。目前关于miR-125b对心肌梗死后成纤维细胞的生物学行为具体的调控作用及可能的作用机制探讨尚少。本研究通过采用脂质体转染的方法上调/下调成人心脏成纤维细胞(HCF-a)中miR-125b的表达水平,探讨miR-125b对HCF-a胶原合成的影响以及可能的作用机制,为冠心病患者提供新的治疗选择。
1 材料与方法
1.1 细胞来源成人HCF-a细胞购自American Type Culture Collection公司。
1.2 主要试剂miR-125b模拟物由上海生工生物工程有限公司合成并提供;BCA蛋白浓度测定试剂盒,购自中国博士德生物工程有限公司;cDNA合成试剂盒、荧光定量PCR试剂盒、细胞凋亡试剂盒,购自美国OMEGA生物公司;抗体,购自美国Abcam公司。脂质体Lipofectamine 2000、Opti-MEM培养基、心脏成纤维细胞培养基,购自美国Invitrogen公司;DMEM高糖细胞培养基,购自美国GIBCO公司;胰蛋白酶-EDTA细胞消化液(0.25%),购自北京钮因华信科技发展有限公司;FBS胎牛血清和链霉素-青霉素双抗,购自美国ThermoFisher公司。Trizol,购自美国Invitrogen公司;DEPC,购自美国Sigma公司;30%H2O2,购自上海碧云天生物技术有限公司;磷酸盐缓冲液、氯仿、异丙醇、无水乙醇,购自国药集团化学试剂有限公司;生理盐水,购自安徽双鹤药业有限责任公司。
1.3 主要仪器GTR16-2型高速台式冷冻离心机,购自北京时代北利离心机有限公司;实时定量PCR仪,购自美国MJ Research公司;UV-8000紫外分光光度计,购自上海精密仪器仪表公司;多功能酶标仪,购自日本Bio-Rad公司;CX41倒置光学显微镜和OLS4100激光共聚焦显微镜,购自日本奥林巴斯医疗公司;电子分析天平,购自上海玉研科学仪器有限公司;Amersham电泳仪,购自瑞典Bioscience公司;恒温水浴摇床和YCZ-40D型转移电泳槽,购自北京六一仪器厂;FluorChem FC3凝胶成像数码分析系统,美国ProteinSimple公司。
1.4 实验方法
1.4.1 细胞培养将HCF-a细胞培养在含有10%FBS的成纤维细胞培养基中,将细胞置于37℃,5%CO2细胞培养箱中进行培养。24~48 h更换培养液,48 h传代一次。
1.4.2 细胞转染提前1 d在相应备行转染的6孔板上接种5×108个细胞,培养24~48 h后,融合率达到50%~60%,在不同2 ml无菌EP管中分别加入适量生理盐水,然后按照脂质体转染说明书,在EP管中分别加入5 μl miR-125 b模拟物和250 μl无血清Opti-MEM培养基,混匀,室温放置10 min;另外在5 ul脂质体Lipofectamine 2000溶液中加入250 μl无血清Opti-MEM培养液,振荡混匀后,室温放置10 min;将上述两种溶液吹打混匀,室温放置30 min;将脂质体-质粒DNA复合液滴加至孔板细胞表面,置于37℃,5%CO2细胞培养箱中培养24~48 h。提取细胞RNA及蛋白,验证目的基因表达情况及转染效率。
1.4.3 实验分组分为空白对照组和miR-125b模拟物转染组。
1.4.4 MTT法检测细胞增殖活性将HCF-a细胞(2×105个/孔)单层接种到96孔板中,置于37℃,5%CO2细胞培养箱中进行培养,每组设置8个平行孔,每隔24 h选择6个重复孔加入20 μl MTT,置于37℃,5%CO2细胞培养箱中孵育4 h后,弃除上清液,每孔加入200 μl DMSO,置于振动器上震动5 min,置于显微镜下观察无紫色结晶物。将96孔板放置于450酶标仪上,检测波长为570 nm,参比波长为450 nm处的吸光光度值(OD值),计算平均值。
1.4.5 迁徙与侵袭实验采用胰蛋白酶消化细胞,将细胞置入离心管中,离心,弃上清;加入无血清的DMEM重悬;调整细胞浓度为3×103个/ml。将100 μl HCF-a细胞(5×104个/孔)单层接种到24孔板中由聚碳酸酯膜嵌套的transwell小室中,外部小室中放入600 μl含有10%FBS的成纤维细胞培养液,置于37℃,5%CO2细胞培养箱中孵育12 h;将侵袭小室内部用4%多聚甲醛固定30 min,再用PBS进行清洗;然后用0.1%的结晶紫将外部小室进行染色30 min,显微镜下观察穿过膜的细胞数,计算迁移率。
1.4.6 流式细胞术检测细胞凋亡率收集细胞调整至1×106/ml,采用PBS清洗细胞两次,加入500 μl binding buffer悬浮细胞,加入5 μl Annexin V-FITC和5 ul碘化丙啶,混匀,避光孵育15 min,上机检测。
1.4.7 提取总RNA①收集细胞1×1010个,置于EP管中;②加入1 ml预冷的Trizol,充分混合均匀,静置5~10 min;③加入200 μl氯仿,震荡30 s,静置5~10 min;④12 000 rpm离心,取上清;⑤加入500 μl异丙醇,震荡30 s,静置5~10 min;⑥12 000 rpm离心,弃上清;⑦加入1 ml 75%乙醇,震荡30 s,12 000 rpm离心,弃上清;⑧将EP管倒置于滤纸上,将RNA充分干燥;⑨加入20 μl DEPC水溶解沉淀,分装,置于-80℃保存备用。采用凝胶电泳检测RNA分子量;采用分光光度计检测RNA浓度。
1.4.8 RNA逆转录根据试剂盒说明书操作进行。将cDNA保存至-20℃保存备用。
1.4.9 实时定量PCR将20 μl反应体系置于37℃恒温水浴60 min,85℃ 5 s,加入去离子水至100 μl,各反应孔取2 μl进行PCR。冰浴中配制20 μl PCR反应体系,95℃ 30 s预变性,95℃ 5 s,60℃ 30 s,循环45次。引物序列如下: Col-Ⅰ(上游引物:5’-TGGCGATGGCAGTGTCTTAG-3’;下游引物:5’-GTGCAGGGTCCGAGGT-3’);Col-Ⅲ(上游引物:5’-CAGCTTTGAG GTTCGTGTTTGT-3’;下游引物:5’-ATGCTCTTCTTTTTTGCGGAAA -3’);α-S M A(上游引物:5’-C A G C T T T G A G G T T C G T G T T T G T-3’;下游引物:5’- A T G C T C T T C T T T T T T G C G G A A A-3’); TGF-β1(上游引物:5’-GTG TGGAGCAACATCTGGCCTCTA-3’;下游引物:5’- TTGGTTCAGCCACTGCCGAT-3’);β-actin(上游引物:5’-TGGC GATGGCAGTGTCTTAG-3’;下游引物:5’-GTGCAGGGTCCGAGGT-3’)。
1.4.10 Western blot①提取蛋白样品;②蛋白样品凝胶电泳;③转膜;④封闭;⑤加入一抗孵育;⑥加入二抗孵育;⑦显影;⑧采用化学发光法检测膜上的蛋白表达条带,采用FluorChem FC3凝胶成像数码分析系统进行定量分析,以积分光密度(IOD)表示灰度值。
1.5 统计学方法采用SPSS 19.0统计学软件进行数据分析处理。数据符合正态分布采用单因素方差分析进行多组间比较,两组间比较采用t检验;数据非正态采用秩和检验进行组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 MTT法检测miR-125b对HCF-a细胞增殖活性的影响经MTT检测结果显示,随着细胞生长时间的延长,miR-125b模拟物转染细胞系生长速度明显高于空白对照组,尤其是96 h之后,两组细胞的OD值逐渐出现统计学差异(P<0.05)(表1,图1)。

表1 不同检测时间点miR-125b对HCF-a细胞增殖活性的影响
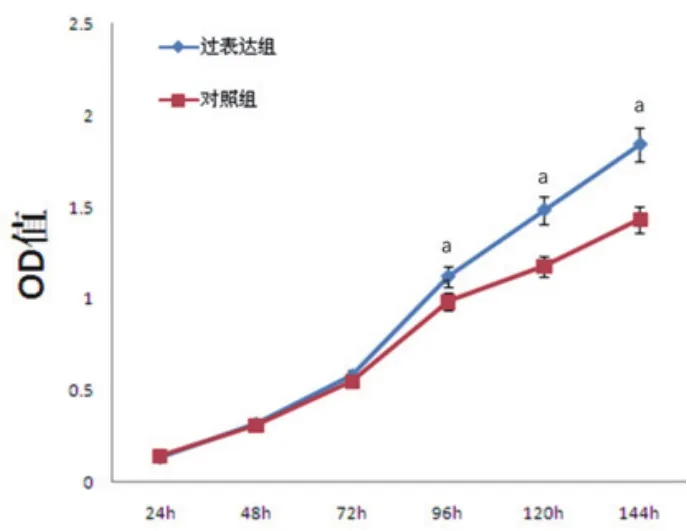
图1 不同检测时间点miR-125b对HCF-a细胞增殖活性的影响
2.2 miR-125b对HCF-a细胞胶原合成能力的影响经PCR和western blot检测结果显示,与空白对照组比较,miR-125b过表达对HCF-a细胞Ⅰ型和Ⅲ型胶原mRNA和蛋白水平均有明显上调作用,有统计学差异(P<0.05)(表2,图2)。
2.3 miR-125b对HCF-a细胞活化能力的影响α-SMA是肌成纤维细胞活化的重要标志物。经PCR和western blot检测结果显示,与空白对照组比较,miR-125b过表达对HCF-a细胞α-SMA mRNA和蛋白水平均有明显上调作用,有统计学差异(P<0.05)(表3,图2)。
2.4 miR-125b对HCF-a细胞转移能力的影响与空白对照组相比,过表达miR-125b可明显提高HCF-a细胞体外迁移能力,有显著的统计学差异(P<0.05)(图3)。
2.5 miR-125b对HCF-a细胞凋亡的影响经流式细胞术检测结果显示,与空白对照组相比,miR-125b过表达可明显抑制HCF-a细胞的凋亡,有统计学差异(P<0.05)(表4)。
2.6 miR-125b对TGF-β1通路的调控作用经RT-PCR检测结果显示,与空白对照组比较,miR-125b过表达可明显促进TGF-β1 mRNA的表达水平(P<0.05);经western blot检测结果显示,与空白对照组比较,miR-125b过表达对HCF-a细胞Smad2/Smad3蛋白磷酸化水平均有明显上调作用,有统计学差异(P<0.05)(表5、图4~5)。
3 讨论
心肌梗死会引发心肌细胞、成纤维细胞或细胞外基质代偿性活化,从而促使大量胶原蛋白分泌,损伤心肌功能,造成心室重构、心肌纤维化等病理进程,最终导致心力衰竭[7]。非梗死区心肌纤维化是引发进展性心室重构的关键环节,因此如何调控心肌细胞成纤维化是防止心力衰竭的重要研究方向[8]。

图2 miR-125b过表达对HCF-a细胞胶原Ⅰ、胶原Ⅲ和α-SMA mRNA和蛋白表达的影响

表2 miR-125b对HCF-a细胞胶原Ⅰ和胶原Ⅲ合成能力的影响

表3 miR-125b对HCF-a细胞α-SMA mRNA和蛋白表达的影响
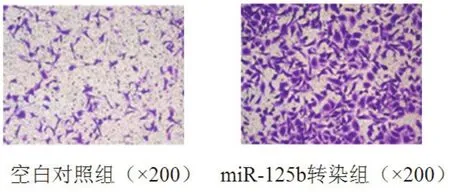
图3 过表达miR-125b对HCF-a细胞迁徙能力的影响

表4 miR-125b对HCF-a细胞凋亡率的影响

表5 miR-125b对HCF-a细胞TGF-β1、p-Smad2、p-Smad3表达的影响

图4 miR-125b过表达对HCF-a细胞TGF-β1 mRNA表达的影响

图5 miR-125b过表达对HCF-a细胞p-Smad2/Smad3蛋白表达的影响
MicroRNAs作为内源性非编码小分子RNA,可通过结合靶mRNA的3’端非编码区,编码区或5’非编码区,在转录后水平调节基因的表达,抑制或降解靶mRNA的翻译,从而参与细胞凋亡、增殖、分化等多种病理生理过程[9]。有研究显示,miR-125b可以调控CFs细胞的增殖、活化和凋亡,但是可能的作用机制尚不清楚[10]。根据国内外研究现状,转化生长因子β(TGF-β)与成纤维细胞活化密切相关,其中TGF-β1是重要的亚型分子之一,可以通过抑制胶原酶的分泌和细胞外间质成分的降解,促使CFs向肌成纤维细胞转化[11,12];miR-125b是否也参与了对TGF-β1的调控是我们研究的目的。本项研究中,选择稳定性良好的人成纤维细胞HCF-a,分离子成年人心房组织,实验差异较小。CFs属于合成胶原的非心肌细胞,同时也是分泌细胞外基质的主要细胞,CFs的增殖和转化是参与心肌纤维化和心室重构的关键环节[13]。本项研究首先体外将miR-125b模拟物转染至HCF-a细胞,对比空白对照组和miR-125b过表达组细胞增殖、胶原合成能力、分化、转移能力和凋亡的影响。结果显示,miR-125b过表达可促使HCF-a细胞增殖、胶原Ⅰ和Ⅲ的合成、活化相关标志物α-SMA的表达、转移,另外,miR-125b也参与成纤维细胞的凋亡。Ghosh等研究发现,miR-125b可能与内皮细胞-间质细胞的转化过程密切相关。其中TGF-β1/Smad通路是参与调控内皮细胞-间质细胞转化的重要途径,CFs和肌成纤维细胞是分泌TGF-β1的主要细胞,TGF-β1大量聚集又会反馈性促使CFs转化为肌成纤维细胞,从而导致心肌纤维化,甚至引发心力衰竭。Smad2/Smad3是与TGF-β1信号传递密切相关的特异性底物蛋白,通过RT-PCR和western blot方法探讨miR-125b对TGF-β1基因及TGF-β1通路下游核心调控蛋白Smad2/Smad3磷酸化的影响,结果显示,过表达miR-125b可明显上调TGF-β1 mRNA和p-Smad2/Smad3蛋白的表达,从而提示TGF-β1通路可能是miR-125b参与调控成纤维细胞一系列生物学行为的作用靶途径。但其关键的作用靶点或者靶基因仍然需要进一步研究探讨。
总之,抑制TGF-β1/Smad通路引起的心肌纤维化,是治疗心肌梗死后进展至心力衰竭的关键。随着对mi RNAs研究的深入,越来越多的mi RNAs被发现参与心脏成纤维细胞的增殖、活化、凋亡等生理病理过程,这将为mi RNAs用于临床心血管疾病抗心衰治疗提供理论基础。综上所述,本项研究证实miR-125b可以通过上调TGF-β1 基因和特异性底物蛋白Smad2/Smad3的磷酸化参与促使心脏成纤维细胞向肌成纤维细胞转化,因此miR-125b可作为心肌纤维化的干预靶点,为后续心血管疾病的治疗提供了新的研究和治疗方向。
