茶多酚对奥尼罗非鱼生长、消化功能、免疫性能和抗病力的影响
2018-08-15梁高杨李小勤POOLSAWATLumpan高擘为冷向军
梁高杨 李小勤 杨 航 POOLSAWAT Lumpan 高擘为 冷向军*
(1. 上海海洋大学水产科学国家级教学示范中心,上海 201306;2.上海海洋大学农业部鱼类营养与环境生态研究中心,上海 201306;3.水产动物遗传育种中心上海市协同创新中心,上海 201306)

抗生素的长期使用带来的病原菌抗药性和药物残留问题严重危害了水产养殖的发展[10],寻找安全有效的抗生素替代产品一直是水产研究的热点。茶多酚具有广泛的抗菌谱,能够抑制多种病原菌的生长[11-12],并且茶多酚能够提高鱼类的免疫性能[13-14],是一种潜在的抗生素替代物。本试验以奥尼罗非鱼(Oreochromisniloticus×O.aureus)为研究对象,在饲料中添加不同水平的茶多酚,考察其对奥尼罗非鱼生长、消化功能、免疫性能和抗嗜水气单胞菌感染能力的影响,为茶多酚在水产养殖中的应用提供理论依据。
1 材料与方法
1.1 试验饲料
以鱼粉、豆粕、菜籽粕、棉籽粕为主要蛋白质源,豆油为主要脂肪源,配制基础饲料(粗蛋白质含量32.06%,粗脂肪含量5.62%)。在基础饲料中分别添加0(对照组)、100、200、400、600、800 mg/kg的茶多酚[14],配制6种试验饲料,另在饲料中加入0.05%氧化钇(Y2O3),以测定营养物质表观消化率。主要饲料原料粉碎后过40目筛,逐级混合,用单螺杆挤压机(SLP-45,中国水产科学研究院渔业机械研究所)制成直径2 mm的硬颗粒沉性饲料,制粒温度为(85±5) ℃,55 ℃烘干后4 ℃冰箱保存。基础饲料组成及营养水平见表1。茶多酚由山东丰泰生物科技有限公司提供,纯度为98%。
1.2 试验用鱼及饲养管理
养殖试验在上海海洋大学滨海特种水产养殖场进行,养殖时间为9周。试验用奥尼罗非鱼购于上海新场罗非鱼良种养殖场,于试验开始前用对照组饲料驯养1周。选取450尾平均体重为(6.09±0.07) g的奥尼罗非鱼,随机分为6组,每组3个重复,每个重复25尾鱼,以重复为单位随机分配到18口网箱(1.5 m×1.0 m×1.2 m)中,每6口网箱置于一口室内水泥池(5.0 m×3.0 m×1.2 m)内,共3口水泥池,位于同一室内车间内,水源均为过滤后的池塘水。试验鱼表观饱食投喂,日投喂3次(08:00、12:00、17:00)。试验期间,每周换水2次,每次换水1/3,水温(28±2)℃,pH 7.5±0.5,溶氧浓度>6.0 mg/L,氨氮浓度<0.2 mg/L。

表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1)饲料原料购自上海农好饲料有限公司,其中鱼粉(秘鲁)、豆粕、菜籽粕、棉籽粕的粗蛋白质含量分别为65.18%、44.65%、36.64%、44.77%。The feed ingredients were purchased from theShanghaiNonghaoFeed Co., Ltd., and the crude protein content of fish meal (Peru), soybean meal, rapeseed meal and cottonseed meal was 65.18%, 44.65%, 36.64% and 44.77%, respectively.
2)维生素预混料为每千克饲料提供The vitamin premix provided the following per kg of the diet:VA 6 000 IU,VD31 000 IU,VE 60 IU,VK 5 mg,VB115 mg,VB215 mg,VB330 mg,VB535 mg,VB620 mg,生物素 biotin 2 mg,叶酸 folic acid 3 mg,VB120.03 mg。
3)矿物质预混料为每千克饲料提供The mineral premix provided the following per kg of the diet:Ca(IO3)20.04 g,CoCl2·6H2O 0.01 g,FeSO4·H2O 0.446 g,ZnSO4·H2O 0.232 g,MnSO4·H2O 0.063 g,NaSeO3·5H2O 0.01 g,MgSO4·7H2O 0.645 g。
1.3 样品采样和指标测定
1.3.1 生长指标
养殖试验结束后,禁食24 h,记录试验鱼尾数并称重,用于计算生长指标;每口网箱随机取3尾鱼,测量体长,解剖取内脏和肝脏,称重用于计算形体指标。相关计算公式如下:
增重率(weight gain rate,WGR,%)=100×(终末均重-初始均重)/初始均重;饲料系数(feed conversion ratio,FCR)=总摄食量/(终末均重-初始均重);存活率(survival rate,SR,%)=100×终末鱼尾数/初始鱼尾数;采食量(feed intake,FI,g)=总摄食量/鱼尾数;肝体指数(hepatosomatic index,HSI,%)=100×肝脏重/体重;脏体指数(viscerosomatic index,VSI,%)=100×内脏重/体重;肥满度(condition factor,CF,g/cm3)=100×体重/体长3。
1.3.2 饲料和全鱼常规成分分析
在鱼体称重之后,每口网箱随机取3尾鱼,用于全鱼常规成分分析。饲料和全鱼中水分含量的测定采用105 ℃烘干法,粗蛋白质含量的测定采用凯氏定氮法(全自动凯氏定氮仪,Kjeltec-2300,福斯有限公司,瑞典),粗脂肪含量的测定采用索氏抽提法(脂肪测定仪,SOX-416,格哈特有限公司,德国),粗灰分含量的测定采用550 ℃马弗炉灼烧法(程控箱式电炉,SXL-1008,上海精宏实验仪器有限公司)。
1.3.3 血清免疫指标的测定
每口网箱另随机取3尾鱼,尾静脉取血,4 ℃离心(3 000 r/min,10 min),取血清分装后-80 ℃冰箱保存。血清超氧化物歧化酶(superoxide dismutase,SOD)、碱性磷酸酶(alkline phosphatase,AKP)、溶菌酶(lysozyme,LZM)活性和丙二醛(malondialdehyde,MDA)含量使用南京建成生物工程研究所生产的生化试剂盒测定,按照试剂盒说明书进行操作。SOD和AKP活性使用酶标仪(Synergy 2,伯腾仪器有限公司,美国)测定;MDA含量和LZM活性使用分光光度计(722型,上海精密科学仪器有限公司)测定。
1.3.4 肠道消化酶活性的测定
将每口网箱抽血后的3尾鱼在冰上解剖后取前肠(胃到肠道第1个弯曲点),生理盐水冲去食糜,-80 ℃冰箱保存。测定前,将前肠于4 ℃解冻,加9倍体积生理盐水,冰水浴匀浆,4 ℃离心(3 000 r/min,10 min),取上清用于消化酶活性的测定。
淀粉酶活性采用南京建成生物工程研究所生产的生化试剂盒测定,组织中每毫克蛋白质在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活性单位。蛋白酶活性采用福林酚法测定,以2%酪蛋白溶液为底物,每微克组织蛋白质在pH 7.2、37 ℃条件下每分钟分解酪蛋白生成1 μg酪氨酸的酶量为1个蛋白酶活性单位。肠道蛋白质含量的测定采用考马斯亮蓝法。
1.3.5 营养物质表观消化率测定
养殖试验开始30 d后,在正常投喂的同时,连续10 d采集粪便,用于测定营养物质表观消化率。每次于投喂2 h后,虹吸法收集粪便,取包膜完整、连续的粪便于60 ℃烘干,-20 ℃保存待测。饲料和粪便中Y2O3含量测定采用电感耦合等离子体发射光谱法(等离子体发射光谱仪,Optima 8000DV,帕金埃尔默股份有限公司,美国),粪便中粗蛋白质含量测定同1.3.2中方法。
干物质表观消化率(%)=100×(1-b/B);粗蛋白质表观消化率(%)=100×[1-(A/a)×(b/B)]。
式中:a、A分别表示饲料和粪便中粗蛋白质含量;b、B分别表示饲料和粪便中Y2O3含量。
1.3.6 嗜水气单胞菌攻毒试验
养殖试验结束后,每个网箱取12尾鱼,进行嗜水气单胞菌攻毒试验。攻毒所用嗜水气单胞菌来自上海海洋大学国家水生动物病原库(吕利群实验室)。将菌种接种于营养琼脂平板,置于28 ℃恒温培养箱(DHP-9082,上海善志仪器设备有限公司),纯化培养24 h,挑取单克隆菌株于无菌营养肉汤液体培养基,28 ℃培养30 h,3 500 r/min离心5 min,去除上清,无菌生理盐水稀释至浓度为1.1×108CFU/mL。每尾试验鱼腹腔注射浓度为1.1×108CFU/mL的嗜水气单胞菌菌液0.2 mL(浓度和剂量根据预试验确定)。记录攻毒后1、24、48、96 h死亡个数,计算累积死亡率。
累积死亡率(cumulative mortality,CM,%)=100×累积死亡尾数/初始鱼总尾数。
1.4 统计分析
试验数据(存活率除外)用平均值±标准差(mean±SD)表示,采用SPSS 22.0软件对试验数据进行单因素方差分析(one-way ANOVA),差异显著时,用Duncan氏法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 茶多酚对奥尼罗非鱼生长和形体指标的影响
茶多酚对奥尼罗非鱼生长和形体指标的影响见表2。经过9周的养殖试验,各组奥尼罗非鱼的存活率均为100%,且在采食量上无显著差异(P>0.05)。与对照组相比,各茶多酚添加组的增重率和饲料系数均无显著变化(P>0.05),但100和200 mg/kg茶多酚组增重率有提高的趋势,而400、600和800 mg/kg茶多酚组增重率有降低的趋势,且800 mg/kg茶多酚组的增重率较200 mg/kg茶多酚组显著降低(P<0.05)。以增重率为评价指标,得出奥尼罗非鱼增重率(y)与茶多酚添加量(x)之间的一元二次回归方程为y=-0.000 3x2+0.122 4x+1 500(R2=0.508 4),由回归方程得出,当茶多酚添加量为204 mg/kg时,奥尼罗非鱼具有最高的增重率。在形体指标方面,600和800 mg/kg茶多酚组奥尼罗非鱼的肝体指数显著低于对照组(P<0.05);肥满度和脏体指数各组之间无显著差异(P>0.05)。

表2 茶多酚对奥尼罗非鱼生长和形体指标的影响Table 2 Effects of TP on growth and physical indexes of hybrid tilapia
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
2.2 茶多酚对奥尼罗非鱼体成分的影响
茶多酚对奥尼罗非鱼体成分的影响见表3。与对照组相比,饲料中添加600、800 mg/kg茶多酚显著降低了全鱼粗脂肪含量(P<0.05)。全鱼水分、粗蛋白质和粗灰分含量各组之间无显著差异(P>0.05)。
2.3 茶多酚对奥尼罗非鱼营养物质表观消化率和肠道消化酶活性的影响
茶多酚对奥尼罗非鱼营养物质表观消化率和肠道消化酶活性的影响见表4。随着饲料中茶多酚添加量的增加,干物质表观消化率呈现先增加后降低的规律,在200 mg/kg茶多酚组显著高于其他组(P<0.05);粗蛋白质表观消化率不受茶多酚添加量的显著影响(P>0.05)。与对照组相比,高添加量(600、800 mg/kg)的茶多酚显著降低了肠道蛋白酶和淀粉酶活性(P<0.05)。
2.4 茶多酚对奥尼罗非鱼血清免疫指标的影响
茶多酚对奥尼罗非鱼血清免疫指标的影响见表5。与对照组相比,饲料中添加200、400、600和800 mg/kg茶多酚均显著增加了血清SOD和LZM活性(P<0.05)。二次曲线回归分析表明,茶多酚添加量为438.89、412.35 mg/kg时,血清SOD和LZM活性分别最高(图1)。血清MDA含量随茶多酚添加量的增加表现出先降低后升高的规律,其中在200 mg/kg茶多酚组具有最小值。血清AKP活性各组之间无显著差异(P>0.05)。
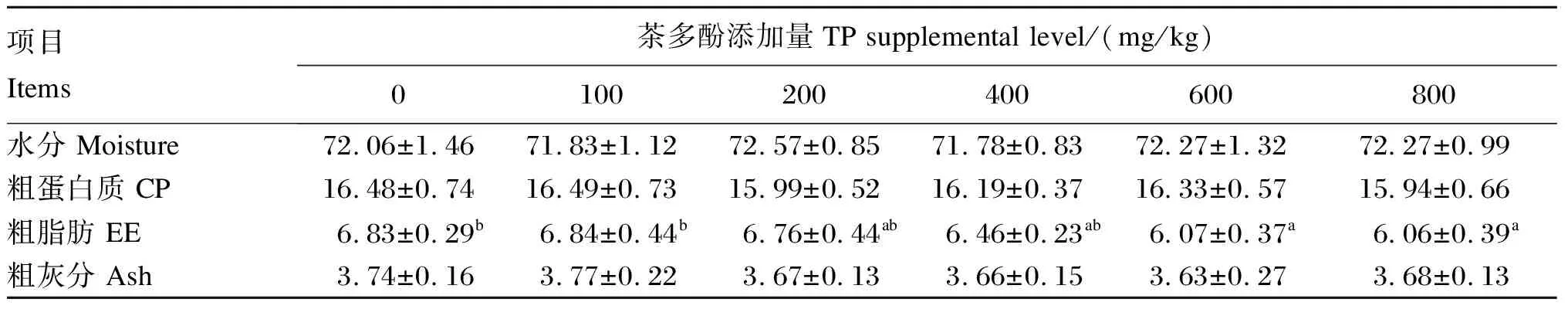
表3 茶多酚对奥尼罗非鱼体成分的影响(湿重基础)Table 3 Effects of TP on body composition of hybrid tilapia (wet weight basis) %

表4 茶多酚对奥尼罗非鱼营养物质表观消化率和肠道消化酶活性的影响Table 4 Effects of TP on nutrient apparent digestibility and intestinal digestive enzyme activities of hybrid tilapia
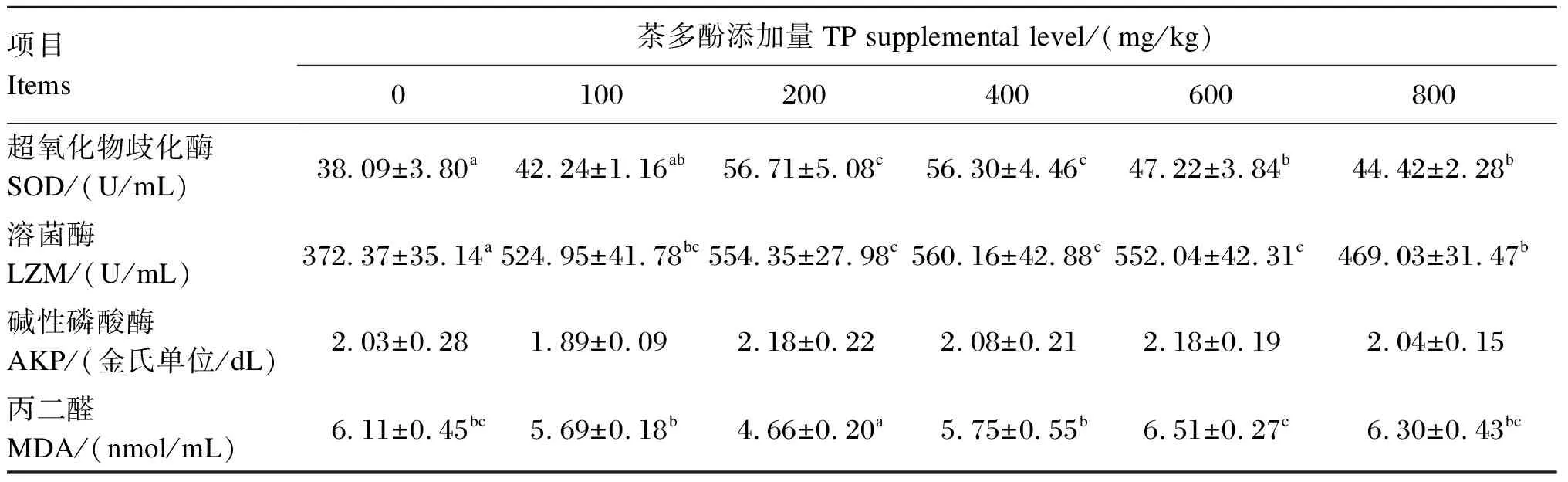
表5 茶多酚对奥尼罗非鱼血清免疫指标的影响Table 5 Effects of TP on serum immunological indexes of hybrid tilapia
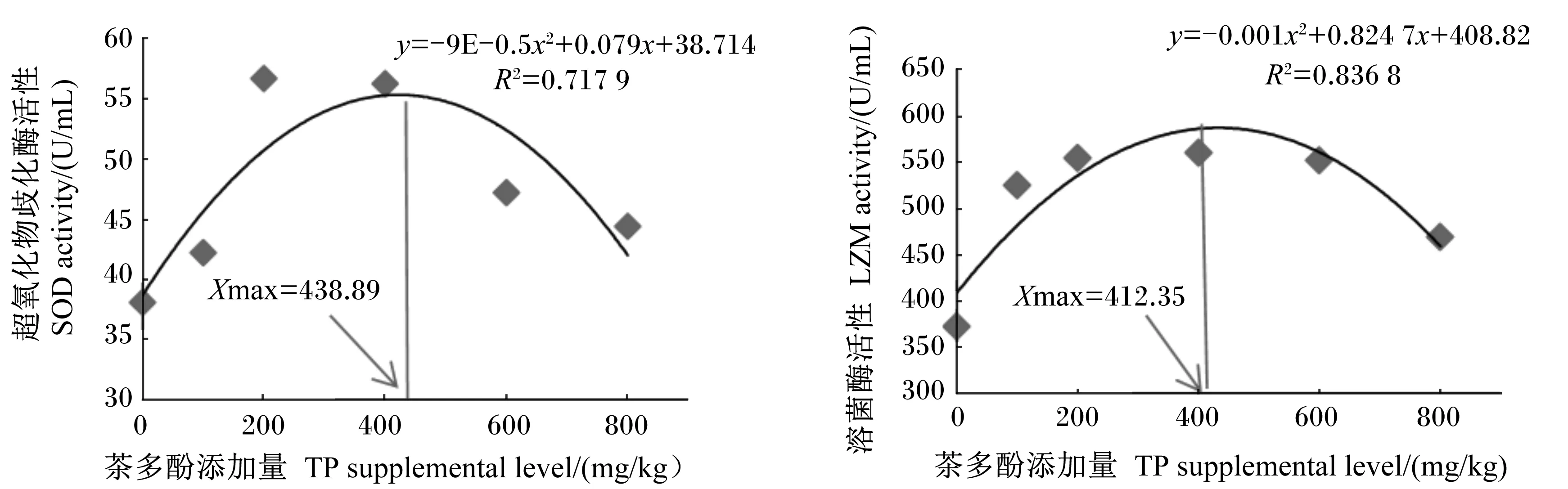
图1 血清SOD或LZM活性与茶多酚添加量的关系Fig.1 Relationships between TP supplemental level and serum SOD or LZM activities
2.5 茶多酚对嗜水气单胞菌攻毒后奥尼罗非鱼累积死亡率的影响
由图2可见,攻毒后1 h,各组试验鱼均无死亡(存活率为100%);攻毒后24 h,100、200、400和600 mg/kg茶多酚组的累积死亡率显著低于对照组(P<0.05);攻毒后48和96 h,200、400、600和800 mg/kg茶多酚组的累积死亡率均显著低于对照组(P<0.05),其中400 mg/kg茶多酚组累积死亡率最低。
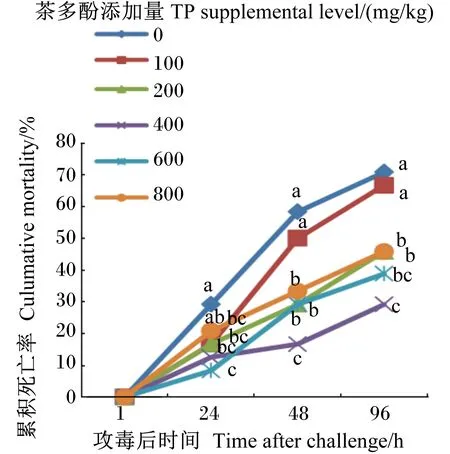
相同时间点数据点标注不同字母表示差异显著(P<0.05)。
Data points at the same time point with different small letters mean significant difference (P<0.05).
图2茶多酚对嗜水气单胞菌攻毒后奥尼罗非鱼累积死亡率的影响
Fig.2 Effects of TP on cumulative mortality of hybrid tilapia challenged withAeromonashydrophila
3 讨 论
3.1 茶多酚对奥尼罗非鱼生长和消化功能的影响
茶多酚在水产动物上的研究相对较少。研究发现,饲料中添加50~100 mg/kg茶多酚,显著提高了团头鲂的增重率和特定生长率,上调了生长相关基因MaGHR2的表达[8];饲料中添加50~100 mg/kg茶多酚后,在数值上提高了虹鳟的增重率,但差异未达显著水平[6]。在罗非鱼(Oreochromisniloticus)的试验中,饲料中添加166 mg/kg茶多酚显著提高了鱼体的增重率,但添加333 mg/kg茶多酚未对生长性能产生有益影响[14]。同样地,饲料中添加50 mg/kg茶多酚显著提高了青鱼(Mylopharyngodonpiceus)的特定生长率,而添加500 mg/kg茶多酚显著降低了青鱼的特定生长率[15]。本试验在饲料中添加100~800 mg/kg茶多酚,结果发现对罗非鱼生长性能无显著影响,但100、200 mg/kg茶多酚有提高增重率的趋势,而400、600和800 mg/kg茶多酚有降低增重率的趋势,且800 mg/kg茶多酚组的增重率较200 mg/kg茶多酚组显著降低。这表明,高添加量的茶多酚对鱼类生长可能具有抑制作用。Zheng等[16]发现,当饲料中绿茶渣添加量超过3.6%时,罗非鱼的增重率降低,饲料系数增加。Welker等[17]也发现,虹鳟摄食含4%绿茶的饲料后,增重率显著降低,饲料系数显著升高,这可能也是高添加量的茶多酚所致。茶多酚是从茶叶中提取的酚类化合物,而酚类化合物通常被认为是饲料中的抗营养因子,能够降低营养物质利用率和动物生长性能[18-19]。
本试验中,添加100~400 mg/kg茶多酚显著增加了奥尼罗非鱼的干物质表观消化率,但高添加量(600、800 mg/kg)的茶多酚则显著降低了干物质表观消化率,肠道淀粉酶和蛋白酶活性。在青鱼饲料中添加50 mg/kg茶多酚,肠道蛋白酶和脂肪酶活性显著增加,而添加500 mg/kg茶多酚后,肠道蛋白酶和脂肪酶活性显著降低[15]。在小鼠饲粮中添加0.4%茶多酚后发现显著降低了粗蛋白质表观消化率[20],用0.4%茶多酚灌喂小鼠后,肠道对水分、葡萄糖、胆固醇、氨基酸和矿物质的消化率显著降低[21]。茶多酚能够缓解肠道氧化应激,促进肠道有益菌的生长[22],这有利于提高动物的消化吸收功能;但过量的茶多酚可能像其他多酚类物质一样,能够与蛋白质、糖类物质和矿物质结合,进而降低其消化率[23-25]。关于茶多酚影响鱼类消化吸收功能的作用机制需要进一步的研究。
3.2 茶多酚对奥尼罗非鱼体成分的影响
茶多酚可通过调节脂肪代谢相关激素如胰岛素样生长因子Ⅰ、瘦素和脂联素等的含量和脂肪代谢相关信号通路基因的表达,降低摄食高脂饲粮小鼠的体脂肪含量[26-28]。分别灌喂80、160 mg/kg茶多酚后,肉鸡皮下脂肪厚度、肌间脂肪宽度和腹脂率均显著降低[29]。饲料中添加6.4%的绿茶渣显著降低了罗非鱼全鱼粗脂肪含量,而全鱼水分、粗蛋白质含量无显著差异[16]。本试验结果与之类似,饲料中添加茶多酚对奥尼罗非鱼全鱼水分和粗蛋白质含量无显著影响,但是高添加量(600、800 mg/kg)的茶多酚显著降低了全鱼粗脂肪含量。这在虹鳟上也有类似报道,即低添加量(25~500 mg/kg)的茶多酚对全鱼粗脂肪含量无显著影响,但高添加量(1 000 mg/kg)的茶多酚显著降低了全鱼粗脂肪含量[6]。在低添加量(25、50 mg/kg)条件下,茶多酚提高了团头鲂幼鱼肌肉粗蛋白质含量,但是对肌肉粗脂肪含量无显著影响[8]。可见,茶多酚对鱼类体脂沉积的影响与茶多酚的添加量有关,高添加量的茶多酚通常会抑制脂肪在鱼体的沉积。
3.3 茶多酚对奥尼罗非鱼免疫性能和抗病力的影响

4 结 论
① 饲料中添加200 mg/kg茶多酚具有促进奥尼罗非鱼生长的趋势。
② 饲料中添加400 mg/kg茶多酚可增加奥尼罗非鱼的免疫性能,降低嗜水气单胞菌攻毒后的累积死亡率。
③ 在本试验条件下,奥尼罗非鱼饲料中茶多酚的建议添加量为200~400 mg/kg。
