利用酵母双杂交技术筛选草鱼Ⅲ型呼肠孤病毒VP6和VP38相互作用蛋白的研究
2018-08-15王龙龙邱军强吕利群
王龙龙, 邱军强,2,3, 喻 飞, 王 浩,2,3, 吕利群,2,3
(1. 上海海洋大学 国家水生动物病原库, 上海 201306; 2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306; 3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306)
草鱼(Ctenopharyngonidellus)是亚洲国家广泛养殖的重要淡水经济鱼类,是我国传统的“四大家鱼”之一。但草鱼出血病的时常爆发给草鱼养殖业带来了巨大的损失[1]。我国学者在20世纪80年代确认了病毒性草鱼出血病的病原为草鱼呼肠孤病毒(GCRV,Grass carp reovirus)[2]。近年来我国各地不断分离出不同的草鱼来源呼肠孤病毒株,根据VP6的序列可分为Ⅰ型、Ⅱ型和Ⅲ型3种基因型,代表株分别为GCRV-873、GCRV-HZ08和GCRV104[3-4]。
GCRV104又称HGDRV(Hubei grass carp disease reovirus),是草鱼Ⅲ型呼肠孤病毒的唯一成员,由Fan等在2009年分离于湖北一养殖场患病草鱼[5]。GCRV104的基因组片段s8编码VP6蛋白,分析表明VP6拥有属于呼肠孤病毒σ1/σ2蛋白超家族的保守性结构域,与另外两种基因型GCRV VP6蛋白的同源性小于20%,与其他水生呼肠孤病毒的对应蛋白的同源性为20%~22%,与MRV σ2蛋白和ARV σA蛋白的同源性也仅有17%~19%,但VP6与 MRV σ2和ARV σA在二级结构上具有较高的相似性,且在C端区域的氨基酸残基均为亲水性[6]。GCRV104的基因组片段s10编码大小为 346aa的VP38蛋白,与Ⅱ型GCRVs11编码的VP35和Ⅰ型GCRVs10编码的VP7为同源蛋白,MRV、ARV和GCRV104s10编码的蛋白在N端具有相同的亲水性谱,呈疏水-亲水-疏水-亲水的顺序[4,6]。总体而言,VP38和VP6的功能仍不清楚。
酵母双杂交系统(Yeast two-hybrid system)作为一种可靠而有效的筛选蛋白与蛋白相互作用的技术平台,已经广泛应用于多个领域[7]。国内外的研究者也已利用酵母双杂交系统筛选了能够与不同分离株GCRV蛋白相互作用的宿主蛋白。目前针对GCRV的研究主要集中在Ⅰ型与Ⅱ型,关于Ⅲ型GCRV蛋白的研究也仅限于蛋白表达、疫苗制备等[8],病毒蛋白与宿主蛋白的相互作用报道则相对较少。本次研究利用酵母双杂交Gal4系统,初步筛选并鉴定了与草鱼Ⅲ型呼肠孤病毒GCRV104株VP6、VP38蛋白存在相互作用的宿主蛋白,为探索与分析VP6、VP38蛋白功能,进一步了解GCRV入侵与复制机制奠定了一定的基础。
1 材料与方法
1.1 材料与试剂
草鱼Ⅲ型呼肠孤病毒GCRV104株、草鱼肾脏细胞系CIK(Ctenopharyngonidelluskideny)和酵母菌AH109由本实验室保存;草鱼肾细胞cDNA文库由本实验室构建保存[9];M199培养基、胎牛血清购自杭州四季青生物工程材料公司;Trizol试剂购自Invitrogen公司;ExTaq酶、dNTP、DNA maker、T4连接酶、限制性内切酶购自TaKaRa公司;Wizard® SV Gel and PCR Clean-Up System试剂盒、Wizard® Plus SV Minipreps DNA Purification Systems试剂盒购自Promega公司;YPD培养基、营养缺陷型培养基、X-α-Gal、YeastmakerTMYeast Transformation System、Advantage® RT-for-PCR Kit购自Clontech公司;酵母质粒提取试剂盒购自天根科技生物公司。
1.2 目的基因的扩增
根据NCBI网站下载的GCRV104s8和s10序列和pGADT7质粒图谱,利用Primer Premier 5.0软件设计扩增引物以及pGADT7文库质粒插入片段测序引物,引物由生工生物工程(上海)股份有限公司合成。引物列表见表1。

表1 引物列表
斜体并下划线的碱基为限制性内切酶酶切位点
含有10%胎牛血清的M199培养基用于CIK细胞系的培养及传代;收集感染GCRV104 5~7 d后的细胞上清和CIK细胞,利用Trizol试剂提取总RNA;使用Advantage® RT-for-PCR Kit试剂盒对总RNA进行逆转录扩增;以逆转录扩增产物为模板,PCR扩增s8和s10片段,反应体系50 μL,退火温度56℃;PCR产物1%琼脂糖凝胶电泳。
1.3 诱饵重组质粒的构建
1%琼脂糖凝胶电泳后,利用Wizard® SV Gel and PCR Clean-Up System试剂盒回收纯化目的基因片段;限制性内切酶NdeⅠ和EcoRⅠ分别酶切s8和pGBKT7载体质粒,限制性内切酶EcoRⅠ和XhoⅠ分别酶切s10和pGBKT7载体质粒;将酶切后的s8和载体质粒、s10和载体质粒分别用T4连接酶16℃连接12 h;连接产物转化大肠杆菌DH5α感受态细胞,取10 μL连接产物加入100 μL大肠杆菌DH5α感受态细胞,冰浴30 min,42℃热激60~90 s,冰上冷却2~3 min后,加入900 μL LB液体培养基,37℃,200 r/min,培养 1 h,涂布于含有50 mg/L卡那霉素(Kanamycin)LB平板上,37℃培养过夜;筛选阳性克隆扩大培养,使用Wizard® Plus SV Minipreps DNA Purification Systems试剂盒提取诱饵重组质粒;NanoDrop2000测量浓度并送至生工测序验证。两个诱饵重组质粒分别为pGBKT7-VP6,pGBKT7-VP38。
1.4 诱饵质粒转化感受态酵母AH109
根据YeastmakerTMYeast Transformation System说明书进行感受态酵母AH109的制备以及相关转化步骤的操作。
将100 ng诱饵质粒、5 μL经95℃变性后的Carrier DNA(10 μg/μL)、50 μL感受态酵母AH109加入到预先冷却的1.5 mL离心管中,混合均匀;加入500 μL PEG/LiAc溶液混合均匀;30℃培养30 min,每隔10 min轻柔混匀1次;加入20 μL DMSO混合均匀;42℃热激15 min,每隔5 min轻柔混匀1次;1500 r/min离心15 s,弃上清,1 mL YPD Plus培养基重悬,30℃培养1 h;再次离心后弃上清,1 mL无菌水重悬,涂布于SD缺陷型固体培养基上,30℃培养。
1.5 文库质粒的转化
将15 ng文库质粒、20 μL经95℃变性后的Carrier DNA(10 μg/μL),600 μL携带有诱饵重组质粒的感受态酵母AH109加入到预先冷却的15 mL离心管中,混合均匀;加入2.5 mL PEG/LiAc溶液混合均匀;30℃培养45 min,每隔15 min轻柔混匀1次;再加入160 μL DMSO混合均匀;42℃水浴20 min,每隔5 min轻柔混匀1次;700 r/min离心5 min,弃上清,3 mL YPD Plus培养基重悬,30℃培养1.5 h;再次离心后弃上清,15 mL无菌水重悬,涂布于SD/-Trp/-Leu固体培养基上,30℃培养。
1.6 诱饵重组质粒自激活检测
实验组:将带有重组诱饵质粒pGBKT7-VP6/pGADT7和pGBKT7-VP38/pGADT7的酵母AH109分别涂布在SD/-Trp/-Leu和SD/-Trp/-Leu/-His固体培养基上,30℃条件下培养3~7 d,期间不断观察菌落生长状态。
对照组:将携带有质粒pGBKT7/pGADT7的酵母AH109分别涂布在SD/-Trp-Leu和SD/-Trp/-Leu /-His固体培养基上,30℃条件下培养3~7 d,其他条件同实验组,期间不断观察菌落生长状态。
1.7 营养缺陷型培养基筛选阳性克隆
实验组:将携带有文库质粒与诱饵重组质粒的酵母AH109接种到 SD/-Trp-Leu平板上,30℃培养 3~7 d,挑选生长良好的阳性菌落依次转接到SD/-Trp-Leu-His、SD/-Trp-Leu-His-Ade和SD/-Trp-Leu-His-Ade/X-α-Gal平板上,按照与上述相同的培养条件培养并筛选阳性菌落。
对照组:将携带有文库质粒与pGBKT7质粒的酵母AH109分别接种到与实验组相同的平板上,方法与培养条件同实验组。
挑取生长在SD/-Trp-Leu-His-Ade/X-α-Gal平板上的蓝色阳性菌落,无菌水稀释后反复冻融3次以上,并以此为模板利用pGADT7质粒插入片段引物进行PCR,另使用酵母质粒小提试剂盒对阳性菌落进行质粒提取,PCR产物以及质粒送生工生物(上海)股份有限公司进行测序。
2 结果
2.1 重组诱饵质粒的构建
VP6蛋白基因s8和VP38蛋白基因s10由RT-PCR成功扩增,1%琼脂糖凝胶电泳结果显示(图1)s8和s10片段大小均与预期相符;割胶回收后,经双酶切,T4连接酶连接过夜,转化DH5α后提质粒,送生物公司测序,测序结果表明诱饵重组质粒pGBKT7-VP6与pGBKT7-VP38构建成功,可用于后续实验。

图1 s8和s10 RT-PCR扩增结果
M:DL2000 marker;NC:阴性对照
2.2 重组诱饵质粒的自激活检测
转化pGBKT7/pGADT7质粒的酵母AH109在SD/-Trp平板上生长良好,分别带有诱饵重组质粒pGBKT7-VP6/pGADT7与pGBKT7-VP38/pGADT7的酵母AH109在SD/-Trp-Leu平板上均生长良好(图2);分别带有诱饵重组质粒pGBKT7-VP6/pGADT7与pGBKT7-VP38/pGADT7的酵母AH109在SD/-Trp/-Leu/-His平板上均不能生长,转化pGBKT7/pGADT7质粒的酵母AH109在SD/-Trp/-Leu/-His平板上不能生长。该结果表明:VP6蛋白和VP38蛋白对酵母的生长无毒性,诱饵重组质粒pGBKT7-VP6与pGBKT7-VP38在酵母双杂系统中均无自激活作用。
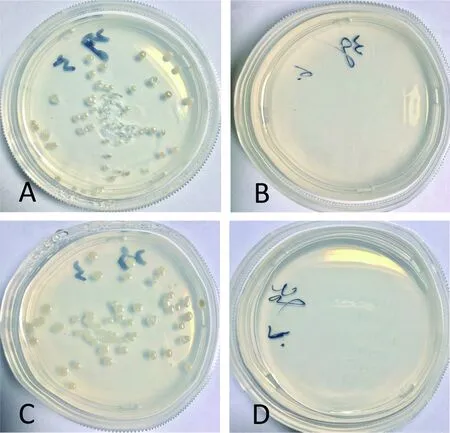
图2 pGBKT7-VP6与pGBKT7-VP38的自激活检测
A:转化质粒pGBKT7-VP6/pGADT7的酵母AH109在SD/-Trp-Leu平板的生长;B: 转化质粒pGBKT7-VP6/pGADT7的酵母AH109在SD/-Trp-Leu-His平板上不生长;C: 转化质粒pGBKT7-VP38/pGADT7的酵母AH109在SD/-Trp-Leu平板的生长;D: 转化质粒pGBKT7-VP38/pGADT7的酵母AH109在SD/-Trp-Leu-His平板上不生长
2.3 营养缺陷型培养基筛选阳性克隆
携带有文库质粒与诱饵重组质粒的酵母AH109依次在SD/-Trp-Leu(图3)、SD/-Trp-Leu-His、SD/-Trp-Leu-His-Ade和SD/-Trp-Leu-His-Ade/3-AT/X-α-Gal平板上筛选,与VP6蛋白存在潜在相互作用的文库质粒筛选得到7个阳性菌落,与VP38存在潜在相互作用的文库质粒筛选得到4个阳性菌落,且该11个阳性菌落在SD/-Trp-Leu-His-Ade/3-AT/X-α-Gal平板上颜色变为蓝色(图4),说明这些阳性菌落中的2个蛋白之间存在相互作用,激活了下游报道基因。

图3 SD/-Trp-Leu平板筛选的阳性菌落
A:携带有文库质粒与pGBKT7-VP6的酵母AH109在SD/-Trp-Leu平板上生长(代表平板);B:携带有文库质粒与pGBKT7-VP38的酵母AH109在SD/-Trp-Leu平板上生长(代表平板)
2.4 阳性菌落文库质粒插入片段序列分析
利用根据pGADT7质粒序列设计的引物(表1),PCR扩增阳性菌落中的插入片段;同时使用酵母质粒小提试剂盒提取阳性菌落质粒,将PCR产物与酵母质粒送生工生物工程(上海)股份有限公司测序。将测序结果通过NCBI网站进行BLAST分析,与VP6相互作用的7个蛋白中,1个鲤鱼同源(Cyprinuscarpio)基因组scaffold序列为未确定蛋白,1个青鱼同源(Mylopharyngodonpiceus)肌动蛋白,其余5个均为斑马鱼同源蛋白(表2);与VP38相互作用的4个蛋白,除一个草鱼葡萄糖转运蛋白外,其余3个均为斑马鱼同源蛋白(表3)。

图4 SD/-Trp-Leu-His-Ade/3-AT/X-α-Gal平板筛选的阳性菌落
A:与pGBKT7-VP6相互作用蛋白的阳性菌落在SD/-Trp-Leu-His-Ade/3-AT/X-α-Gal平板上的生长情况,1-7为7个阳性菌落;b:与pGBKT7-VP38相互作用蛋白的阳性菌落在SD/-Trp-Leu-His-Ade/3-AT/X-α-Gal平板上的生长情况,I-IV为4个阳性菌落
3 讨论
病毒感染宿主的过程是一个病毒与宿主不断频繁交互的过程,蛋白间的相互作用在此过程中扮演着主要的角色。探究病毒蛋白与宿主蛋白之间的相互作用,对于揭示病毒感染与复制机制、启示防治药物开发等具有深远意义。
对于草鱼呼肠孤病毒的3种基因型,最早分离的Ⅰ型代表株GCRV-873已有相对深入的研究,近几年国内分离出多株Ⅱ型GCRV[4-6,10],研究热点也主要集中在Ⅱ型,目前完成全基因测序的Ⅱ型GCRV有HZ08、GD108和109,GCRV104作为Ⅲ型唯一的成员,目前对于其蛋白功能等了解较少。有学者根据序列分析推测GCRV104 VP38与Ⅱ型GCRV VP35、Ⅰ型GCRV VP7同源[3-4],VP7为病毒颗粒的外衣壳蛋白(Outer clamp),处于GCRV的外层蛋白衣壳的最外层,与VP5形成VP7-VP5三聚体复合物[11],VP7蛋白起到了保护穿透蛋白VP5的作用;方琴等利用酶解法消化掉外衣壳蛋白VP7能够显著性的增强GCRV的感染效力,缺失VP7蛋白的病毒株能够更迅速地吸附宿主,进入细胞进行复制,这表明GCRV VP7蛋白具有一定的保护病毒粒子的作用[12];GCRV104 VP6蛋白与其他两种基因型GCRV的VP6蛋白同源,但Ⅱ型GCRV VP6蛋白由s9片段编码,Ⅰ型与Ⅲ型由s8片段编码,为病毒粒子的核衣壳蛋白(Core clamp),VP6蛋白与核衣壳蛋白VP3嵌合,与外衣壳蛋白VP5相连,能够加固核衣壳及连接外衣壳[3,11-12]。

表2 与VP6蛋白有潜在相互作用蛋白的基因列表

表3 与VP38蛋白有潜在相互作用蛋白的基因列表
酵母双杂交技术是一种筛选相互作用蛋白的有效技术手段,前期的研究中,我们利用酵母双杂交技术筛选到了能够与GCRV-JX01外衣壳蛋白VP5相互作用的潜在受体蛋白Lamini receptor和其他一些免疫相关蛋白[9];能够与GCRV-104 VP55 蛋白相互作用的类泛素化相关蛋白Ubc9和细胞外基质蛋白Fibulin4[13-14]。丁燏等利用酵母双杂交技术筛选到宿主蛋白3-磷酸甘油醛脱氢酶能够与GCRV096 VP6蛋白相互作用,并根据3-磷酸甘油醛脱氢酶的功能推测GCRV096 VP6蛋白在病毒侵染过程中可能参与了代谢转录调控、细胞凋亡的启动调节等[15]。
本研究运用酵母双杂交技术初步筛选了与GCRV-104 VP6 和VP38蛋白存在潜在相互作用的宿主蛋白,为探索与分析VP6、VP38蛋白功能,进一步了解GCRV感染机制奠定了一定的基础。β肌动蛋白(β-actin) 在细胞浆内分布广泛且丰富,是细胞骨架的主要成分,一些病毒可利用肌动蛋白等细胞骨架成分完成胞内运输[16]。HAUS复合体是一种重要的、在进化上保守的多亚基蛋白,能够在细胞的有丝分裂过程中调节中心体和纺锤体的完整性[17-18]。FYVE锌指是一种半胱氨酸富集的锌指样基序,能与两个锌原子结合,FYVE结构域可以通过与膜脂质磷酸酰肌醇-3-磷酸的高特异性结合,将信号传导蛋白靶向到细胞膜上[19]。α-甘露糖苷酶参与了细胞内糖蛋白的代谢和分解,在保持细胞内稳态中至关重要[20]。程序性细胞死亡蛋白6(PDCD6)是一种公认的凋亡调节因子,PDCD6的表达是大量死亡刺激后细胞凋亡的必要条件[21-22]。真核翻译延长因子1γ(eEF1γ)与eEF1α、eEF1β和eEF1δ亚基共同构成大分子复合体,在蛋白质生物合成的过程中催化肽链的延伸[23]。剪切与多聚腺苷酸化特异性因子(CPSF)是真核生物中一种重要的多亚基复合体,是mRNA 3′末端形成的反式作用因子之一,CPSF5可以与RNA结合,与Poly(A)聚合酶相互作用,参与RNA前体的剪切与加工[24-25]。高迁移率组蛋白核小体结合结构域2(HMGN2)是由上皮细胞产生的抗菌多肽,在先天免疫和获得性免疫中都行使重要功能[26],有报道称HMGN2在体外可以显著的抑制乙肝病毒蛋白的表达以及病毒的复制,可以抑制乙肝病毒3.5 kb 和 2.4/2.1 kb mRNA的表达[27]。草鱼葡萄糖转运体(gcGLUT)与哺乳动物GLUT3在进化上亲缘关系最近,gcGLUT在缺氧组织中可加强葡萄糖的利用,促进代谢能量的供应[28];蛋白酶体亚基β7(PSMB7)是蛋白酶体的组成成分之一,在调节细胞内特定蛋白含量、降解损伤或错误折叠蛋白过程中十分重要[29-30]。在之后的工作中,我们将利用其他方法验证VP6和VP38与以上蛋白的相互作用,进一步探究这两种蛋白在细胞凋亡、细胞分裂、蛋白代谢、能量供应及转录翻译等过程中的功能。
