桑葚中烯酰吗啉残留量测定
2018-08-13李国烈
李国烈
(南充农产品质量监测检验中心,四川南充 637000)
烯酰吗啉(dimethomorph),化学名称为4-[3-(4-氯苯基)-3-(3,4-二甲氧基苯基)丙烯酰]吗啉,存在2种异构体(Z、E型)。其为高效卵菌纲真菌杀菌剂,具有内吸、治疗和抗孢子形成等特性,对卵菌生命周期的各个阶段都有效[1]。烯酰吗啉影响病原菌细胞壁分子结构的重排,干扰细胞壁聚合体的组装,进而干扰细胞壁的形成。其可用于防治多种作物上由霜霉属和疫霉属病菌引发的病害,且与甲霜灵、苯霜灵等苯基酰胺类杀菌剂无交互抗性[2-3]。烯酰吗啉广泛用于蔬菜和水果,因此,其残留具有较高的检出率[4]。报道的烯酰吗啉残留检测分析方法主要有气相色谱法[5-6]、气相色谱-质谱联用法[7-8]、液相色谱法[9]和高效液相色谱-串联质谱法[10-11],检测基质包括葡萄[7-8]、草莓[6]、龙眼[12]、柑橘[13]、柠檬[7]、黄瓜[9,14-15]、大蒜[16]、辣椒[13]、烟草[11]、大豆[17]、番茄[18]、甘蓝[3]、白菜[19-20]、莴笋[21]、油麦菜[21]、胡椒[5]、大葱[22]、生姜[18]、胡萝卜[18]、菠菜[18]、白木耳[18]、洋葱[7]、三七[23]和人参[24]等。
桑葚(mulberry)含有丰富的糖分、氨基酸、维生素、矿物质等营养物质以及桑色素、桑素、黄酮类化合物等活性物质,具有丰富的营养价值和药用价值[25]。我国将其列为“既是食品又是药品”的农产品[26]。桑葚病虫害的防治通常以化学防治为主[27]。在实际生产中,由于用药不当易造成桑葚中化学农药残留污染,危害人类健康和产业发展。李国烈等[28-30]报道了桑葚中醚菌酯、噻虫嗪、吡虫啉和啶虫脒的残留检测。覃明丽等[31]和赵鑫等[32]报道了桑葚中乐果、甲基硫菌灵和腐霉利的残留分析方法,但尚未见关于烯酰吗啉在桑葚中的残留分析报道。本试验建立了桑葚中烯酰吗啉残留检测的超高效液相色谱-串联质谱方法(UPLC-MS/MS),并研究了在该试验条件下烯酰吗啉在桑葚中的基质效应,以期为桑葚中烯酰吗啉的残留分析检测提供参考。
1 材料与方法
1.1 标准品和试剂
烯酰吗啉标准品购于农业农村部环境保护科研监测所(标准品编号为SB05-140-2008);甲醇、乙腈、甲苯、甲酸等试剂均为质谱级,购于Fisher公司。
1.2 仪器和设备
Acquity UPLC/Xevo TQ-S超高效液相色谱-质谱仪、Xbridge C18色谱柱(50 mm×3.0 mm,3.5 μm),Waters公司;FP3010匀浆机,德国Braun公司;ML802分析天平,梅特勒-托利多公司;固相萃取装置、Mega BE Carbon/NH2固相萃取小柱 (500 mg,6 mL),Agilent公司;50 mL离心管,Eppendorf中国有限公司;HS501摇床、Vortex Genius 3旋涡混合器,IKA集团;N-EVAP112氮吹仪,美国Organomation公司;3-18KS离心机,Sigma公司;Milli-Q超纯水仪,美国Millipore公司;微孔滤膜(PTFE 0.22 μm),天津津腾实验设备有限公司。
1.3 样品处理
1.3.1 提取
准确称取匀浆后的桑葚样品10.00 g(精确至0.01 g)于50 mL离心管中,加入20 mL乙腈提取,置于摇床以300 r/min速率振摇30 min,再加入5 g氯化钠,盖上塞子,剧烈振荡1 min,然后置于离心机中以10 000 r/min速率离心10 min,移取上清液于50mL离心管中,待净化。
1.3.2 净化
Mega BE Carbon/NH2固相萃取小柱先用5 mL乙腈+甲苯(体积比为3∶1)活化。移取10 mL上述待净化液过柱,收集滤液,再用25 mL乙腈+甲苯(体积比为3∶1)分5次洗脱,合并洗脱液,于40℃氮吹至近干。用5.00 mL 50%甲醇水溶液定容,旋涡混合器混匀后过0.22 μm滤膜,待检测。
1.4 仪器条件
流动相采用0.1%甲酸甲醇溶液+0.1%甲酸水溶液+0.1%甲酸乙腈溶液进行梯度洗脱,洗脱程序见表1。流动相使用前用超声波脱气。柱温35℃,样品室温度16℃,进样体积1 μL。质谱采用电喷雾离子源正离子模式,多反应监测方式进行采集。脱溶剂气和锥孔气均为高纯氮气,流量分别为1 000 L/h和150 L/h,碰撞气为高纯氩气,流量为0.10 mL/min,脱溶剂温度为500℃。定量离子对、定性离子对、毛细管电压、锥孔电压和碰撞电压等相关参数见表2。

表1 测定桑葚中烯酰吗啉残留量的液相色谱条件

表2 质谱参数
1.5 方法标准曲线和检测限
用空白基质溶液配制质量浓度为1.00、2.00、5.00、10.00、20.00、50.00 μg/L的烯酰吗啉基质标样溶液,采用1.4仪器条件进行分析。以烯酰吗啉定量离子的峰面积(Z、E型峰面积之和)为纵坐标,基质标样溶液质量浓度为横坐标作标准曲线,用Masslynx V4.1软件进行线性回归分析,并求出回归方程和相关系数。检测限采用在最低浓度附近添加一系列已知浓度的双平行样品进行测定,采用Masslynx V4.1软件计算烯酰吗啉的信噪比(S/N),以S/N≥3时的样品添加浓度为方法检测限[33]。
1.6 方法回收率和精密度
回收率试验采用加标回收试验法。取桑葚空白样品,按照添加质量分数为1.00、10.00、50.00 μg/kg加入相应的烯酰吗啉标准品,每个浓度水平设6个平行样品。所有样品按1.3中方法进行样品前处理,采用1.4仪器条件测定质量浓度,根据随行测定的基质标准曲线计算样品的实测浓度。回收率/%=样品实测浓度/样品理论浓度×100。精密度试验采用加入法,参照回收率试验方法,所有样品连续测定3 d,根据随行测定的基质标准曲线计算样品的实测浓度,采用Microsoft Excel 2010软件计算该方法的日内和日间精密度。
1.7 方法基质效应
参照Matuszewski等[34]提出的方法,基质效应采用比较不同条件下峰面积平均值的方法来评价。在纯试剂标样溶液(A)、桑葚空白基质标样溶液(B)2个条件下,分别采用3个质量浓度(基质浓度)1.00、10.00和50.00 μg/L来评价该方法条件下烯酰吗啉在桑葚样品中的基质效应,每个条件下重复测定5个样品,基质效应为B信号峰面积/A信号峰面积。
2 结果与讨论
2.1 方法选择性
该试验条件下,烯酰吗啉采用反相液相色谱分离,流动相中加入体积分数为0.10%甲酸来提高离子化效率。结果表明,桑葚基质对桑葚样品中烯酰吗啉的测定干扰小,且可获得较强的分子离子峰,Z、E型保留时间分别为5.08 min和5.18 min。桑葚空白样品图谱、烯酰吗啉试剂标样溶液图谱、烯酰吗啉桑葚基质标样溶液图谱以及烯酰吗啉加标样品图谱分别见图1~图4。各图中上图为定量离子色谱图,下图为定性离子色谱图。

图1 桑葚空白样品图谱

图2 烯酰吗啉试剂标样溶液图谱(1.00 μg/L)

图3 烯酰吗啉桑葚基质标样溶液图谱(1.00 μg/L)
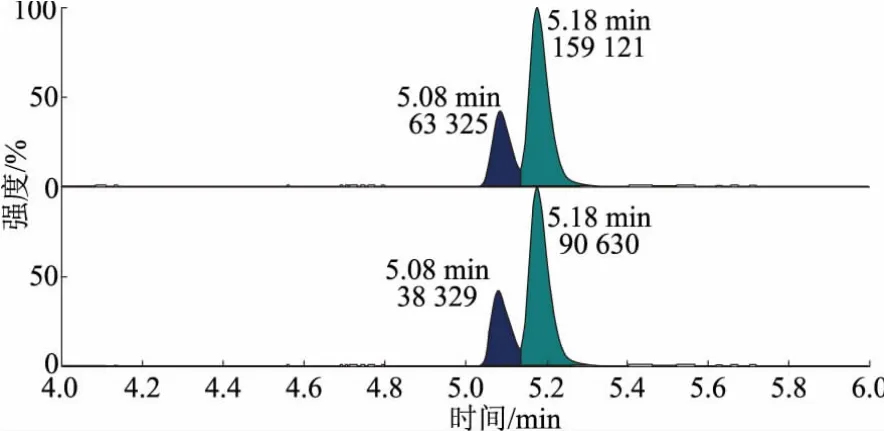
图4 烯酰吗啉加标样品图谱(1.00 μg/kg)
2.2 标准曲线和检测限
该试验条件下,烯酰吗啉在质量浓度1.00~50.00 μg/L范围内线性关系良好,标准曲线回归方程为y=1.932 69×105x+34 081.9,R2=0.999。以3倍基线噪声的药物浓度为检测限,烯酰吗啉在桑葚中的检测限为0.25 μg/kg。以4倍方法检测限为定量限,则桑葚中烯酰吗啉的定量限为1.00 μg/kg。
2.3 方法回收率和精密度
该试验条件下,烯酰吗啉在1.00、10.00和50.00 μg/kg 3个添加质量分数下的平均回收率分别为92.18%、95.11%、104.39%,相对标准偏差(RSD)分别为4.48%、4.31%和1.56%(见表3)。结果表明,该试验方法在测定桑葚中烯酰吗啉残留量时具有较高的回收率。方法的日内精密度RSD分别为4.85%、4.28%、3.48%,日间精密度RSD分别为5.13%、4.60%、4.27%(见表4)。结果表明,该试验方法具有很好的重现性和稳定性。

表3 方法的回收率(n=6)测定结果

表4 方法日内精密度和日间精密度(n=6)测定结果
2.4 方法基质效应
采用Matuszewski等[34]提出的方法来评价烯酰吗啉在桑葚样品中的基质效应,结果见表5。在1.00、10.00和50.00 μg/L 3个质量浓度水平下,烯酰吗啉在桑葚样品中的基质效应分别为93.51%、84.81%和87.51%,RSD分别为2.35%、1.12%和0.64%。由结果可知,在质量浓度为1.00~50.00 μg/L范围内,烯酰吗啉在桑葚样品中的基质效应表现为基质抑制效应,并且随着浓度的变化而变化。因此,在测定桑葚中烯酰吗啉残留量时,为避免因使用纯溶剂标准曲线进行校正引起的分析结果偏差,应采用基质匹配标准溶液或工作曲线的方法进行校正。

表5 桑葚中烯酰吗啉残留量测定的基质效应(n=5)
3 结论
该试验采用乙腈提取桑葚样品,石墨化炭黑/氨基复合柱净化,超高效液相色谱-串联质谱(UPLCMS/MS)测定其中烯酰吗啉残留量(基质匹配标准曲线进行校正)。该方法前处理操作简便,方法的选择性、检测限、回收率、精密度和标准曲线线性范围及其相关系数均满足样品分析要求,适用于桑葚中烯酰吗啉残留量的测定。
