稀土钐离子与牛血清白蛋白相互作用研究
2018-08-10吕艳阳张文生袁广胜陈越超叶盈珊
吕艳阳,张文生,袁广胜,陈越超,叶盈珊
(1.信阳师范学院 化学化工学院,河南 信阳 464000;2.中山纪念中学,广东 中山528454)
0 引言
随着稀土在农业及医学上应用的不断扩大,稀土离子与生物大分子的相互作用及对生物大分子结构和功能方面的影响日益受到重视.蛋白质是一种含多个配位基团的生物大分子,其生物功能与其特定结构密切相关.稀土进入人体内与蛋白质发生作用,会影响甚至改变蛋白质分子固有的结构和功能.因此研究稀土与蛋白质的相互作用对于了解稀土离子在体内的代谢过程及生物效应的作用机理有实际而深远的意义[1].
牛血清白蛋白与内源性化合物、药物分子及许多金属离子如Cu2+、Ni2+、Ca2+、Zn2+、Cd2+、Mn2+、Co2+和Cr2+等的相互作用已进行了较为广泛的研究[2-5].但与稀土金属离子作用的研究较少.本文用荧光光谱法研究了稀土金属Sm3+离子与BSA的相互作用,为进一步探究稀土离子在生物无机化学、药化学等领域的研究提供一些理论和应用价值方面的信息.
1 实验部分
1.1 仪器与试剂
仪器:Cary Eclipse荧光分光光度计,美国瓦里安公司;HH-2恒温水浴锅,金坛市杰瑞尔电器有限公司;精密pH计,上海雷磁有限公司;电子分析天平,上海菁海仪器有限公司.
试剂:BSA溶液,分析纯,国药集团化学试剂有限公司;三氧化二钐(Sm2O3),分析纯,天津市光复精细化工研究所;Tris(三羟甲基氨基甲烷)固体粉末,分析纯,天津市凯通化学试剂有限公司;盐酸溶液(6 mol/L),北京中诺泰安科技有限公司.
1.2 溶液的配制
配制8×10-6mol/L的BSA:用分析天平准确称量0.052 g BSA固体粉末,加蒸馏水使之完全溶解,然后定容至100 mL容量瓶中.
配制不同pH值(6.5、7.5、8.5)Tris-HCl缓冲溶液:先配制0.1 mol/L Tris溶液,即用分析天平准确称量3.029 g Tris(三羟基甲基甲烷)固体粉末,加蒸馏水使之完全溶解,然后移至250 mL容量瓶中(Tris称两份,溶解至两个250 mL容量瓶).取配制好的0.1 mol/L的Tris溶液,使其体积为V≥120 mL(够用就好,120 mL左右,取三份).然后用精密pH计(带磁力搅拌器)向其中加6 mol/L的盐酸溶液分别配制pH值为6.5、7.5、8.5的Tris-HCl缓冲溶液.
配制0.1 mmol/L的Sm3+标准溶液:用分析天平准确称量1.25 mg三氧化二钐固体粉末,用6 mol/L的盐酸溶液在HH-2恒温水浴锅条件下溶解,然后定容转移至100 mL容量瓶中.
1.3 实验方法
取8支10 mL刻度比色管,加入2.0 mL 8×10-6mol/L的BSA溶液和不同体积的Sm3+标准溶液,分三组,分别用pH值为6.5、7.5、8.5 Tris-HCl缓冲溶液定容至10 mL刻度线处,固定激发波长为280 nm,记录282~500 nm范围的荧光发射光谱.实验室激发狭缝10 nm而发射狭缝为5 nm,测定荧光光谱.
2 结果与讨论
2.1 不同Sm3+离子浓度对BSA荧光光谱的影响
按1.3实验方法设1号比色管为空白对照组(2 mL BSA,8 mL Tris-HCl),2~8号比色管先加入2 mL BSA,然后分别加入50、100、150、200、250、300、350 μL的1×10-4mol/L Sm3+标准溶液,再用pH值6.5的Tris-HCl缓冲溶液定容至10 mL刻度线处.扫描Sm3+与BSA相互作用的荧光发射光谱图,结果见图1.
同上,改变Sm3+标准溶液的浓度范围,再用pH值7.5的Tris-HCl缓冲溶液定容至10 mL刻度线处.扫描Sm3+与BSA相互作用的荧光发射光谱图,结果见图2.
同上,改变Sm3+标准溶液的浓度范围,再用pH值8.5的Tris-HCl缓冲溶液定容至10 mL刻度线处.扫描Sm3+与BSA相互作用的荧光发射光谱图,结果见图3.
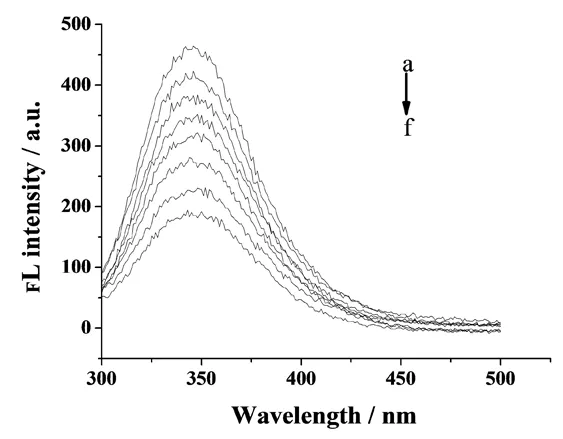
图1 缓冲溶液pH值为6.5时Sm3+与BSA相互作用的荧光发射光谱Fig. 1 Fluorescence emission spectra ofSm3+ and BSA(pH=6.5)图中从a到f曲线:往BSA中加入的Sm3+离子浓度依次为0、0.5×10-5、1.0×10-5、1.5×10-5、2.0×10-5、2.5×10-5、3.0×10-5、3.5×10-5 mol/L
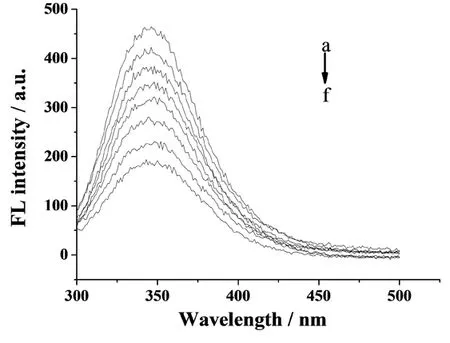
图2 缓冲溶液pH值为7.5时Sm3+与BSA相互作用的荧光发射光谱Fig. 2 Fluorescence emission spectra ofSm3+ and BSA(pH=7.5)图中从a到f曲线:往BSA中加入的Sm3+离子浓度同图1
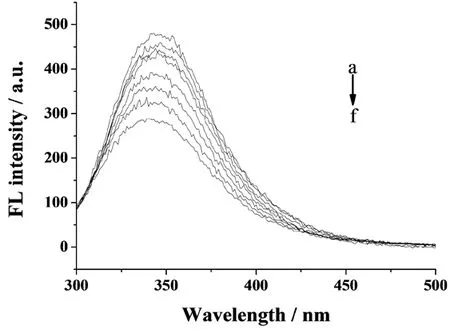
图3 缓冲溶液pH值为8.5时Sm3+与BSA相互作用的荧光发射光谱Fig. 3 Fluorescence emission spectra ofSm3+ and BSA(pH=8.5)图中从a到f曲线:往BSA中加入的Sm3+离子浓度同图1
由图1、图2、图3可以看出,在选定的Sm3+浓度范围内,Sm3+对BSA的荧光均产生了猝灭,且其荧光强度随着Sm3+浓度的增加而降低.
2.2 稀土Sm3+离子与BSA的相互作用的探究
往BSA中加入稀土Sm3+会产生荧光强度降低的现象,这是因为荧光物质与其他溶剂分子或溶质分子的相互作用而产生猝灭.故稀土Sm3+离子与BSA的相互作用使荧光强度降低也属于荧光猝灭.发生荧光猝灭的原因很多,主要有静态猝灭和动态猝灭.动态猝灭也称为碰撞猝灭[4].处于单重态的荧光分子与猝灭剂发生反应后,生成没有荧光的基态复合物.而静态猝灭则是指部分荧光物质分子与猝灭剂分子相互作用生成非荧光的络合物,故而静态猝灭也称为组合化合物的猝灭.
牛血清白蛋白的内源荧光是由分子中色氨酸残基和络氨酸残基引起的,稀土Sm3+离子的加入能使其荧光规律性猝灭.荧光猝灭过程有动态和静态之分,动态猝灭是猝灭剂与荧光剂激发态分子之间的相互作用过程,遵从Stern-Volmer方程[5]:
F0/F=1+Kqτ0C=1+KsvC,
(1)
式(1)中:F0/F指未加入猝灭剂与加入猝灭剂后的相对荧光强度.Kq是指猝灭速率常数.τ0是不含有猝灭体时荧光体的荧光寿命[3](对于大多数的生物分子τ0多为10-8s).Ksv为Stern-Volmer猝灭常数.Ksv的大小表示稀土Sm3+离子与BSA间的作用强弱.
综上所述,根据Stern-Volmer方程,在Tris-HCl缓冲溶液pH值为6.5、7.5、8.5的情况下测定荧光发射光谱在350 nm波长的相对荧光强度为F,以F0/F为纵坐标,以添加的Sm3+溶液的浓度C为横坐标作图,得出稀土Sm3+离子与BSA的Stern-Volmer猝灭曲线,如图4所示.
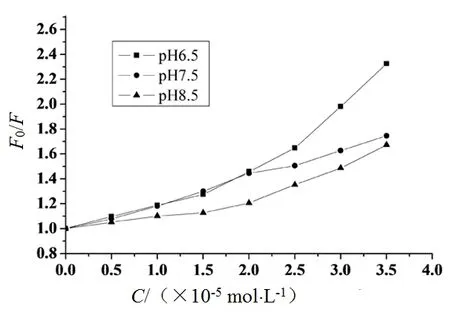
图4 不同pH值时Sm3+离子对BSA的荧光猝灭Stern-Volmer图Fig. 4 Fluorescence emission spectra of Sm3+and BSA at different pH values
从图1、图2、图3和图4可知,随着加入的Sm3+离子的浓度的增大,整个体系的荧光发射峰逐渐降低,此时Sm3+离子与BSA可能在基态时生成了不发光的复合物,从而导致了荧光强度的降低,产生了猝灭效果.
为确认Sm3+离子对BSA荧光猝灭的机理,按照图1、图2、图3中曲线在λex= 350 nm出的荧光强度及处理图4的数据,利用式(1)对各实验结果进行处理,结果如表1所示.
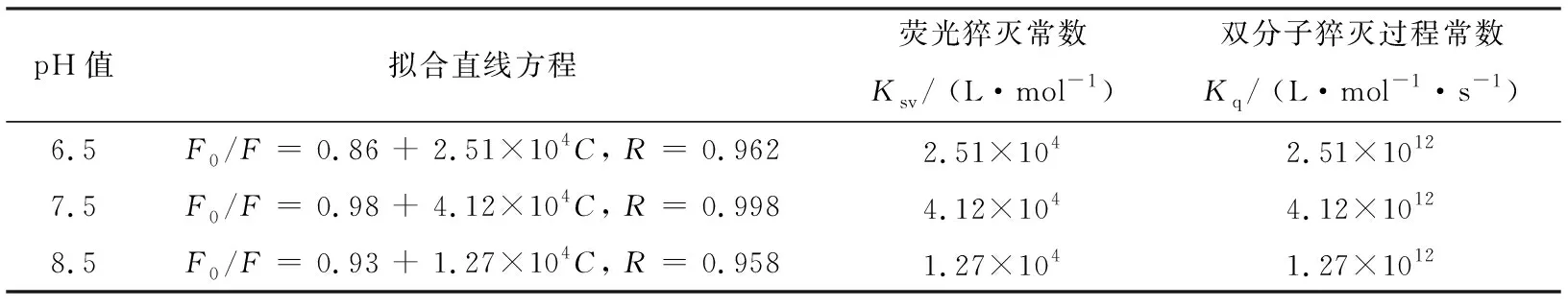
表1 Sm3+离子对BSA的荧光猝灭常数Ksv和双分子猝灭过程常数Kq
查询资料,各类猝灭剂对生物大分子最大扩散控制的碰撞猝灭常数是2.0×1010L·mol-1·s-1,本文得到的Kq远大于这一数值.说明了Sm3+离子对BSA的荧光猝灭不是动态猝灭,而是形成复合物所引起的静态猝灭[6].
2.3 稀土Sm3+离子与BSA的结合常数Ka和结合数n
在静态猝灭中,利用何锡文等[7]推导的公式(2)求出结合常数Ka和结合位数n:
lg[F/(F0-F)]=-lgKa-nlg[Q],
(2)
式(2)中:F0、F同样指的是猝灭剂与无猝灭剂时的荧光强度,Ka是BSA与稀土Sm3+离子的结合常数,[Q]是猝灭剂的平衡浓度,n是结合数.由图4和表1可以得出:pH值为7.5时拟合直线方程线性关系最好.pH 7.5时拟合的线性方程为:
lg[F/(F0-F)]= -5.945 -1.22 lg[Q],
R= 0.997.
则Ka= 9.652×105L·mol-1,结合数n= 1.22.
2.4 稀土La3+和Ce3+离子与BSA的结合常数Ka和结合数n
本文也研究了另外两种稀土离子La3+和Ce3+与BSA相互作用的荧光光谱,发现它们对BSA的荧光同样产生了静态猝灭,只是强度稍弱,pH值为7.5时结合常数Ka= 9.3×104L·mol-1、结合数n= 1.15.
3 结论
本文通过对稀土Sm3+离子与BSA相互作用的荧光光谱的研究,可以发现Sm3+离子对BSA有良好的荧光猝灭作用,并且猝灭过程为静态猝灭.通过比较可知,Tris-HCl缓冲溶液pH值为7.5时,向浓度为8×10-6mol/L的BSA溶液加入不同浓度的Sm3+离子时,其猝灭过程速率常数Kq= 4.12×1012L·mol-1·s-1、结合常数Ka= 9.652×105L·mol-1和结合数n= 1.22.该结果为进一步探究稀土离子在生物无机化学、药化学等领域的研究具有应用价值.
