2D-LC/MS/MS 在药物生物分析中的优势
2018-08-09JonasDinserDaiichiSankyoEuropeGmbHMunichGermanySonjaKrieger
文/Jonas Dinser& Daiichi-Sankyo Europe GmbH& Munich, Germany &Sonja Krieger
利用2D-LC/MS/MS分析药代动力学研究中的药物及其代谢物 // 本文展示将 Agilent InfinityLab二维液相色谱解决方案与 Agilent 6495 三重四极杆液质联用系统结合使用,分析药代动力学研究中的药物及其代谢物。二维液相色谱可避免出现共洗脱,因此能够减少信号抑制以及交叉干扰风险,这些问题可能存在于复杂样品的一维分析中。通过以更适合的洗脱方式将分析物引入质谱离子源,2D-LC/MS/MS 分析方法的第二维可用于提高质谱检测的信号强度。
在过去十年间,LC/MS/MS 已成为了药代动力学研究中用于分析药物及其代谢物的一项成熟技术。这项技术除高选择性、高分析灵敏度以及在峰归属或分子量信息等方面具有明显优势以外,也遇到了一些众所周知的困难,如难以对血浆或细胞培养基等基质复杂的生物样品进行分析。信号抑制的问题在低浓度分析物定量时尤为突出,可能造成定量限不达标。就如何将 Agilent InfinityLab 二维液相色谱解决方案与 Agilent 6495 三重四极杆液质联用系统结合在生物分析研究环境中克服上述难题,本文详细列举了两个示例,分别是:
■ 二维分离方案如何避免出现共洗脱,以及如何在处理复杂分析物混合物时降低交叉干扰风险或减少信号抑制。
■ 如何利用第二维通过改变洗脱条件提高质谱检测的信号强度,从而以更适合的洗脱液将分析物引入质谱离子源,大幅提高定量限。
实验部分
设备
Agilent 1290 In fi nity II 二维液相色谱系统包括以下模块:
■ 两台 Agilent 1290 In fi nity II高速泵;
■ Agilent 1290 Infinity II Multisampler(G7167B),配备冷却装置;
■ Agilent 1290 In fi nity II 高容量柱温箱;
■ Agilent 1290 Infinity 阀驱动,配备 2 位/4 通双向阀;
■ 两个 Agilent 1290 Infinity阀驱动,配备带 40 μL 定量环的多中心切割阀;
■ 质谱 (MS) 检测采用配备安捷伦喷射流电喷雾离子源的Agilent 6495 三重四极杆液质联用系统进行。
软件
■ Agilent OpenLAB CDS ChemStation版,版本 C.01.07 SR2[263] 以及二维液相色谱软件,版本 A.01.03 [025];
■ Agilent MassHunter 工作站 LC/MS数据采集软件,版本B.08.00,Build 8.0.8023.5 SP1;
■ Agilent MassHunter 工作站定量分析软件,版本 B.07.01,Build 7.1.524.0。
化学品
LC/MS 级乙腈和甲醇购自 TH Geyer;
LC/MS 分析所使用的甲酸和乙酸铵购自 Sigma-Aldrich;
新制超纯水产自配置 0.2 μm膜式终端过滤器的 ELGA Pureflex 2 水纯化系统。
样品和方法
1.利用二维液相色谱避免信号抑制和交叉干扰
进行体外细胞悬液测定,鉴定负责候选药物代谢的关键酶。在细胞悬液中对候选药物(小分子)和多种酶特异性探针底物及相应酶抑制剂进行温育。经过一段时间后,收集样品并分析代谢物的形成。为避免信号抑制或交叉干扰,采用色谱法对高丰度底物和抑制剂进行了分离。进样溶液中含有细胞上清液与稳定同位素标记内标溶液的混合物。方法参数如表 1所示。

图1 细胞培养上清液的 LC/MS/MS 分析结果
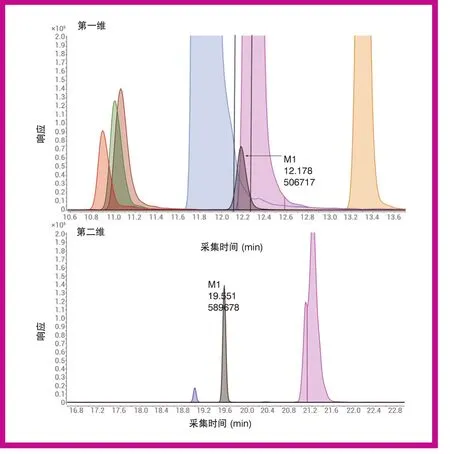
图2 细胞培养上清液的 2D-LC/MS/MS 分析结果
2.二维液相色谱通过溶剂切换提高质谱检测灵敏度通过体外细胞培养测定评估母体化合物(候选药物)及其三种主要代谢物在培养基和细胞中的浓度。在预设温育时间结束后采集样品,加入非稳定同位素标记的内标,然后进样。方法参数如表 2 所示。

表1 用于避免信号抑制的二维液相色谱方法参数
结果与讨论
利用二维液相色谱避免信号抑制和交叉干扰
在酶底物和抑制剂存在的条件下,体外细胞悬液测定得到的细胞培养上清液中含有各种代谢物,因此属于复杂混合物。图 1所示为细胞培养上清液的 LC/MS/MS 分析结果。突出显示的代谢物 M1 与浓度更高的底物和抑制剂发生了共洗脱。在此次LC/MS/MS 分析中,代谢物 M1 发生信号抑制,原因是该代谢物与丰度更高的底物和抑制剂发生了共洗脱。对于结构相关化合物,还可能有交叉干扰的问题。
要避免信号抑制和交叉干扰,分析细胞上清液时需要采用一种能够将代谢物与底物和抑制剂分离开来的色谱方法。为确保将代谢物M1 与共洗脱底物和抑制剂分离,采用了中心切割 (MHC) 二维液相色谱。在基于时间的模式下,对代谢物M1 进行中心切割,然后转移至选择性不同的第二维 (2D) 进行分离。在第二维分离中,代谢物M1 与高丰度底物及抑制剂
发生充分分离,如图 2 所示。代谢物 M1与高丰度底物及抑制剂的分离可避免信号抑制和交叉干扰。
利用基于时间的 MHC 二维液相色谱将16 个目标代谢物从第一维转移至第二维。这样可使目标化合物与底物及抑制剂进一步分离,从而使分析的总运行时间仅为 35分钟。如果采用一维方法将 16 个目标代谢物与底物及抑制剂分离开来,需要开发六种不同的方法,每种方法的运行时间为 25 分钟(相关数据未显示)。在这种情况下,MHC 二维液相色谱的使用节省了大量的时间和样品。
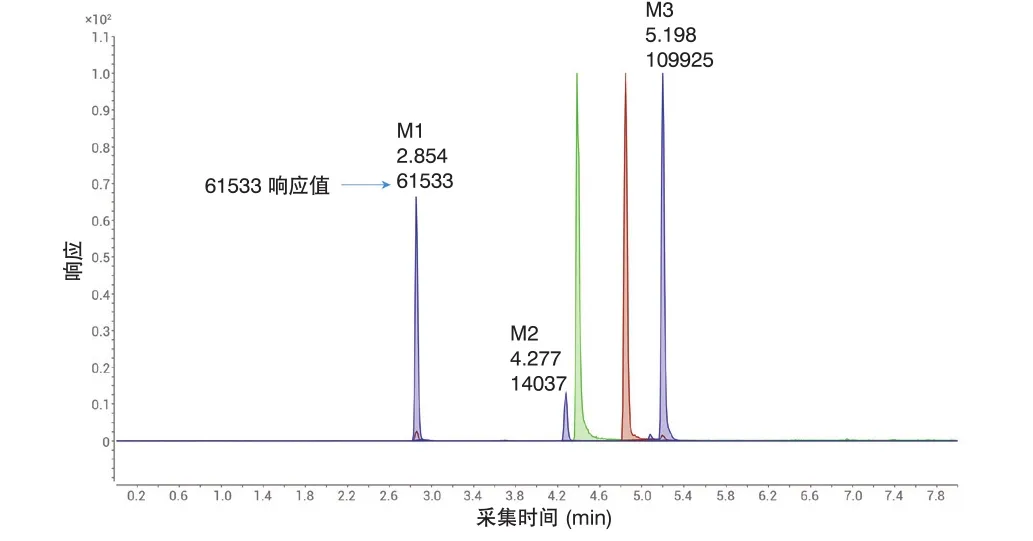
图3 对体外细胞培养测定样品中一个母体化合物(棕色迹线)及其三个代谢物(M1-M3,蓝色迹线)以及一个内标(绿色迹线)进行LC/MS/MS 分析得到的结果
二维液相色谱通过溶剂切换提高质谱检测灵敏度
在体外细胞培养测定中,如果是一种母体化合物和一种代谢物,则必须通过基于内标的外部校准法进行定量。如果还有两种代谢物,则必须进行相对定量,因为没有相应分析标准品。图 3 所示为采用现有一维 LC/MS/MS 方法得到的分析结果。
方法优化时测试了不同的色谱柱和溶剂组合。图 4 所示为方法优化过程中得到的两幅 LC/MS/MS 色谱图。图 4A 中采用的是与图 3 现有 LC/MS/MS 方法类似的条件。在上述条件下,全部三种代谢物(M1–M3) 均实现了彼此分离以及与母体化合物和内标的分离,但所选溶剂导致质谱检测灵敏度受到影响。向流动相中加入乙酸铵和甲醇,质谱检测灵敏度得到大幅提升,但代谢物 M1–M3 之间的分离以及与母体化合物和内标之间的分离受到了影响,如图 4B 所示。代谢物 M1 与 M3 的共洗脱问题尤为严重,因为三种代谢物的质量离子对相同,因此需要通过色谱分离。
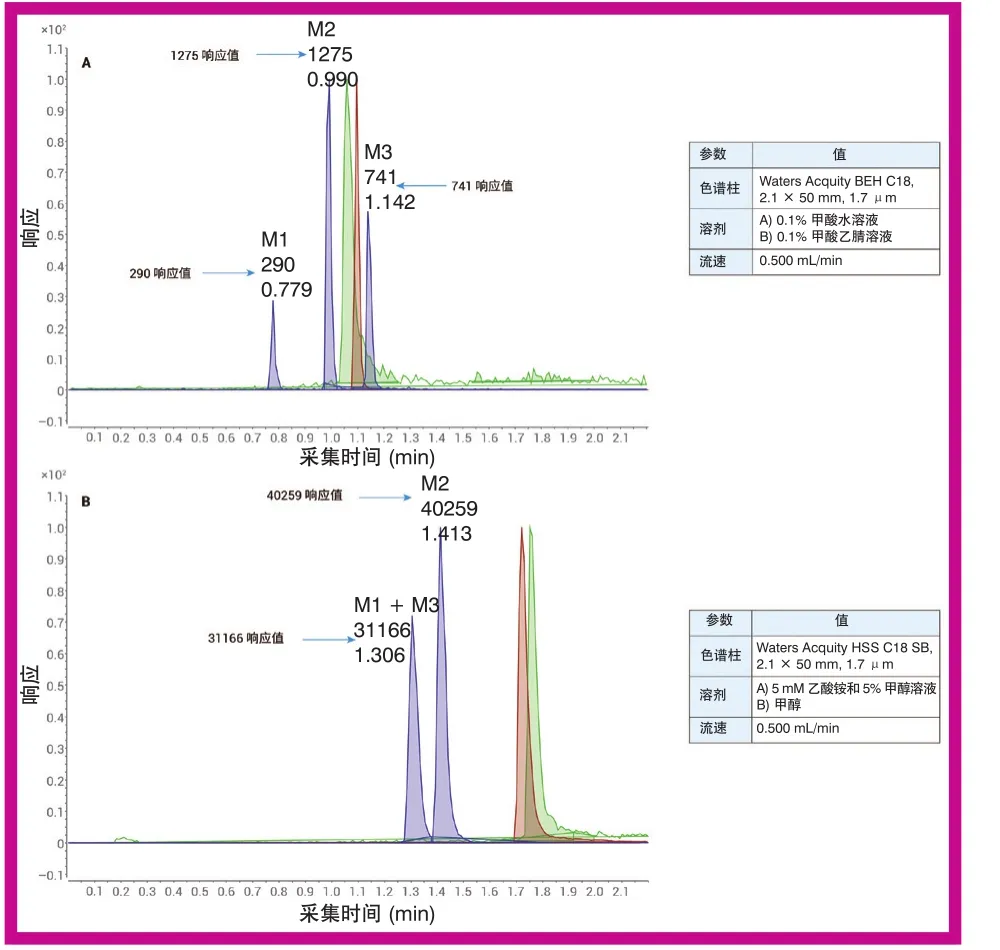
图4 LC/MS/MS 方法开发中得到的色谱图

图5 2D-LC/MS/MS 方法开发中得到的第一维色谱图
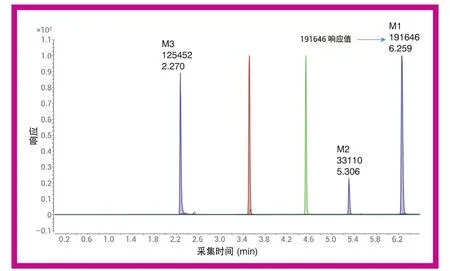
图6 对体外细胞培养测定样品中一个母体化合物(棕色迹线)及其三个代谢物(M1–M3,蓝色迹线)以及一个内标(绿色迹线)进行 2D-LC/MS/MS 分析得到的结果
为了达到水和乙腈流动相中加入甲酸后的分离效果,同时拥有流动相中加入乙酸铵和甲醇后的质谱检测灵敏度,本研究利用多中心切割将两种分离方法在二维液相色谱方法设置中进行了结合。在第一维中,将流速提高至 0.9 mL/min 以加快分析速度。图 5 所示为最终的第一维分离结果。利用基于时间的中心切割法将五个目标峰转移至第二维。在第二维中,采用快速梯度(第二维周期 1.0 分钟)将化合物捕集到第二维色谱柱,然后用第二维溶剂洗脱至质谱离子源,以提高检测灵敏度。对体外细胞培养测定样品进行 2D-LC/MS/MS分析后得到的第二维色谱图如图 6 所示。与原始 1D-LC/MS/MS 方法中代谢物M1 61533 的响应值(图 3)相比,2D-LC/MS/MS 方法中代谢物 M1的响应值达191646(图 6),质谱检测灵敏度提高了 15 倍,同时进样量从 5 μL 降至 1 μL。2D-LC/MS/MS 分析的总运行时间从9.5 分钟缩短至 6.5 分钟。

表2 用于提高质谱检测灵敏度的二维液相色谱方法参数
结论
在药代动力学研究中将 2DLC/MS/MS 技术用于药物及其代谢物的应用引入了第二维分离,因此可避免出现共洗脱,并消除上述复杂样品中的交叉干扰风险。从体外细胞悬液测定细胞上清液的分析中已经证实了这种可能性。二维液相色谱卓越的分离能力实现了在 35分钟的总运行时间内对 16 种目标代谢物的分析,与采用六种不同方法对目标代谢物进行 1D-LC/MS/MS 分析的方法相比,这种方法能够节省大量时间和样品。
2D-LC/MS/MS 方法中第二维的使用成功提高了质谱检测的信号强度。在该方法设置中,第一维采用能够分离目标分析物的条件,而在第二维中选择有助于达到绝佳质谱检测灵敏度的条件。以更适合的洗脱液将分析物引入质谱离子源的方式大大提高了定量限。
