燕麦幼苗对干旱-低温交叉适应的生理响应及其综合评价
2018-08-08刘建新刘秀丽王金成
刘建新,刘秀丽,王金成
(甘肃省高校陇东生物资源保护与利用省级重点实验室,陇东学院生命科学与技术学院,甘肃 庆阳 745000)
燕麦(AvenanudaL.)是禾本科燕麦属一年生小杂粮作物,生育期短、抗逆性强,其籽粒不仅营养价值高[1],还具有控制血糖、血压和血脂升高的保健功效[2]。燕麦在中国主要分布于西北、西南和华北等省区,年种植面积约1.6×107hm2[3]。燕麦喜凉爽但不耐寒,幼苗能忍耐-2℃~-4℃的低温。在中国西北地区的早春季节不仅少雨干旱,而且倒春寒气候时常发生,干旱和低温交叉胁迫成为影响燕麦幼苗生长发育,继而影响产量和品质的制约因素。因此,探讨燕麦幼苗干旱-低温交叉适应的生理机制,对减轻燕麦低温逆境胁迫和高产稳产栽培具有重要意义。
植物遭受某种不良环境后不仅增强这种特定环境的适应能力,还能产生抵抗其它不良环境的能力称为植物的交叉适应[4]。关于植物交叉适应的研究目前主要集中在干旱、盐胁迫、高温和低温等方面,人们对植物交叉适应的机理尚缺乏深入和全面的了解。张俊环和黄卫东[5]研究得出,高温锻炼和低温锻炼能够诱导葡萄幼苗对温度逆境的交叉适应性,认为高温锻炼诱导的葡萄抗冷性和低温锻炼诱导的耐热性有着相似的抗氧化保护机制。Streb等[6]研究表明,低温和重金属诱导的豌豆对低温下光系统Ⅱ保护能力的增强与叶片抗坏血酸和谷胱甘肽含量提高相关。小麦[7]和黄瓜[8]对干旱-低温适应能力的增强与渗透溶质含量和渗透调节能力提高有关。研究发现,旱盐交叉胁迫下适量土壤含盐量会通过提高渗透调节[9]和抗氧化系统活性[10]缓解轻、中度干旱胁迫对燕麦幼苗的伤害。为进一步了解干旱能否增强燕麦对低温胁迫的交叉适应能力,本研究采用聚乙二醇6000(PEG)模拟干旱预处理燕麦幼苗,检测低温胁迫下燕麦叶片活性氧物质、膜脂过氧化产物、渗透调节物质含量和抗氧化系统活性及植株生长状况,采用主成分和隶属函数分析综合评价干旱诱导燕麦幼苗低温交叉适应的作用,旨在为探索燕麦苗期抗寒新途径提供理论依据。
1 材料与方法
1.1 材料培养与处理
试验于2015年4-7月在甘肃省高校陇东生物资源保护与利用重点实验室进行。供试燕麦品种为 ‘定莜6号’(种子由甘肃省定西市旱作农业科研推广中心提供)。挑选饱满一致、无病虫害的种子,用自来水清洗干净后浸泡6 h,播种在装有珍珠岩的培养皿(直径12 cm)中,每皿播200粒左右,共播种180个培养皿。浇足水后置于人工气候箱中萌发生长,常规管理。人工气候箱昼/夜温度25℃/16℃,光周期13 h/11 h(昼/夜),光照强度100 μmol·m-2·s-1,湿度65%~75%。当幼苗2叶1心期时浇灌1次Hoagland营养液以补充养分,再培养7 d后进行处理。将180个培养皿幼苗分成两组,每组90个,其中一组用20% PEG浇灌幼苗以模拟干旱胁迫,3 d后幼苗叶片出现萎蔫,然后用蒸馏水清洗培养皿中PEG,洗净后加入Hoagland营养液培养2 d至幼苗恢复正常;同时,另外一组以未经PEG处理的幼苗作为对照(CK)。然后将干旱预处理及对照幼苗放入人工气候箱中进行昼/夜温度为8℃/5℃(甘肃省中部燕麦种植区3~4月份遭倒春寒后常见的低温)低温胁迫。每组处理3次重复,随机排列,每天交换培养皿位置以保证光温条件一致,分别于低温处理的0、1、3、5、7 d从上往下取幼苗1~2片全展叶,用液氮速冻后-70℃保存,用于测定相关生理指标。低温处理7 d后测定植株株高增量和生物量增量。
1.2 测定指标与方法
1.2.1 株高增量和生物量增量 幼苗低温胁迫前及低温胁迫7 d后用直尺测量30株植株从茎基部到叶尖的高度,计算株高增量Δh(cm)=低温胁迫7 d后株高(h2)-低温胁迫前株高(h1)。分别取100株低温胁迫前和低温胁迫7 d后幼苗,在105℃杀青30min后70℃烘至恒重称生物量,计算生物量增量Δm(g)=低温胁迫7 d后生物量(m2)-低温胁迫前生物量(m1)。

1.2.3 抗氧化酶活性和抗氧化物质含量 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)活性及抗坏血酸(ASA)和谷胱甘肽(GSH)含量均按陈建勋和王晓峰[14]的方法测定。
1.2.4 渗透调节物质含量 采用李合生[13]的蒽酮比色法、考马斯亮蓝法、茚三酮染色法和磺基水杨酸法分别测定可溶性糖(SS)、可溶性蛋白质(SP)、游离氨基酸(AA)和脯氨酸(Pro)含量。
1.3 数据统计分析
为克服单一指标评价带来的片面性,对检测的14项生理指标值采用SPSS 20.0软件离差标准化后进行主成分分析,得到不同处理时间主成分的得分值后再计算隶属函数值,然后根据主成分分析方差贡献率的大小计算出各主成分的加权综合评价值(D值),再对D值进行单因素方差分析,Duncan法检验差异显著性(P<0.05),最后用Excel 2003将D值与不同处理时间作图,以平均值±标准差表示D值结果。
原始数据离差标准化值Xj用公式:
(1)
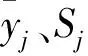
隶属函数值U(Xj)计算用公式:
U(Xj)=(Xj-Xjmin)/(Xj-Xjmax)
(2)
式中,Xjmin、Xjmax分别是第j个综合指标Xj的最小值和最大值。
综合指标权重Wj计算用公式:
Wj=Pj/∑Pj
(3)
式中,Pj为各处理组第j个主成分的特征值。
综合评价值D计算用公式:
D=∑[U(Xj)×Wj],j=1,2,3,…,n
(4)
2 结果与分析
2.1 PEG预处理对低温胁迫下燕麦幼苗生长状况的影响
从图1可见, 与CK相比,PEG模拟干旱预处理显著提高了燕麦幼苗在低温胁迫下的株高增量和生物量增量,增幅分别为28.0%和30.1%。
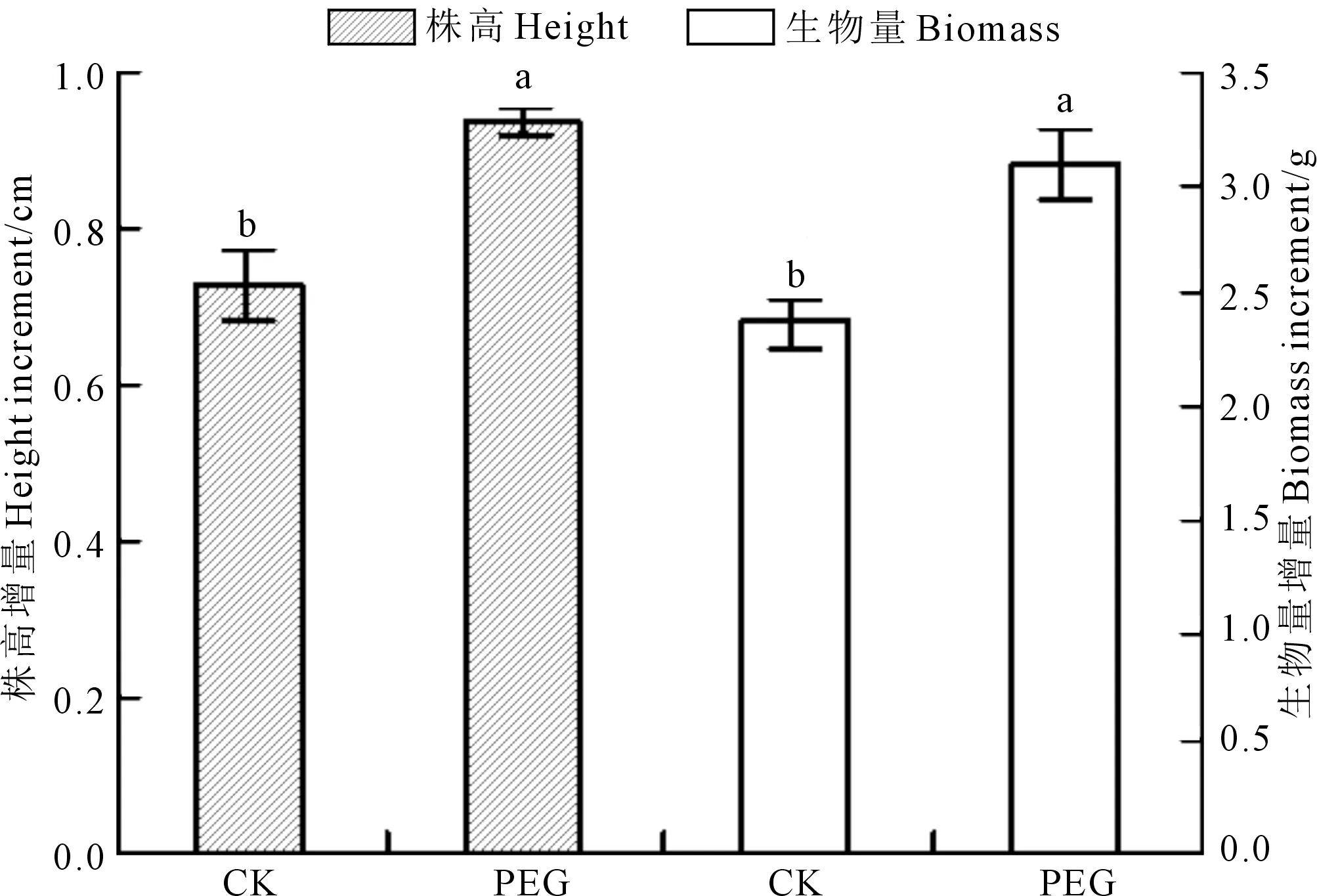
注:不同字母表示处理间在P<0.05水平下差异显著,下同。Note: The different letters mean significant differences at P<0.05. The same below.图1 PGE预处理对低温下燕麦株高和生物量增量的影响Fig.1 Effect of PEG pretreatment on the height increment and biomass increment of oat seedlings under low temperature stress
2.2 PEG预处理对低温胁迫下燕麦幼苗生理指标的影响
表1低温胁迫下燕麦幼苗生理指标
Table 1 Physiological indexes in leaves of oat seedlings under low temperature stress

指标IndexPEGCK0d1d3d5d7d0d1d3d5d7dO∸2/(μmol·g-1FW)0.3830.1790.0320.0180.2300.6560.2250.0620.0270.116H2O2/(mg·g-1FW)1.4333.7534.3033.4776.0971.4102.1034.5872.9831.433MDA/(nmol·g-1FW)1.5433.57321.0135.4534.1803.5435.5903.9602.8571.543SOD/(U·g-1FW)30.8033.9728.2022.5021.7733.2733.0031.5335.0330.80CAT/(U·g-1FW)471.7702.0647.31264.070.7330.0233.3577.3269.0471.7POD/(U·g-1FW)9.5315.7731.5520.5211.428.4811.9711.5518.259.53APX/(U·g-1FW)3.945.8333.193.362.884.055.883.253.083.94ASA/(μg·g-1FW)23.0022.4738.3358.1348.4314.0759.1338.0028.3723.33GSH/(μg·g-1FW)4.1532.2431.9936.7373.6835.0473.7805.4875.1774.153SS/(mg·g-1FW)1.322.682.554.435.201.302.242.564.661.32SP/(mg·g-1FW)38.3052.3357.5341.8775.6744.1353.5391.1032.4738.30AA/(mg·g-1FW)1.322.682.554.435.141.373.542.284.661.32Pro/(mg·g-1FW)0.1700.3210.6730.3720.9400.1440.1060.1610.8120.170RWC/%84.975.373.962.051.266.562.663.453.684.9

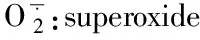
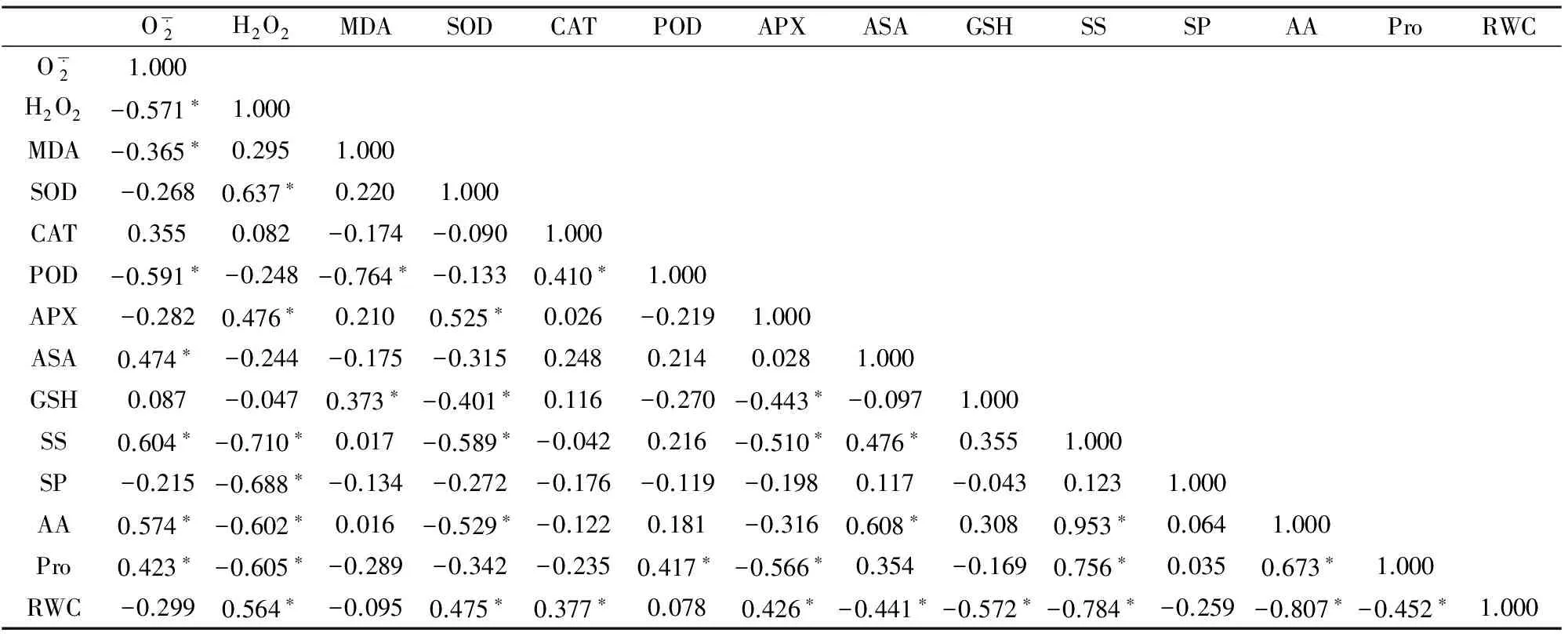
表2 变量之间的相关系数Table 2 Correlation coefficient of 14 variables oat seedling
注:*表示在0.05水平上显著相关。Note:*Show significant correlation at 0.05 levels.
2.3 离差标准化数据的主成分分析

2.4 PEG预处理对燕麦幼苗耐冷性的隶属函数综合评价
将主成分得分系数(表3)乘以各标准化原始变量后求和可得各处理的综合指标值CI(x)[15],见表4。根据公式(2)计算各处理综合指标值的隶属函数值U(Xj),再根据公式(3)计算可得5个综合指标的权重Wj分别为0.448、0.210、0.130、0.111、0.102,然后根据公式(4)计算得到隶属函数综合评价值D(表4)。D值越大,植株耐低温的能力越强。为了更加直观显示低温胁迫下PEG预处理后燕麦幼苗综合评价值(D值)与CK的差异,将表4中的D值与处理时间作图。从图2可见,不论是CK幼苗还是PEG处理的幼苗与低温胁迫前相比,D值随低温胁迫时间延长呈递增趋势,PEG处理的幼苗在低温处理7 d时D值有所下降。然而,除第1天CK幼苗的D值高于PEG处理的幼苗外,在低温胁迫的第0、3、5、7天PEG处理幼苗的D值显著高于CK。表明干旱预处理更能增强燕麦幼苗对低温的适应能力。
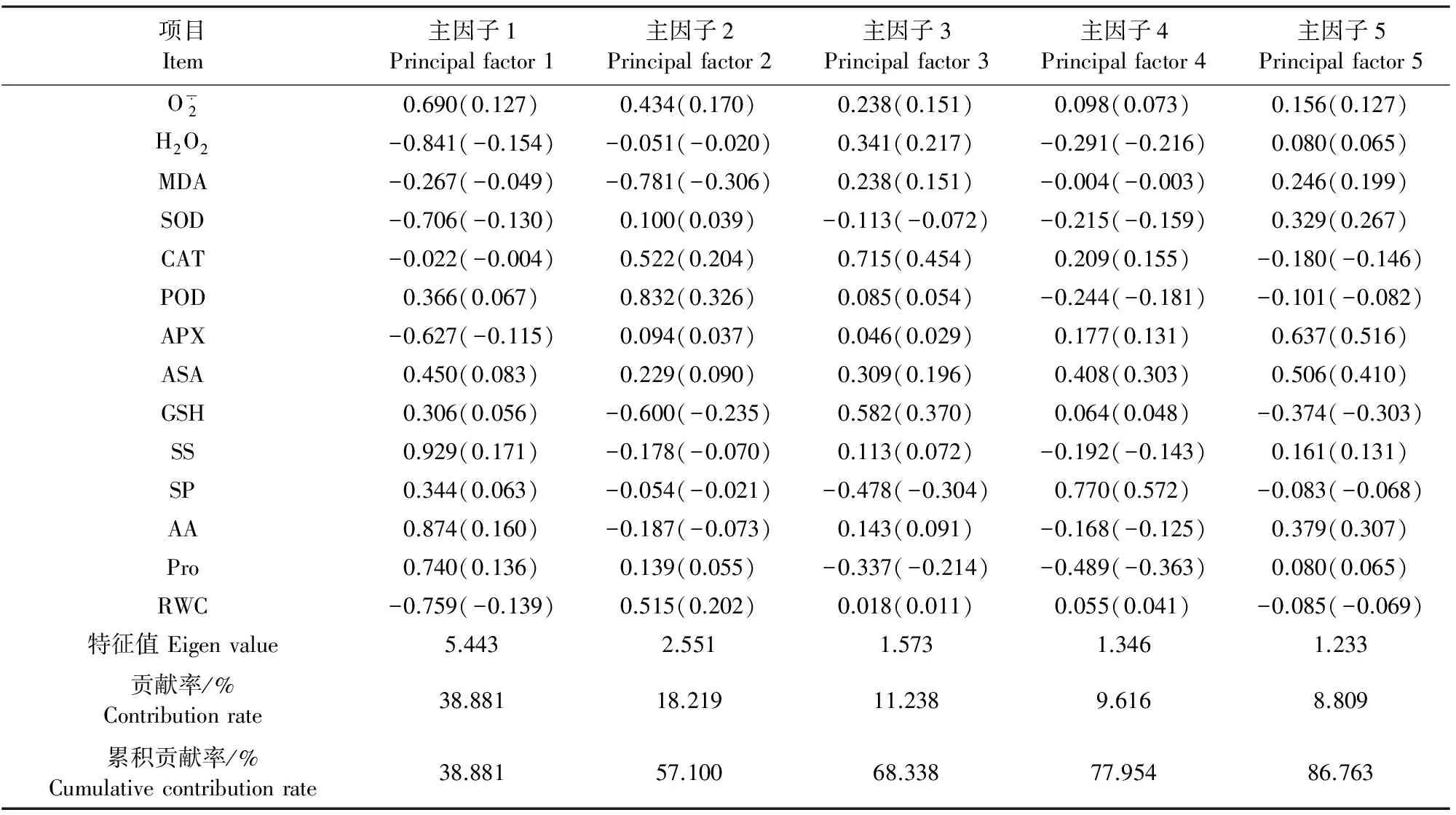
表3 各主因子的系数、得分系数、特性值和贡献率
注:括号内数值为得分系数。Note: The value in bracket is score coefficient.

表4 各处理的综合指标值CI(x)、权重Wj、隶属函数值U(Xj)和综合评价值(D)
3 讨 论
植物的抗性表现是诸多生理代谢综合作用的结果,若以单个或少数几个指标的改变很难全面和准确评价植物对干旱-低温的交叉适应性。因此,本研究未逐一考察单个指标对燕麦干旱-低温交叉胁迫的响应,而是将上述检测的14项生理指标值离差标准化后采用主成分分析,将14个存在信息重叠的单项指标综合为5个相互独立的主成分变量,这5个主成分变量的特征值分别为5.443、2.551、1.573、1.346、1.233,贡献率分别为38.881%、18.219%、11.238%、9.616%、8.809%,累积贡献率达86.763%(表3),说明用这5个主成分因子代替14个单项指标具有较强的信息代表性。由此,计算5个主成分因子的得分系数(表3),再乘以相应标准化原始变量值后求和得到不同处理时间的综合变量得分值(表4)。根据各主成分因子贡献率的大小确定其相对权重,进行隶属函数加权分析。结果表明,干旱预处理显著提高了燕麦幼苗在低温胁迫下的综合评价值(图2),说明干旱能够增强燕麦对低温的交叉适应性。另外,干旱预处理提高低温下燕麦幼苗株高增量和生物量增量(图1)进一步证明了这个结论。这与前人在小麦[7]和黄瓜[8]上的研究结果一致。然而,人们对植物交叉适应的机理还知之甚少。多年生黑麦草经中度干旱后可使低温下的叶片相对含水量、叶绿素含量降幅减小,而脯氨酸、可溶性糖含量和抗氧化酶活性增加[16]。干旱诱导黄瓜对低温交叉适应性的提高与渗透调节能力增强有关[8]。本试验表明,干旱预处理燕麦能够通过改善体内ROS代谢平衡和渗透溶质积累,增强对低温的耐受能力,从而可为生产上燕麦苗期低温伤害预防提供参考。Janicka-Russak等[17]报道,低温改变植物质膜H+-ATP酶基因表达及酶蛋白的磷酸化修饰。Romanenko等[18]研究表明,抗寒锻炼使低温下植物亚细胞隔室中的一些蛋白(如脱水蛋白)产生积累和转移。干旱诱导植物低温交叉适应的分子机理尚需进一步深入探讨。
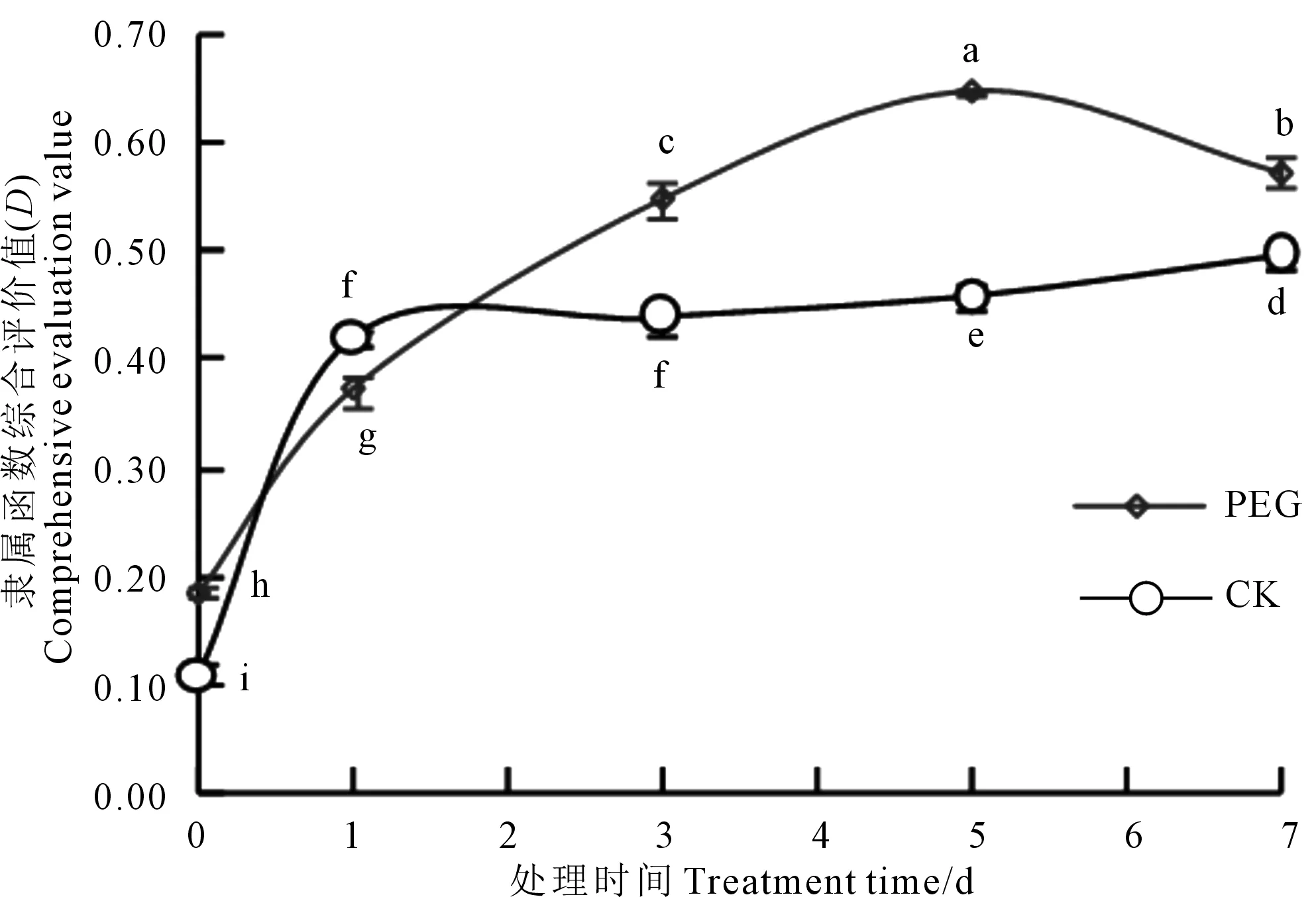
图2 燕麦幼苗对干旱-低温交叉适应的综合评价Fig.2 The comprehensive evaluation of cross adaptation of oat seedlings to drought-low temperature
