口咽癌患者术后精确放疗应用MRI和18FDG PET-CT检查的临床价值分析
2018-08-08河南省开封市中心医院口腔科河南开封475000河南省开封市中心医院影像科河南开封475000河南省开封市中心医院放疗科河南开封475000
1.河南省开封市中心医院口腔科(河南 开封 475000)2.河南省开封市中心医院影像科(河南 开封 475000)3.河南省开封市中心医院放疗科(河南 开封 475000)
刘会林1 李 立2 陈华旭3
口咽癌是极为常见的头颈部恶性肿瘤,其临床诊断难度不大,肉眼、镜下活检均能发挥诊断价值。但在口咽癌的治疗上,因其极易侵犯周围组织,并沿组织、血管、肌肉间隙像深部扩散,从而产生淋巴结转移,预后相对较差[1]。而近年来,随着手术技术、放疗等治疗手段的日渐改进及完善,口咽癌的临床治疗已初步形成手术联合术后放疗的治疗模式。口咽部解剖构造特殊,位置深且狭窄,术中如何一期重建并恢复形态功能、如何确定外科手术切除范围等均增加手术难度,术后病灶残留、复发等已成为局部手术治疗口咽喉疗效不佳的主要因素[2]。而精确放疗是指给予残留病灶高剂量照射,通过提高局部控制率达到有效清除术后残留病灶,降低术后复发风险的目的。口咽癌患者经手术治疗后,解剖构造及组织形态的改变,加之术后病灶软组织炎性反应及持续水肿,导致计算机断层扫描(CT)、MRI等显像手段难以对术后残留病灶进行有效鉴别,难以确认淋巴结是否清扫完毕,影响疗效评估[3-4]。局部组织取样活检虽是病理诊断金标准,但有创,且术后病灶黏膜反应极大限制了活检的临床开展;鉴于此,本研究着重分析口咽癌患者术后精确放疗应用MRI和18FDG PET-CT检查的临床价值,具体报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2014年8月~2017年7月在我院进行精确放疗的49例口咽癌患者的MRI及18FDG PET-CT检查资料。其中男29例,女20例,年龄47~69岁,平均(51.22±4.65)岁,病理分型为舌根鳞癌19例,软腭鳞癌21例,扁桃体鳞癌6例,口咽侧壁鳞癌3例,病理分期为Ⅱ期15例,Ⅲ期21例,Ⅳ期13例。
1.2 纳入与排除标准 纳入标准:1)符合口咽癌[5]诊断要求,并有明确病理佐证;2)手术方式均参照2013年版NCCN指南对瘤体病灶切除,并加行单侧或双侧颈淋巴结清扫术;3)术后为并发严重并发症,未见远处转移;4)术后18FDG PET-CT及MRI检查间隔时间<7d;5)自愿参与研究并签署研究知情同意书。
排除标准:1)ps评分>2分;2)精确放疗后1个月、3个月时未行18FDG PET-CT或MRI,不能满足研究条件;3)临床资料缺失。
1.3 方法
1.3.118FDG PET-CT检查:1)设备:Discovery STE型PET/CT仪,显像剂为18F-FDG,均来自美国GE公司;2)参数设置:常规螺旋CT扫描参数:140kV、160-200mA,螺距0.75,球管单圈旋转时间0.8s;18FDG PET-CT扫描参数:层厚3mm,50cmAFOV,平均6个床位,4min/床位;3)图像重建方式:工作站为XELERIS,应用有序子集最大期望值迭代法(OSEM)将显像资料衰减、校正后将PET图像与CT图像进行多层面、多幅成像对位融合;4)检查条件:患者需空腹4h后开始检查,且血糖值<6.6mmol/L,平静状态下于肘静脉注射18F-FDG 259-444MBq后静止休息40min~60min,先行常规螺旋CT扫描,再行18FDG PET-CT;5)诊断方法为定性分析及半定量分析,综合患者术前肿瘤状况及手术切除相关情况分析,在CT引导下明确可疑代谢异常部位,并沿病灶周围划定感兴趣区域(RIO),在XELERIS工作站中自动计算RIO区被标准摄取值(SUV),并以SUVmax作为最终结果。
1.3.2 MRI检查:1)设备:美国GE公司的3.0T磁共振成像系统,造影剂为马根维显,剂量15ml,工作站为GE 4.4工作站,图像分析软件为Functool;2)扫描参数:T1加权像(T1W1)重复时间(TR)=400~600ms、回波时间(TE)=15~30s、层厚5mm、层间距0.5mm、矩阵512×512、有效视野(FOV)380×380;T2加权像(T2W1)TR=2000~3000ms、TE=80~150ms、层厚5mm、层间距0.5mm、矩阵320×320、FOV 240×240;弥散加权成像(DWI)序列:单次激发平面回波成像序列(EPI序列),TR=2000~3000ms、TE=80~100ms、层厚5mm、层间距0.5mm、矩阵256×256、FOV 380×380;3)应用GE 4.4工作站及Functool字符测量DWI图像上的RIO区型号强度,并计算弥散系数(ADC值)。
1.4 观察指标 1)所有患者均于放疗前进行18FDG PET-CT、MRI检查,并以纤维喉镜检查结果作为金标准,对经18FDG PET-CT、MRI检查诊断为可疑转移的颈部淋巴结进行鉴别,统计18FDG PETCT、MRI检查的准确度、特异度、灵敏度、阳性预测值、阴性预测值及一致性;2)所有患者均于放疗前、放疗后1个月、3个月时行18FDG PET-CT、MRI检查,并记录SUVmax及ADC值。
1.5 统计学方法 统计学分析软件为SPSS 19.0,计量资料以()示,多组间比较行方差分析,计数资料以%表示,行计χ2检验,p<0.05为差异有统计学意义。

表1 18FDG PET-CT对残存病灶的检出率与金标准比较
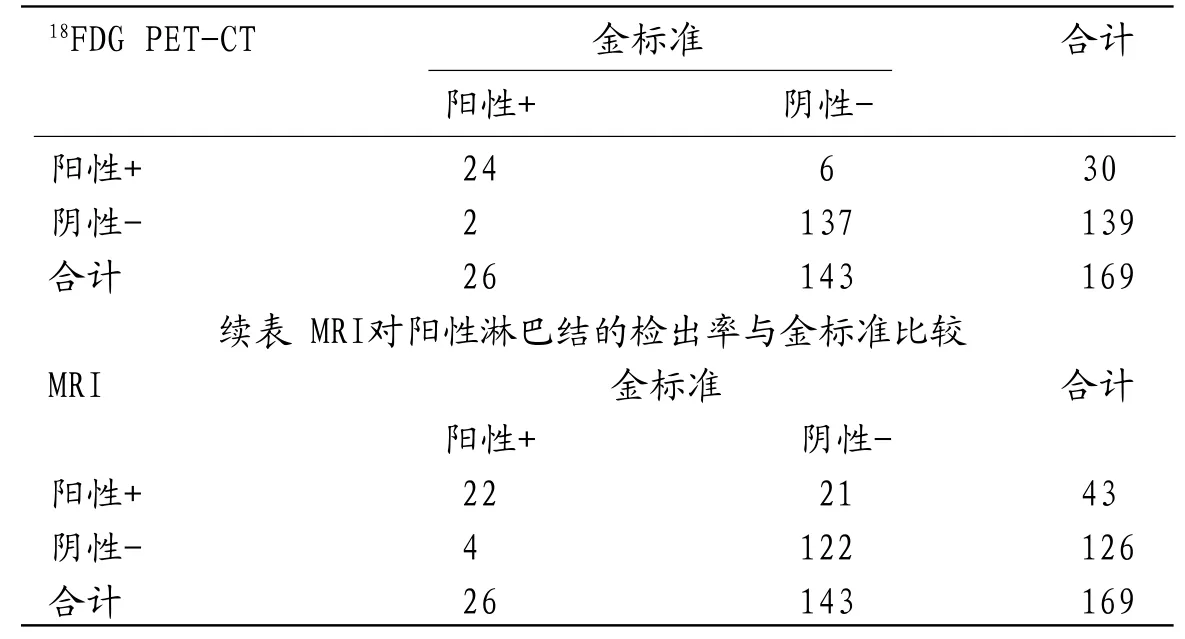
表2 18FDG PET-CT对阳性淋巴结的检出率与金标准比较

表3 精确放疗前后18FDG PET-CT(SUVmax)及MRI(ADC值)检查结果比较
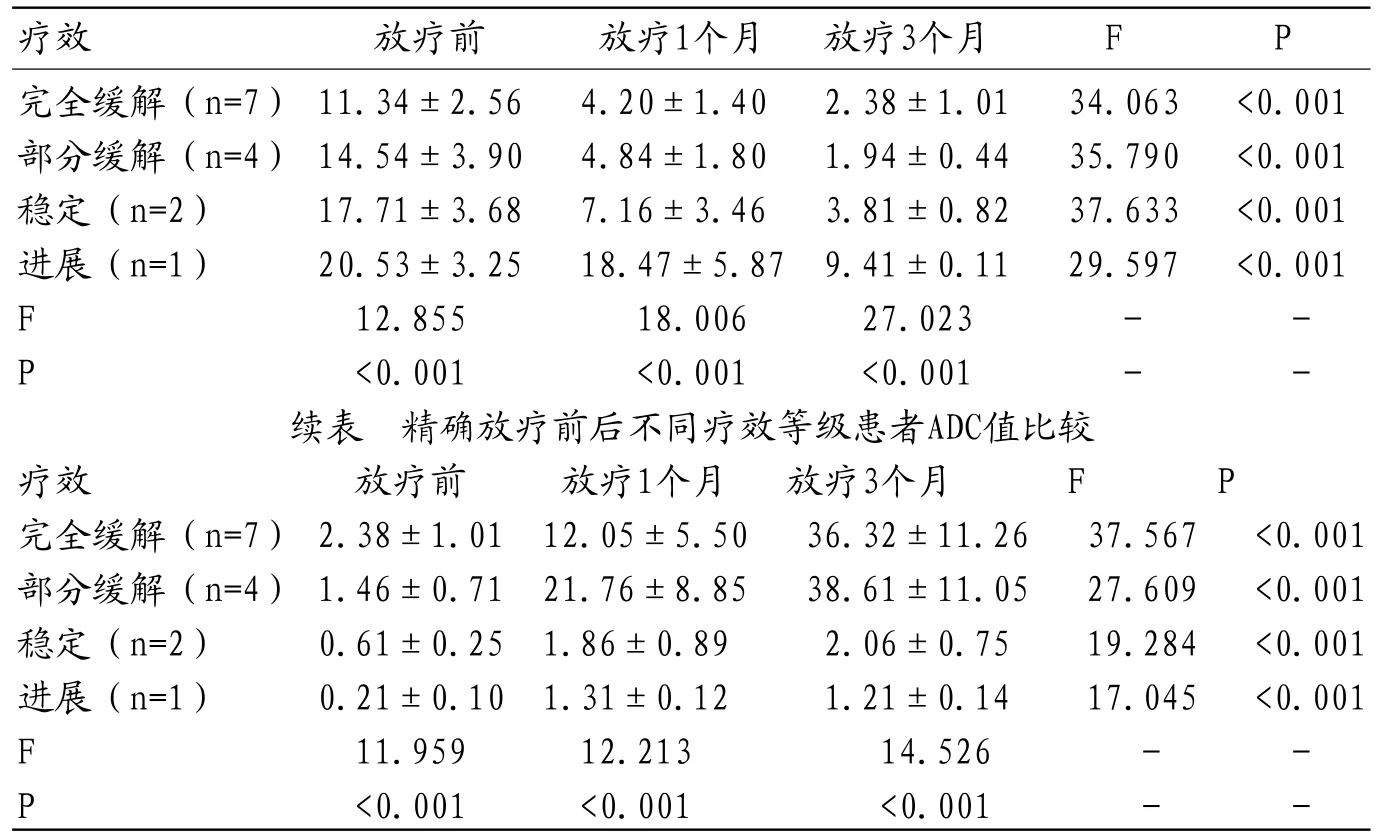
表4 精确放疗前后不同疗效等级患者SUVmax值比较
2 结 果
2.118FDG PET-CT、MRI对残存病灶的检出率与金标准比较术后经纤维喉镜活检,共检出阳性残存病灶14例,18FDG PET-CT诊断残存病灶的准确率为94.33%、特异度为94.87%、灵敏度为92.85%、阳性预测值为86.67%、阴性预测值为97.36%、kappa值为0.857,18FDG PET-CT诊断残存病灶与纤维喉镜检出结果具良好的一致性;而术后MRI共检出17例残存病灶,MRI诊断残存病灶的准确率为75.47%、特异度为79.48%、灵敏度为64.28%、阳性预测值为52.94%、阴性预测值为86.11%、kappa值为0.409,如表1及其续表。
2.218FDG PET-CT、MRI对阳性淋巴结的检出率与金标准比较53例患者经18FDG PET-CT、MRI共检出169枚颈部淋巴结,超声引导下穿刺活检证实26枚为转移淋巴结;经18FDG PET-CT诊断阳性淋巴结的准确率为95.26%、特异度为95.58%、灵敏度为92.30%、阳性预测值为80.00%、阴性预测值为98.56%。Kappa值为0.828,提示18FDG PET-CT诊断阳性淋巴结与病理金标准具良好的一致性;MRI诊断阳性淋巴结的准确率为85.20%、特异度为85.31%、灵敏度为84.61%、阳性预测值为51.16%、阴性预测值为96.82%。Kappa值为0.465,提示一致性较差,见表2及其续表。
2.3 精确放疗前后18FDG PETCT及MRI检查结果(SUVmax)比较 术后残存病灶及术后原发病灶经精确放疗后可见SUVmax显著下降,经方差分析,多组间比较差异有统计学意义(p<0.05),但放疗1一个月与放疗3个月时其SUVmax对比差异无统计学意义(P>0.05);术后残留病灶经精确放疗后MRI扫描DWI成像ADC值显著上升,组间比较差异有统计学意义(p<0.05),但术后原发病灶经放疗后组间ADC值对比差异无统计学意义(P>0.05),见表3及其续表。
2.418F--FDGPET/CT及MRI检查与精确放疗疗效比较 参照实体瘤疗效评价标准[5],以疗效等级暴露分组,14例术后残存病灶患者中,不同疗效等级患者放疗前、放疗1一个月及3个月时及同一疗效等级患者放疗前、放疗1个月及3个月时的SUVmav值、ADC值多组间对比差异皆有统计学意义,见表4及其续表。
2.5 观察病例 病例1:男,49岁,术后18F-FDG+PET/CT诊断残存病灶为阳性表达,而MRI呈阴性表达,后经病理金标准明确为阳性病灶,见图1-2。病例2:女,57岁,术后18F-FDG+PET/CT诊断淋巴结为阳性,MRI诊断阴性,经病理活检明确为阴性,见图3-4。
3 讨 论
MRI在头颈部肿瘤的临床诊断、分期及疗效评价上虽发挥了重要价值,但在进行残存病灶鉴别、复发、淋巴结转移上仍存在一定局限性。正电子发射断层显像(PET)的显像机制是通过对分子水平的观察来表达肿瘤组织代谢特征,以代谢显像明确肿瘤的生物学特征,为肿瘤的诊断、分期、优化治疗提供高价值影像学

图1 为18F-FDG+PET/CT图、
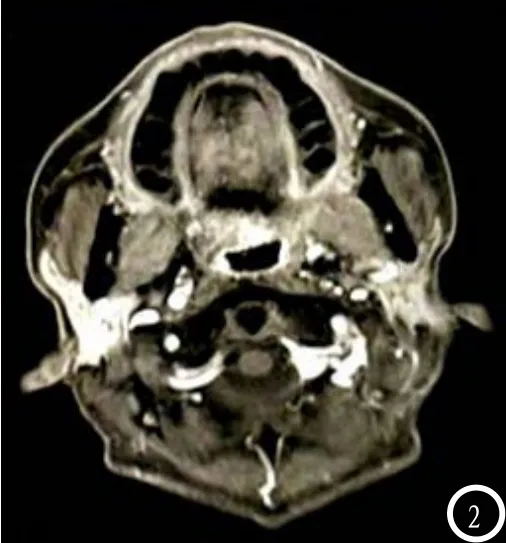
图2 为MRI图。

图3 为18F-FDG+PET/CT图、
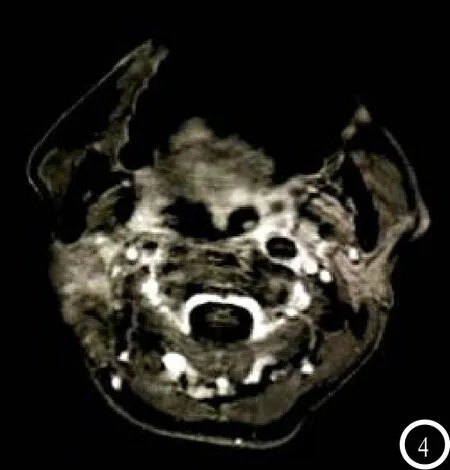
图4 为MRI图。
4资料[6]。而本研究亦显示,18FDG PET-CT在残余肿瘤、阳性淋巴结诊断与金标准均存在良好的一致性,较MRI而言,其在诊断残存肿瘤时的准确率、特异度、敏感度更具优势,这与黄蓉等[7]的报道相符。但本研究也发现,在淋巴结方面,虽PET/CT具一定优势,但两者阳性预测值均相对较低,分析可能受术后病灶周围组织、肌肉等生理性摄取增高的干扰,加之术后纤维瘢痕的形成、淋巴结短径微小或形态改变,故造成对两种检查方式在淋巴结阳性诊断上均一定局限性。
同时,精确放疗作为口咽癌患者术后主要治疗方案,其优势主要体现在对靶区照射剂量的准确评估,而如何正确的勾勒靶区是实施精确放疗的关键。常规CT扫描在密度、空间分辨能力上具一定优势,临床认为常规CT扫描是模拟定位及制定放疗技术的最佳方法,但CT对软组织的结构区分能力相对较差,临床为提升CT模拟定位的准确率,精确靶区勾画,通常结合MRI、PET/CT检查来达到目的[8]。但MRI在评价肿瘤组织良恶性时,主要是依据病灶形态、大小、信号及强化程度,但头颈部肿瘤术后残存病灶多存在周围水肿及炎症反应,导致其难以与正常组织区分,因此,影像学医师在进行靶区勾画时,为避免遗漏病灶,常凭经验扩大靶区,将肿瘤边界不清晰的正常组织或水肿、炎性组织均勾画为肿瘤大体靶区体积[9]。同时,DWI对组织生理学早期改变的评价标准主要是通过分子水平反应组织细胞中含水量的变化来判断,并认为ADC越低,分化程度越差,淋巴结分期越晚,但有研究表明,局部控制区ADC在精确放疗前后并未见显著差异,并认为ADC值在精确放射疗效评估上不具特异性。而PET/CT则主要是通过观察肿瘤细胞对葡萄糖的代谢水平来评价肿瘤组织的良恶性,SUV值是18FDG PET-CT用以半定量评价肿瘤组织代谢程度的标志性指标,其水平的高低与肿瘤分化程度、分期具密切关联性[10]。有研究表明[11],SUV值越高,瘤体恶化程度越高,预后越差,SUV值不仅可发挥预测肿瘤患者预后的作用,其治疗前后的差异也可用以评价疗效,这在本研究也得以体现。
综上所述:18F-FDG+PET/CT与MRI在口咽鳞癌术后精确放射治疗中均具一定应用价值,但18FFDG+PET/CT优势更显著。
