猪繁殖与呼吸综合征弱毒活疫苗免疫猪脾脏转移因子的制备及其活性分析
2018-08-07郭海勇袁洪兴孙泰然宋勤叶李潭清逯纪成
郭海勇,袁洪兴,孙泰然,曹 静,宋勤叶*,李潭清,逯纪成
(1.吉林师范大学 生命科学学院,四平 136000;2.河北农业大学 动物医学院 河北省兽用生物制品工程技术研究中心,保定 071001; 3.河北省保定市动物疫病预防控制中心,保定 071000)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的猪繁殖与呼吸综合征(PRRS)是导致母猪流产、产死胎和木乃伊胎儿、不孕等繁殖障碍,哺乳仔猪呼吸系统疾病、大量死亡,生长猪呼吸道疾病频发、成活率降低的重要传染病,严重威胁着全球养猪业的健康发展[1-4]。PRRS于1987年首次在北美暴发流行[5],1996年我国首次报道此病并分离到病毒[6],2006年由PRRSV变异株引起的高致病性PRRSV(highly pathogenic PRRSV, HP-PRRSV)在国内各地猪场广泛流行,给我国养猪业造成了巨大经济损失[1,7]。
PRRSV主要感染宿主的单核/巨噬细胞,损害机体免疫功能,引起Ⅰ型干扰素(IFN-α/β)和IFN-γ的表达水平下降[8-12]。此外,PRRSV虽然在感染早期可以诱导机体产生特异性抗体,但是该抗体无抑制或中和病毒作用,而直到感染4周后才能够检测到高亲和力的病毒中和抗体[2,13]。PRRSV感染引起的免疫功能抑制和低水平中和抗体导致病毒在宿主体内持续性存在,出现抗体依赖性增强作用(antibody-dependent enhancement, ADE)感染免疫特征[2-4,13-14]。转移因子(transfer factor,TF)于1954年首次发现和报道,是具有免疫活性的T淋巴细胞产生的一类可透析的小分子物质,其相对分子质量<5 ku,是由核酸和多肽相连而成的杂合分子[15-16]。TF能特异性地将供体的细胞免疫功能转移给受体,具有激发免疫细胞活性、调节免疫功能、增强机体特异性和非特异性细胞免疫功能等作用,并且无热原和抗原性,不引起过敏反应,无明显毒副作用和种属特异性,其对于恶性肿瘤性疾病、免疫缺陷性疾病以及病毒、细菌和寄生虫等引起的感染性疾病具有良好辅助治疗和预防效果[15-18]。李士学等[19]从PRRSV灭活疫苗免疫猪和非免疫猪的脾分别提取了TF,发现从免疫猪提取的TF对小鼠外周血淋巴细胞(peripheral blood lymphocyte,PBLC)转化能力的增强作用更高。但该研究未报道所制备转移因子的成分,也未对猪免疫细胞的增强作用进行深入研究。PRRSV侵害机体免疫细胞,引起机体免疫功能抑制,且目前PRRSV疫苗免疫效果不理想,研发能够改善机体免疫力和增强疫苗免疫效果的免疫增强剂具有现实意义。TF可以调节和改善机体细胞免疫功能,是一种应用前景广阔的免疫调节剂。本研究从PRRSV弱毒活疫苗免疫猪的脾中提取TF,分析其成分及免疫活性,旨在为改善PRRSV疫苗的免疫效果和新型免疫增强剂的研发奠定理论基础。
1 材料与方法
1.1 疫苗与主要试剂
PRRSV弱毒活疫苗,购自吉林省元亨生物技术有限公司;淋巴细胞分离液(密度为1.077 g·mL-1),购自北京Solarbio公司;无酚红RPMI 1640细胞培养基础液、噻唑蓝(MTT)及 ConA,均为美国Promega 公司产品。PRRSV抗体检测试剂盒,为美国IDEXX公司产品。
1.2 动物
4周龄和3月龄健康非免疫猪(杜洛克×长白× 大约克夏三元杂交),购自河北保定某规模化猪场。6~8周龄SPF BALB/c小鼠,购自河北医科大学。
1.3 TF的制备
给2头3月龄猪肌内注射PRRSV弱毒疫苗,以每头猪3头份剂量连续接种4次;第4次免疫10 d 后,采取前腔静脉血,分离血清;按照ELISA检测试剂盒说明,检测PRRSV抗体。当特异抗体水平合格(S/N值在1.5左右),用2.5%戊巴比妥钠麻醉后,无菌采取猪的脾,去除被膜和结缔组织,用无菌生理盐水冲洗3次,称重,剪碎;加入适量无菌生理盐水,制成匀浆;经冻融—透析后,收集透析外液,过滤除菌后分装,-20 ℃保存备用。
1.4 理化性质及主要成分检测
观察TF的颜色及有无沉淀物产生,嗅其气味,测定pH值。应用磺基水杨酸法,检测TF中是否含有蛋白质;通过茚三酮反应和硝酸—钼酸铵试验,分别检测TF中的氨基酸和核酸成分;用紫外分光光度计测量波长为260 nm和280 nm的光密度吸收(OD)值,计算OD260 nm/OD280 nm值,当OD260 nm/OD280 nm>2.0时,表示制备的TF合格。
1.5 氨基酸种类及含量的测定
取1 mL样品加入9 mL 6.0 mol·L-1的盐酸,110 ℃下水解14 h,冷却至室温;取水解液5 mL真空抽干,加入0.1 mol·L-1的盐酸1.0 mL溶解后,经过氨基酸衍生,用高效液相色谱仪(Agilent 1200)检测TF中的氨基酸组成及其含量。
1.6 免疫活性检测
1.6.1 巨噬细胞吞噬率的检测 取BALB/c小鼠随机分为试验组和对照组,每组6只。试验组每只小鼠腹腔注射1 mL TF;对照组每只小鼠腹腔注射等体积的生理盐水。每隔24 h注射一次,连续注射5次。参照文献[20]所述方法,采取腹腔液,滴于载玻片上,经姬姆萨染色后,显微镜下计数吞噬红细胞的巨噬细胞数,计算吞噬率。吞噬率(%)=吞噬鸡红细胞的巨噬细胞数/200个巨噬细胞×100%。
1.6.2 小鼠外周血淋巴细胞增殖试验 采集3只6~8 周龄BALB/c小鼠眼球血,分离PBLC,用适量含10%小牛血清无酚红的RPMI 1640细胞培养液悬浮。经1%台盼蓝染色,显微镜下检测PBLC的活性>95%时,计数,调整细胞浓度为4×106个·mL-1;将100 μL细胞悬液加到96孔细胞培养板的相应各孔内,每个样品重复3孔,每孔用2.78 μg TF刺激,于37 ℃ 5% CO2培养箱中培养48 h。同时设立ConA(终浓度为10 μg·孔-1)阳性和生理盐水阴性对照孔。每孔加入10 μL MTT溶液(5 μg·μL-1), 混匀,于37 ℃ 5% CO2条件下培养4 h;每孔加入100 μL 10% SDS-0.01 mol·L-1盐酸,混匀后于37 ℃作用30 min;消除孔内气泡,测定OD570 nm光密度值,计算各组淋巴细胞的刺激指数(stimulating index,SI)。SI=(刺激孔OD值-营养液对照孔的OD值)/(不刺激的阴性对照孔的OD值-营养液对照孔的OD值)。
1.6.3 PRRSV弱毒疫苗-TF免疫猪外周血淋巴细胞增殖试验 将4 周龄健康仔猪随机分为A、B、C组,每组3头。A组:每头猪左、右侧耳后分别肌内注射1头份PRRSV弱毒疫苗和1 mL TF;B组:每头猪注射1头份PRRSV弱毒疫苗和1 mL TF的混合液;C组:每头猪注射1头份PRRSV弱毒疫苗和1 mL生理盐水混合液。免疫前0 d和免疫后20 d ,经前腔静脉采血,分离外周血淋巴细胞,应用MTT法检测淋巴细胞增殖活性。MTT试验方法及SI的计算方法同“1.6.2”。
1.7 数据统计分析
应用 SPSS 软件对试验数据进行统计学分析,用成对样本T-test方法检验不同组的吞噬细胞吞噬率以及小鼠外周血淋巴细胞SI的差异,用Two-way ANOVA方法检验不同组的猪外周血淋巴细胞SI的差异。当P<0. 05 时,差异显著;P<0. 01 时,差异极显著。
2 结 果
2.1 理化性质及主要成分
制备的TF呈淡黄色的澄清液体,有微弱的腥味,pH值为6.44;与20%磺基水杨酸反应无沉淀生成,与茚三酮反应溶液呈蓝紫色,说明TF溶液中无蛋白质成分,但含有氨基酸;与硝酸-钼酸铵反应有黄色沉淀生成,生理盐水对照无沉淀生成,表明TF溶液内含有PO43-。紫外分光光度计测定的OD260 nm和OD280 nm的平均值分别为0.430和0.155,OD260 nm/OD280 nm值为2.77,核酸的含量为21.5 μg·mL-1。
2.2 氨基酸种类及其含量
经高效液相色谱仪分析可知,制备的TF含有18种氨基酸(图1和表1)。其中谷氨酸的含量最高,为0.642 mg·mL-1,其次为非蛋白氨基酸——牛磺酸,含量为0.298 mg·mL-1,此后依次为甘氨酸、脯氨酸、丝氨酸等,每毫升TF中含氨基酸总量为3.479 mg。

图1 TF氨基酸组成的高效液相色谱分析Fig.1 The amino acid composition analysis of TF by high performance liquid chromatography
2.3 TF可以增强小鼠腹腔巨噬细胞的吞噬活性
显微镜下计数200个细胞,计算腹腔巨噬细胞对鸡红细胞吞噬率。注射TF组的小鼠腹腔巨噬细胞对鸡红细胞的吞噬率为54.48%,注射生理盐水对照组的吞噬率为39.73%,两组间差异极显著(P<0.01) (图2),表明TF能显著增强小鼠腹腔巨噬细胞的吞噬活性。
2.4 TF能够提高小鼠PBLC的增殖能力
用制备的TF和ConA分别刺激小鼠PBLC 48 h后,通过MTT法检测各组淋巴细胞增殖活性,发现TF和ConA刺激组的PBLC增殖的SI均显著高于阴性对照组的SI (P<0.05),并且TF刺激细胞的增殖活性显著高于ConA刺激细胞(P<0.05)(图3)。该结果表明TF能够显著提高PBLC的增殖活性(图3)。
2.5 TF改善了PRRSV疫苗免疫猪PBLC的增殖活性
用PRRSV弱毒疫苗-TF免疫仔猪后20 d,通过MTT法检测PBLC的增殖活性。同时在不同部位注射PRRSV弱毒疫苗和TF组(A组)及接种PRRSV弱毒疫苗与PRRSV-TF混合液组(B组)的PBLC刺激指数分别为2.83±0.32和2.95±0.38,均显著高于单独接种PRRSV弱毒疫苗组(C组)的SI(1.29±0.31)(P<0.01),但A组和B组间没有显著差异(图4)。结果表明,TF与PRRSV弱毒疫苗同时分别接种,或者TF与PRRSV弱毒疫苗混合注射,均能够显著改善猪的细胞免疫功能。
表1TF中氨基酸的种类及其含量
Table1KindsandcontentsofaminoacidsintheTF

氨基酸类别Kinds of amino acids含量/(mg·mL-1)Contents 天冬氨酸 Asp0.246谷氨酸 Glu0.642组氨酸 His0.065丝氨酸 Ser0.251精氨酸 Arg0.194甘氨酸 Gly0.274苏氨酸 Thr0.144脯氨酸 Pro0.253丙氨酸 Ala0.195缬氨酸 Val0.152甲硫氨酸 Met0.061半胱氨酸 Cys0.070异亮氨酸 Ile0.129亮氨酸 Leu0.212苯丙氨酸 Phe0.119赖氨酸 Lys0.086酪氨酸 Tyr0.087牛磺酸 Tau0.298

**. P<0. 01,两组间差异极显著**. P<0. 01, mean significant differences between two groups图2 小鼠腹腔巨噬细胞的吞噬活性Fig.2 Phagocytic activity of mice celiac macrophagocytes
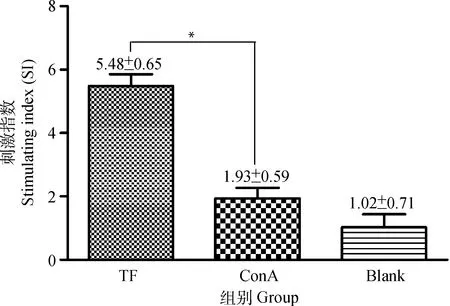
*. P<0.05,两组间差异显著*. P<0.05, mean significant differences between two groups图3 小鼠外周血淋巴细胞增殖活性Fig.3 Proliferation activities of mice PBLC
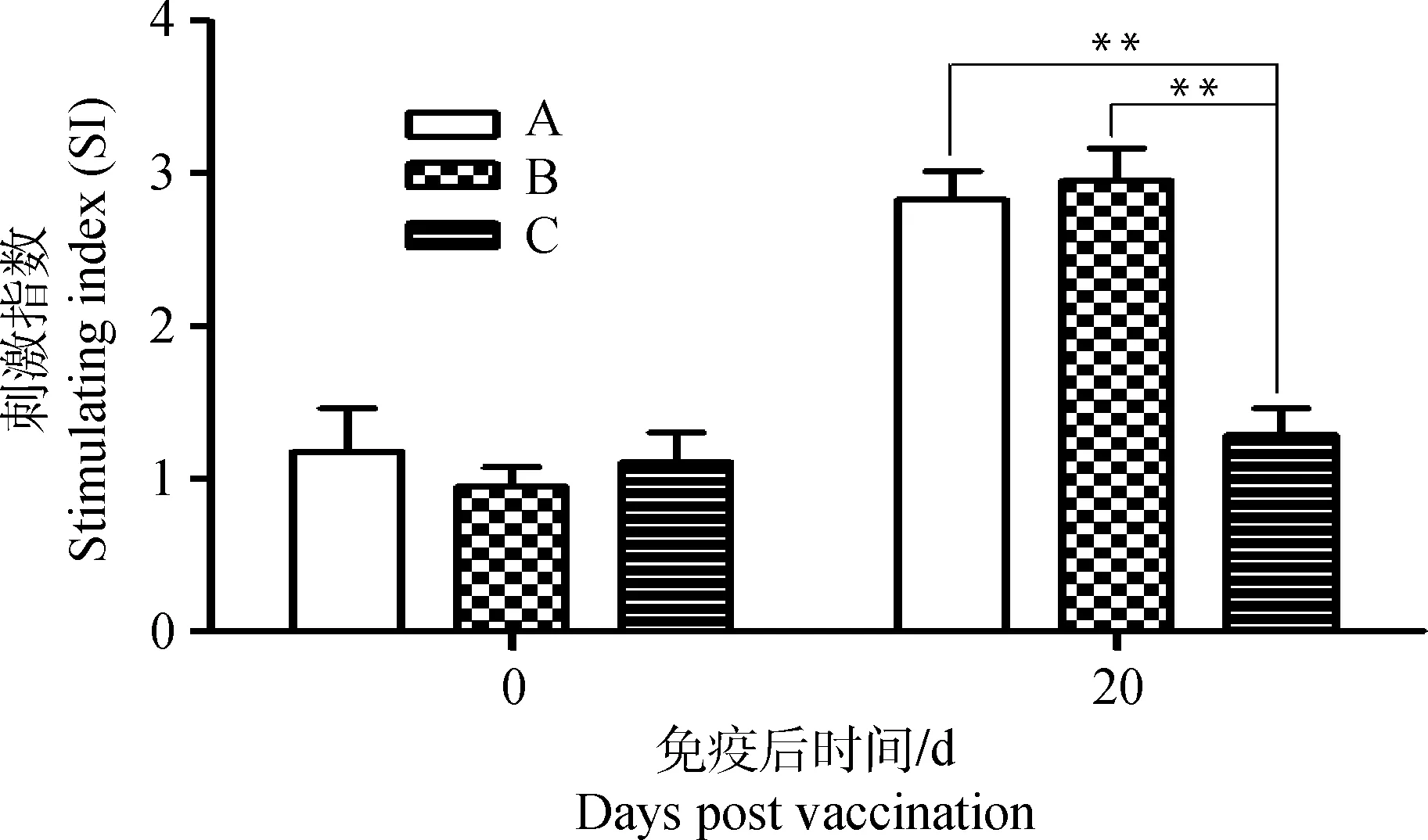
A. PRRSV疫苗与TF分开注射;B. PRRSV疫苗与TF混合液注射;C. PRRSV疫苗单独免疫。**. P<0. 01,两组间差异极显著A. Injecting PRRSV vaccine and TF separately; B. Injecting the mixture of PRRSV vaccine and TF; C. Injecting PRRSV vaccine only. **. P<0. 01, mean significant differences between two groups图4 免疫猪外周血淋巴细胞的增殖活性Fig.4 Proliferation activities of PBLC from immunized pigs
3 讨 论
PRRSV不仅可以引起妊娠母猪繁殖障碍和仔猪死亡,而且还可导致猪非特异性和特异性免疫功能抑制,致使PRRSV感染猪与其他病原混合感染及免疫失败现象屡屡发生[21-23]。因此,研究和开发改善猪免疫功能和提高疫苗免疫效果的免疫增强制剂具有重要意义。转移因子因具备传递免疫信息、调节和增强机体免疫功能等优势,已经被广泛用于肿瘤、传染病、寄生虫病、过敏和自身免疫性疾病的防治研究与实践中[16,19,24-25]。用某种抗原免疫人或动物制备的TF对相应疾病的治疗效果更好[19,26],目前临床上用于治疗乙型肝炎病毒、疱疹病毒、巨细胞病毒、艾滋病病毒和寄生虫等疫病及肿瘤的转移因子多是从用特异抗原免疫机体提取的TF[16]。本研究从PRRSV弱毒活疫苗强化免疫猪的脾内提取了TF,该TF由核酸和至少18种氨基酸组成,比孔庆波等[27]从猪脾提取的TF多了一种牛磺酸,说明从不同免疫原免疫动物组织提取的转移因子的组成成分可能不完全一致。值得注意的是,牛磺酸为非蛋白氨基酸,不参与蛋白的生物合成,但与胱氨酸、半胱氨酸的代谢密切相关,具有维持正常生殖功能,提高机体免疫力等生物学功能。而且本研究中制备的TF中牛磺酸的含量仅次于含量最高的谷氨酸,推测其很可能在调节PRRSV感染机体免疫功能与改善免疫效果方面发挥着较重要的作用。
巨噬细胞和树突状细胞等单核/巨噬细胞系是PRRSV的靶细胞。PRRSV能够在猪肺泡巨噬细胞内复制,抑制细胞的吞噬功能以及Ⅰ型干扰素(IFN-α/β)和IFN-γ的表达,同时PRRSV感染引起淋巴细胞总数降低、CD4+与CD8+T细胞总数的比值下降,致使机体免疫功能抑制或紊乱,不能及时清除体内病毒[2,4,22,28-29]。本试验发现从PRRS弱毒活疫苗免疫猪的脾中提取的TF能够显著提高小鼠腹腔巨噬细胞的吞噬功能,说明其可以改善巨噬细胞的免疫功能。该TF是否会影响宿主Ⅰ型干扰素(IFN-α/β)和IFN-γ的表达以及CD4+与CD8+T细胞总数的比值,将进一步通过动物试验加以验证。
PRRSV感染猪4~6周后,才可以检测到高亲和力的特异性中和抗体IgG,而此前病毒诱导产生的抗体不能中和体内病毒,并且还发现即使在中和抗体存在的条件下,PRRS病毒血症可以持续存在[30-32]。这些现象提示在机体抗PRRSV感染免疫中,细胞免疫可能发挥着重要作用。因此,提高细胞免疫功能对于控制病毒感染具有重要作用。本研究中,TF能够同时显著增强小鼠和PRRSV弱毒疫苗免疫猪外周血淋巴细胞的增殖活性,但对免疫猪的特异抗体水平没有明显提高作用(数据未在本文显示),表明制备的TF主要改善细胞免疫功能,与文献报道的转移因子主要表现细胞免疫调节活性相同[16,24,26]。从PRRSV弱毒活疫苗免疫猪脾中提取的TF具有提高细胞免疫功能的调节活性,可能有助于机体对PRRSV的清除,缩短病毒血症的持续时间。同时提示该TF与疫苗的联合应用对阻止或降低免疫机体被野毒感染具有重要意义。
4 结 论
从猪繁殖与呼吸综合征弱毒活疫苗免疫猪的脾中提取了转移因子,其含有核酸和18种氨基酸,不含蛋白质。该转移因子能显著提高小鼠巨噬细胞的吞噬功能和小鼠外周血淋巴细胞的增殖能力,改善PRRSV疫苗免疫猪的细胞免疫功能。
