NaN3和紫外线复合诱变对苜蓿愈伤组织在干旱和盐胁迫下生长的影响
2018-08-07邬婷婷陈雪梅
李 波,林 浩,邬婷婷,陈雪梅
(齐齐哈尔大学生命科学与农林学院,抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006)
苜蓿(MedicagosativaL.)是多年生的豆科类草本植物,具有产量高、营养价值高的特性,被世界公认为优质牧草之一[1]。由于近几年环境干旱和土地盐渍化的加剧,导致紫花苜蓿的种植面积逐年减少, 严重威胁其产量,因此,亟待加强培育抗逆性强的苜蓿新品种,以丰富我国匮乏的苜蓿种质资源。
植物耐盐和抗旱机制是错综复杂的, 耐盐和抗旱性状是受多基因控制的, 涉及多种生理代谢途径。为了获得抗逆性强的苜蓿新品种,评价耐盐和抗旱突变材料生理生化功能上的差别,采用理化诱变因素复合处理的方法开展耐逆紫花苜蓿研究,以期获得优良农艺性状的新种质材料,对紫花苜蓿耐盐和抗旱育种及生理机制研究有一定参考价值,有利于丰富我国苜蓿的品种资源,推动苜蓿产业化发展。
1 材料与方法
1.1 试验材料
以图牧2号苜蓿无菌苗的下胚轴诱导出的愈伤组织为材料,由齐齐哈尔大学植物组织培养研究室提供。
1.2 试验方法
1.2.1 愈伤组织的继代培养 将淡黄色、松嫩的愈伤组织切割成0.5 cm3左右的小块,转接到继代培养基中,继代2~3次的愈伤组织即可作为诱变和胁迫的材料。继代培养基为MS+2,4-D 1 mg·L-1+ 6-BA 0.5 mg·L-1+ 30 g蔗糖+8.5 g琼脂(pH=5.8)。
1.2.2 NaN3和紫外线诱变半致死浓度(剂量)选择 用磷酸缓冲液(pH=7.0,0.2 M)配置浓度为1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0×10-3mol·L-1和5.5×10-3mol·L-1的NaN3溶液,将愈伤组织置于NaN3溶液中,低速摇床震荡4 h后无菌水冲洗3次,愈伤组织转接在继代培养基,每个梯度约120块愈伤组织(每块约0.5 cm3),25℃恒温培养箱中培养25 d。
选取30 W的紫外灯管,以20 cm的距离和不同的照射时间(2、3、4、5、6、7 min和8 min)为紫外线的诱变剂量,每个梯度处理约90块愈伤组织,避光黑暗25℃恒温培养箱中培养25 d。
1.2.3 NaCl和PEG胁迫致死浓度的筛选 将愈伤组织切割成0.5 cm3左右小块,接种在含有不同浓度的PEG-6000液体培养基中,PEG胁迫的浓度梯度为0%、15%、20%、25%和30%,每个梯度处理约90块愈伤组织,25℃恒温培养箱中培养,分别在2、4、6、8 d和10 d将其转接到MS固体培养基中培养。
将愈伤组织切割成0.5 cm3左右小块,转接至NaCl梯度培养基中(NaCl浓度为0.5%、1.0%、1.5%和2.0%),每种盐浓度处理约90块愈伤组织,25℃的恒温培养箱中培养12 d。
1.2.4 复合诱变后愈伤组织的干旱、盐胁迫 将复合诱变处理后生长良好的愈伤组织转接在含NaCl和PEG的致死浓度培养基中,分别胁迫处理8 d和10 d,存活的愈伤组织继代培养。继代两次后,将NaCl处理的部分愈伤组织转入含PEG的致死培养基中,进行胁迫处理10 d,存活的愈伤组织继代培养。
1.2.5 生理生化指标的测定 游离脯氨酸含量测定采用茚三酮法,丙二醛(MDA)含量测定采用硫代巴比妥酸法,可溶性糖含量的测定采用蒽酮法,过氧化氢酶活性(CAT)测定采用紫外吸收法。
1.3 愈伤组织存活率和愈伤组织致死率的测定
愈伤组织存活率(%)=愈伤组织存活(块)数/接种愈伤组织总(块)数×100%
愈伤组织的致死率(%)=愈伤组织死亡(块)数/接种愈伤组织总(块)数×100%
1.4 数据处理与分析
利用统计分析软件Execl 2003、SPSS 17.0对所测定的各项生理指标的数据进行方差分析,比较各项生理指标变化的差异及显著性。
2 结果与分析
2.1 NaN3和紫外线诱变对愈伤组织生长的影响
2.1.1 NaN3诱变 苜蓿愈伤组织对NaN3诱变剂比较敏感,经过不同浓度的NaN3诱变后,其生长受到显著的影响(见图1),表现出随NaN3浓度的增加,愈伤组织受损伤程度加重,其生活力明显降低,愈伤组织色泽由淡黄色转变为黄褐色,甚至为褐色。NaN3浓度与愈伤组织存活率间呈负相关性(见表1),在诱变后培养初期(前5 d)愈伤组织无明显变化,第10天左右随着NaN3浓度的增加愈伤组织逐渐褐化死亡。培养至25 d时,随着NaN3诱变浓度的增加,愈伤组织的致死率增加,4.0×10-3mol·L-1NaN3处理组的致死率为50.83%,此浓度为NaN3的LG50,NaN3浓度为5.5×10-3mol·L-1处理组致死率为95.83%,此浓度为NaN3的LC100,LC50为愈伤组织死亡近一半的NaN3浓度,LC100为愈伤组织近全部死亡的NaN3浓度。
2.1.2 紫外线诱变 苜蓿愈伤组织经过不同剂量紫外线诱变后,其生长状态受到一定的影响(见图2),表现出随紫外线剂量的增加,愈伤组织存活率逐渐下降。在诱变初期(前5 d)愈伤组织无明显变化,第10天左右随着紫外线辐射剂量的增加愈伤组织逐渐褐化死亡(见表2),随着培养时间的推移,各诱变处理组死亡率提高。处理时间大于6 min,愈伤组织表现为生活力明显降低,色泽由淡黄色转变为黄褐色,甚至成为褐色,存活率大大下降。紫外线辐射与愈伤组织存活率呈负相关,愈伤组织培养至25 d时,随着紫外线诱变剂量的增加,愈伤组织的致死率逐渐增加,6 min处理组的致死率为51.11%,此剂量为紫外线的LC50,8 min处理组致死率达到96.67%,此剂量为紫外线的LD100。
2.1.3 复合诱变下苜蓿愈伤组织生长状况 苜蓿愈伤组织经过复合诱变处理后,其生长状况受到明显的抑制,愈伤组织存活率降低(见图3)。复合诱变处理前6 d愈伤组织颜色变淡,没有生长活力,培养至15 d左右,部分愈伤组织开始缓慢恢复生长(见图4),20 d时部分存活下来逐渐生长,当培养至25 d时,愈伤组织颜色逐渐转为淡绿色,旺盛生长。
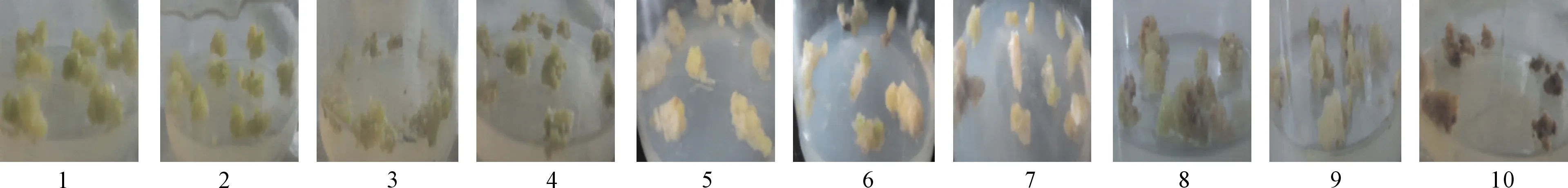
注:1~10为NaN3浓度为0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5×10-3 mol·L-1的愈伤组织。Notes:1~10 was callus under NaN3concentration of 0, 1.5, 2.0, 2.5, 3.0, 3.5, 4.0, 4.5, 5.0, 5.5×10-3 mol·L-1.图1 不同浓度NaN3诱变苜蓿愈伤组织Fig1 Alfalfa callus induced by different concentrations of NaN3

表1 NaN3诱变苜蓿愈伤组织生长状况Table 1 The growth status of alfalfa callus induced by NaN3 mutagenesis

注:1~8为紫外线照射不同时间(0,2,3,4,5,6,7 min和8 min)苜蓿愈伤组织。Notes:1~8 was callus of UV irradiation for different time( 0,2,3,4,5,6,7 min and 8 min).图2 紫外线辐射苜蓿愈伤组织Fig 2 Alfalfa callus under ultraviolet radiation

表2 紫外线辐射苜蓿愈伤组织生长状况Table 2 Growth status of alfalfa callus after ultraviolet radiation
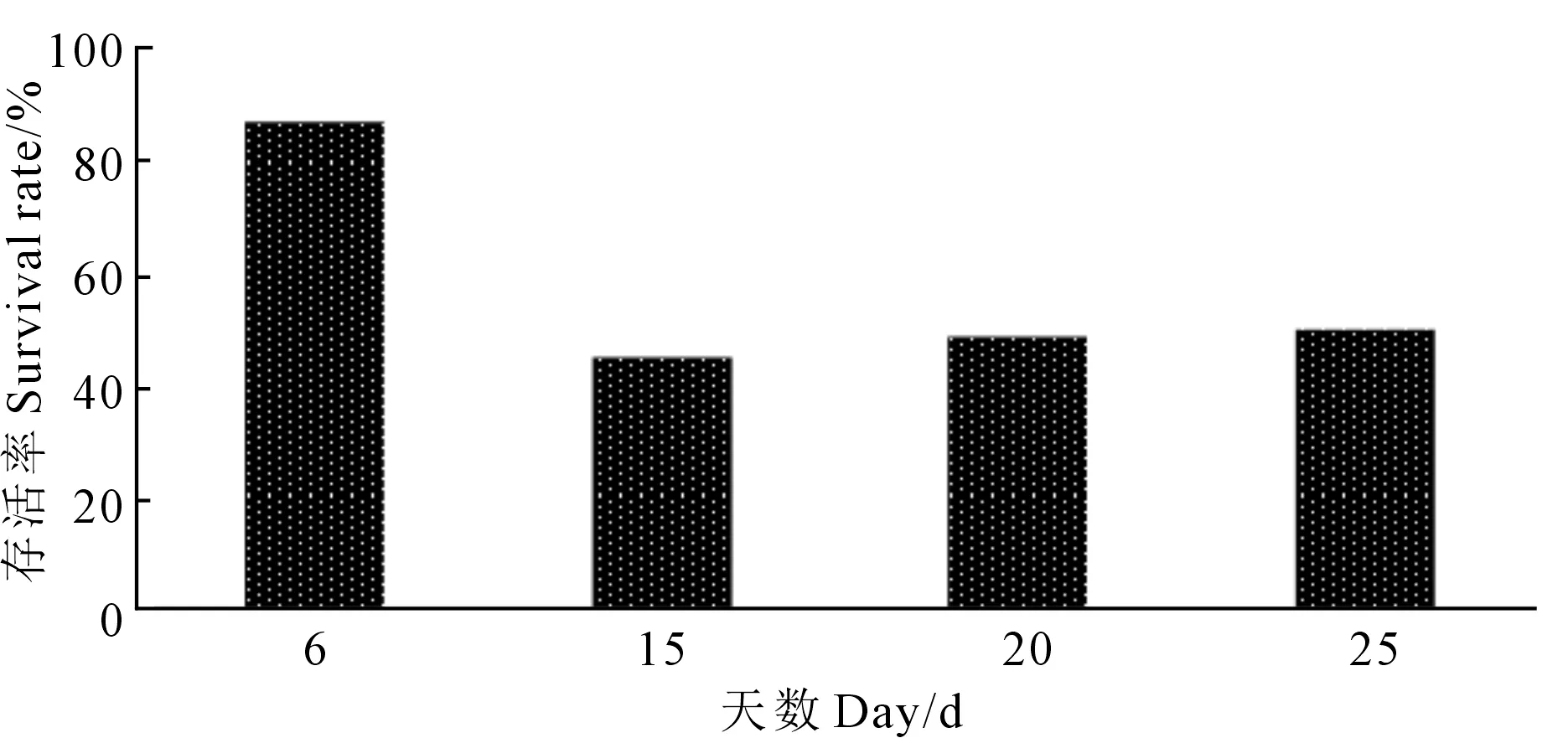
图3 复合诱变愈伤组织的存活率Fig.3 The survival rate of callus by hybrid mutagenesis

图4 复合诱变苜蓿愈伤组织Fig.4 Alfalfa callus by hybrid mutagenesis

图5 NaCl胁迫下愈伤组织的存活率Fig.5 The survival rate of callus under NaCl stress
2.2 NaCl和PEG胁迫对愈伤组织存活率和生长状况的影响
NaCl胁迫下苜蓿愈伤组织存活率的变化见图5,生长状况见图6。随着盐浓度的增加和处理时间的增加苜蓿愈伤组织的存活率逐渐降低,在NaCl胁迫处理10 d和浓度为1.0%时、8 d和浓度1.5%时,愈伤组织存活率分别为53.96%、54.31%,均达到NaCl的LC50,在NaCl胁迫处理12 d和浓度为2.0%时,愈伤组织存活率达到最低,为17.45%,褐化率最高,此浓度为NaCl的LC100。
PEG胁迫苜蓿愈伤组织生长状况见图7,愈伤组织存活率的变化见图8。随着PEG浓度的增加及处理天数的增加苜蓿愈伤组织的存活率逐渐降低,在PEG胁迫6 d和浓度为25%时,存活率为48.10%,此浓度为PEG的LC50,在PEG胁迫10 d和浓度为30%时,其存活率最低,为3.80%,此浓度为PEG的LC100。
2.3 复合诱变对干旱和盐胁迫下苜蓿愈伤组织存活率的影响
复合诱变和混合高盐及干旱胁迫下苜蓿愈伤组织生长状况见图9,愈伤组织的存活率变化见图10。经复合诱变的PEG胁迫、复合诱变的NaCl胁迫、复合诱变的PEG和NaCl胁迫处理后的苜蓿愈伤组织,随着培养时间的增加其存活率下降,直到15~18 d时生长状态趋于稳定,经复合诱变的PEG和NaCl处理下的愈伤组织存活率最低,为16%。

注:1~5为0,0.5%,1.0%,1.5%和2%浓度NaCl处理的愈伤组织。Note:1~5 was callus under NaCl concentration of 0,0.5%,1.0%,1.5% and 2%.图6 NaCl胁迫下苜蓿的愈伤组织Fig. 6 Alfalfa callus under NaCl stress

注:1~5为0,15%,20%,25%和30%浓度PEG处理的愈伤组织。Notes:1~5 was callus under PEG concentration of 0,15%,20%,25% and 30%.图7 PEG胁迫下苜蓿的愈伤组织Fig.7 Alfalfa callus under PEG stress
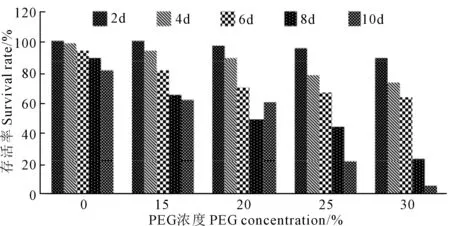
图8 PEG胁迫下愈伤组织的存活率Fig.8 Survival rate of callus under PEG stress

注:1.复合诱变(LC50)+PEG(LC100);2.复合诱变(LC50)+NaCl(LC100);3.复合诱变(LC50)+PEG(LC100)+NaCl(LC100)。Notes:1. hybrid induced(LC50)+PEG(LC100);2. hybrid induced (LC50)+NaCl(LC100);3. hybrid induced (LC50)+PEG(LC100)+NaCl(LC100).图9 复合诱变及盐和干旱胁迫下苜蓿愈伤组织Fig.9 Alfalfa callus under hybrid mutagenesis and stress of salt and drought
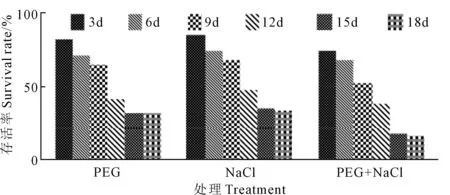
图10 复合诱变及盐和干旱胁迫下愈伤组织的存活率Fig.10 Survival rate of callus under hybrid mutagenesis and stress of salt and drought
2.4 诱变和胁迫处理苜蓿愈伤组织的生理变化
经胁迫和诱变苜蓿愈伤组织的脯氨酸、可溶性糖、丙二醛的含量及CAT酶活性的变化见表3,胁迫和诱变处理与对照比较提高了脯氨酸、可溶性糖和CAT酶活性,降低了丙二醛的含量。NaCl和PEG胁迫脯氨酸比对照增加了55.36%和41.88%,可溶性糖比对照增加了52.15%和37.12%,CAT酶活性比对照增加了7.58%和5.77%,丙二醛含量比对照降低了30.66%和25.23%。在三种诱变处理中,NaN3诱变后的脯氨酸、可溶性糖含量和CAT酶活性分别比对照增加了59.77%、77.91%和9.61%,丙二醛含量比对照降低了40.48%;紫外线诱变后的脯氨酸、可溶性糖含量和CAT酶活性分别比对照增加66.75%、105.83%和9.72%,丙二醛含量比对照降低了44.56%;NaN3+紫外线混合诱变后的脯氨酸、可溶性糖含量和CAT酶活性分别比对照增加155.31%、258.90%和21.14%,丙二醛含量比对照降低了64.20%。三种诱变方式中,混合诱变愈伤组织脯氨酸、可溶性糖及CAT酶活性均最高,丙二醛含量最低。在混合诱变中,NaCl、PEG和NaCl+PEG混合胁迫比较,NaCl+PEG混合胁迫愈伤组织脯氨酸、可溶性糖及CAT酶活性均最高,丙二醛含量最低,NaN3+紫外线混合诱变处理提高了苜蓿愈伤组织对盐和干旱的抵抗能力。

表3 诱变及干旱和盐胁迫下苜蓿愈伤组织的生理和生化指标的变化Table 3 Changes of physiological and biochemical indexes under mutagenesis and stress
注:不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)。
Note:Different letters indicate significant difference (P<0.05), and the same letters indicate no significant difference (P>0.05).
3 讨 论
3.1 复合诱变效应
单一因素虽能引起某些植物性状的突变,但诱变效果还不够理想,诱变谱也比较单纯,为了提高诱变育种效果,理化因素复合诱变处理受到广泛关注。由于射线改变了生物膜的完整性和渗透性,从而有助于化学诱变剂的吸收[4-6]。物理和化学因素的复合处理,可以产生累加效应,提高突变频率和诱变效果。多数试验证实了复合处理增加诱变效应的可能性。付凤玲等[8]用射线辐射和NaN3处理玉米愈伤组织,在含1.0% NaCl的高渗培养基上筛选,对再生植株株系进行耐盐性鉴定。结果表明,20 Gy的辐射和1 mmol·L-1NaN3是较为适合玉米愈伤组织诱变的处理组配,22个再生植株株系中有5个诱变株系的耐盐性高于未诱变对照。鹿巍[9]采用紫外线及化学诱变EMS的方法对小麦叶锈菌菌株05-5-46的单胞菌系进行诱变,得到的4株小麦叶锈菌突变菌株为新的致病类型。本研究发现不同的诱变处理方法,可以影响苜蓿愈伤组织的存活率,且在一定的NaN3和紫外线诱变下,存活的愈伤组织增加其对NaCl和PEG的抵抗能力,说明紫外线和NaN3复合诱变可提高苜蓿愈伤组织的诱变效应。
3.2 复合诱变对苜蓿愈伤组织生理和生化水平的影响
从脯氨酸、可溶性糖含量和CAT活性的变化来看,这三项指标变化情况一致,经复合诱变处理后,三项指标均有大幅度增加,说明理化复合诱变可以增强某些生理生化指标的含量,来提高机体的抵抗能力[10-11]。单一化学诱变处理或物理诱变使三项指标的含量均小幅上升,而丙二醛的含量经复合诱变处理含量的下降趋势也要高于单因素诱变,这说明理化复合诱变对苜蓿愈伤组织的影响较大,这可能与理化复合诱变的特性有关。
为了适应诱变后盐和干旱胁迫,植物体内存在的抗氧化酶系统包括过氧化物酶(POD)、过氧化氢酶(CAT)等可以缓解因逆境带来的伤害[12]。CAT酶是生物体内的主要抗氧化酶,它能促进细胞中过氧化氢的分解,减轻过氧化氢对细胞的损害,试验发现苜蓿愈伤组织经诱变胁迫处理后,特别是复合诱变+NaCl+PEG处理苜蓿愈伤组织CAT活性大大提高。
复合诱变+PEG+NaCl处理均高于紫外线+NaCl+PEG和NaN3+NaCl+PEG处理,表明复合诱变苜蓿愈伤组织的抗性比单一因素诱变愈伤组织的抗性强。理化复合诱变处理对苜蓿愈伤组织的影响较为复杂,但总体表现出理化复合诱变+PEG+NaCl处理对诱变起着主导性的作用,这说明理化复合诱变处理的诱变效果强于单因素诱变,能提高苜蓿愈伤组织的抗逆性,这可能与复合诱变处理的多方向性和不定向性有关。