实验兔非酒精性脂肪肝病的CT灌注成像研究
2018-08-07钟志伟曾庆思林翰菲叶永胜秦积龙宋玉全向之明
钟志伟 曾庆思 林翰菲 叶永胜 秦积龙宋玉全 向之明 邓 宇
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是除酒精及其他明确的损肝因素所致, 以肝细胞内脂肪堆积为主要特征的一组疾病,病理学变化为一连续的病变谱,由非酒精性肝脂肪变性(nonalcoholicfatty liver, NAFL)至非酒精性脂肪 肝 炎(nonalcoholic steatohepatitis, NASH),进一步发展后期甚至可演变为脂肪性肝硬化[1]。NAFLD目前已成为发达国家最常见的慢性肝脏疾病,约占10%~ 24%[2]。由于我国居民饮食结构的改变及生活水平的提高,该病的发生率也逐年提高,且呈低龄化趋势,流行病学数据表明,中国的香港、广州和上海等发达地区成人本病的患病率约为15%[3]。早期诊断并治疗NASH能有效改善肝纤维化,阻止其进一步向肝硬化发展,故而具有重要的临床意义[4]。
非酒精性脂肪肝病动物模型是探讨非酒精性脂肪肝的发病机理、评价诊断方法及寻找合理有效治疗药物的重要工具,在非酒精性脂肪肝病的研究中占有举足轻重的地位。故本研究通过对实验兔采用高脂高胆固醇饮食,复制与人类非酒精性脂肪肝病的病理生理学特点接近,且适合影像学研究的动物模型,并通过 CT灌注扫描(CT perfusion, CTP)结果与NAFLD病理半定量分析结果进行对照分析,探索CTP定量参数与NAFLD严重程度之间的相关性。
方 法
1. 实验动物
选用49只健康的雄性新西兰大白兔,6~ 8月龄,体重2.2~2.5kg。实验兔进入实验室后常规饲养1周,以适应实验室环境。实验室相对湿度40%~70%,温度控制在16°~26°之间,换气次数约8~10次/小时,昼夜明暗交替时间为12/12。兔均为单笼饲养,自由饮食、摄水。
2. NAFLD模型构建
将42只实验兔随机分配至5个实验组,分别为正常组10只、高脂饮食组4组,每组8只,分别为高脂4周组、高脂8周组 、高脂12周组和高脂16周组。另有补充组7只,高脂饮食组实验兔死亡时,随机抽取补充。正常组采用标准饮食,各高脂饮食组及补充组采用高脂饮食。高脂饲料为88%普通饲料+10%猪油+2%胆固醇混合制备而成[5-6]。
3. CT灌注成像
先行上腹部CT平扫,确定肝脏和脾脏位置,然后行肝脏CT灌注成像, 对比剂使用优维显(300 mgI/ml,先灵拜耳,德国),用量为1.5ml/kg,注射速率1 ml/s, 采用Dynamic 4D动态灌注扫描方案,对比剂注射后延迟2秒启动扫描。扫描范围为96mm,自膈顶到脾脏。扫描参数为80 kVp,100 mAs,采集模式为32×1.6 mm,重建层厚/层间距2 mm/0 mm,FOV 150mm,矩阵512×512,球管旋转时间为0.3秒,采集50个周期,每个周期扫描时间为1.5秒。
4. CT灌注图像处理及参数生成
将CT灌注成像数据传输至三维重建工作站处理SyngoMMWP(VE36A,Siemens,German), 处理软件包为VPCT Body。首先进行运动校正,然后计算生成参数图,分别为最大密度投影(maximum intensity projection, MIP),血流量(blood flow,BF),血容量(blood volume, BV),肝动脉灌注图(arterial liver perfusion, ALP),门静脉灌注图(portal venous liver perfusion, PVP),肝动脉灌注指数图(hepatic perfusion index, HPI)。分别在肝右外叶、肝右内叶、肝左内叶和肝左外叶放置一椭圆形ROI,大小约0.25cm2,尽量与磁共振测量的位置保持一致,测量并记录相应数据。
5. 病理学检查
CT检查完成后,经耳缘静脉空气栓塞处死实验兔。经腹腔取肝脏后固定行HE染色,以非酒精性脂肪肝病活动评分(NAFLD activity score,NAS)(0~8分)对实验兔肝脏的脂肪病变进行分级诊断研究,评价标准为中华肝脏病学会2010年的修订版非酒精性脂肪性肝病诊疗指南[3],具体见表1。
NAS<3分 则 可 以 排 除 NASH,NAS>4分可诊断为NASH,介于两者之间的为可能NASH(Borderline)。规定肝脂肪变>33%但不伴有小叶内炎症、气球样变和纤维化者为NAFL,肝脏脂肪变性达不到此程度者为简单的肝细胞脂肪变。
6. 统计学分析
统计学分析利用IBMSPSS统计软件(version 22.0,Chicago, IL, USA)及GraphPad Prism(version 6.01,San Diego, CA, USA)完成。计量资料均用±s形式表示,对方差齐的多样本采用完全随机设计的单因素方差分析(one-way ANOVA),方差不齐的多样本采用近似F检验Welch法。对多样本均数之间的比较,方差齐时采用LSD-t检验,方差不齐使用Duntte’s T3检验。P<0.05有统计学意义。
结 果
1.NAFLD成模情况
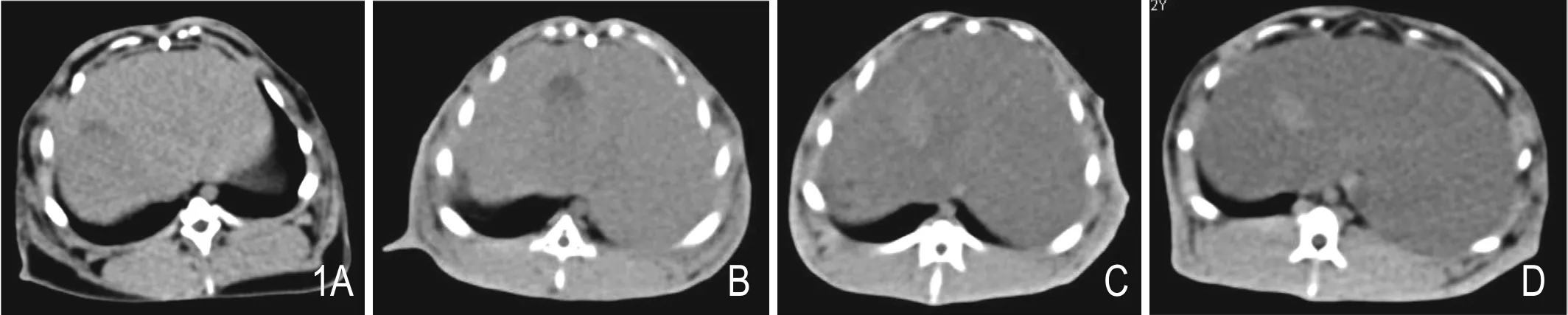
图1 正常实验兔及NAFLD的肝脏CT平扫。A. 正常实验兔的肝脏CT;B. 轻度脂肪肝的CT表现;C. 中度脂肪肝的CT表现;D. 重度脂肪肝的CT表现。
本研究高脂饮食组的实验兔全部发展为NAFLD,成模率为100%,根据NAS评分系统,正常组为9只, NAFL为0只,可疑NASH(Borderline组,NAS为3~4分)13只, NASH组(NAS>4分)19只 。
2.正常实验兔及NAFLD肝脏的CT平扫表现
正常对照组实验兔肝脏的CT表现为肝脏密度正常,与竖脊肌密度相当(图1A);高脂饮食组轻度脂肪肝者表现为肝密度略减低,密度低于竖脊肌,肝脏体积略增大(图1B);中度脂肪肝者表现为肝密度进一步降低,肝脏体积进一步增大(图1C);重度脂肪肝者表现为肝密度显著降低,明显低于竖脊肌,肝脏体积明显增大 (图1D)。
不同组间(正常对照组与Borderline组、NASH组)肝脏CT值、肝脏/竖脊肌CT比值差异有统计学意义(F值及Welch值分别为34.289和55.411,P值均为0.000),经用LSD或Duntte’s T3方法进行多重比较,各组间均差异有统计学意义,NASH组<Borderline组<正常对照组(P均<0.05)(表2)。
3. 正常实验兔及NAFLD肝脏的CT灌注表现及参数比较
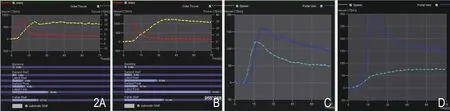
图2 CT灌注成像正常实验兔及NAFLD实验兔的肝动脉、门静脉、肝脏、脾脏时间-密度曲线。A.正常实验兔的肝动脉、肝脏时间-密度曲线;B.NAFLD组实验兔的肝动脉、肝脏时间-密度曲线;C.正常实验兔的门脉及脾脏时间-密度曲线;D.NAFLD组实验兔的门脉及脾脏时间-密度曲线(红色:肝动脉;黄色:肝实质;蓝色:门静脉;绿色:脾脏)。
CT灌注成像显示正常对照组的实验兔肝实质时间密度曲线(time density curve, TDC)呈速升平台型(图2A),NAFLD组肝实质强化峰值时间较正常组延长,肝实质时间密度曲线呈缓升平台型(图2B),正常对照组脾脏时间密度曲线呈速升缓降型(图2C),NAFLD组脾脏强化程度减低,时间密度曲线呈缓升平台型(图2D)。

表1 非酒精性脂肪肝病NAS评分标准
正常对照组实验兔肝脏以门静脉灌注为主,肝动脉灌注量较小,高脂饮食组实验兔肝脏的门静脉灌注量减低,肝动脉灌注量增加,肝动脉供血比增高。不同组间(正常对照组与Borderline组、NASH组)的ALP差异无统计学意义(F=0.858,P=0.432),BF、BV、PVP及HPI差异有统计学意义(Welch或 F 值分别为 5.113,6.733,9.107 和 41.160,P值分别为 0.017,0.003,0.002 和 0.000),经用 LSD或Duntte’s T3方法进行多重比较,Borderline组的BV较正常对照组减低(P<0.05),Borderline、NASH组的BF、PVP较正常对照组减低,HPI升高,差异均有统计学意义(P均<0.05),但Borderline组和NASH组的BF、BV、PVP、HPI差异均无统计学意义(P均>0.05)(表3)。
讨 论
国内外有很多研究在NAFLD的诊断和严重程度的评价,治疗方法等方面进行了评价。目前肝活检穿刺仍是诊断NAFLD和NASH的参考标准,但其为有创性检查方法,且采样时存在一定的误差,有可能影响分期的准确性或导致误诊,所以,该方法并不适用于所有患者[4,7-9]。此外,由于治疗NAFLD的关键在于减缓或者逆转肝脏纤维化的进程,因而评价患者的疗效非常重要,显然肝活检不是理想的随访检查方法[9]。
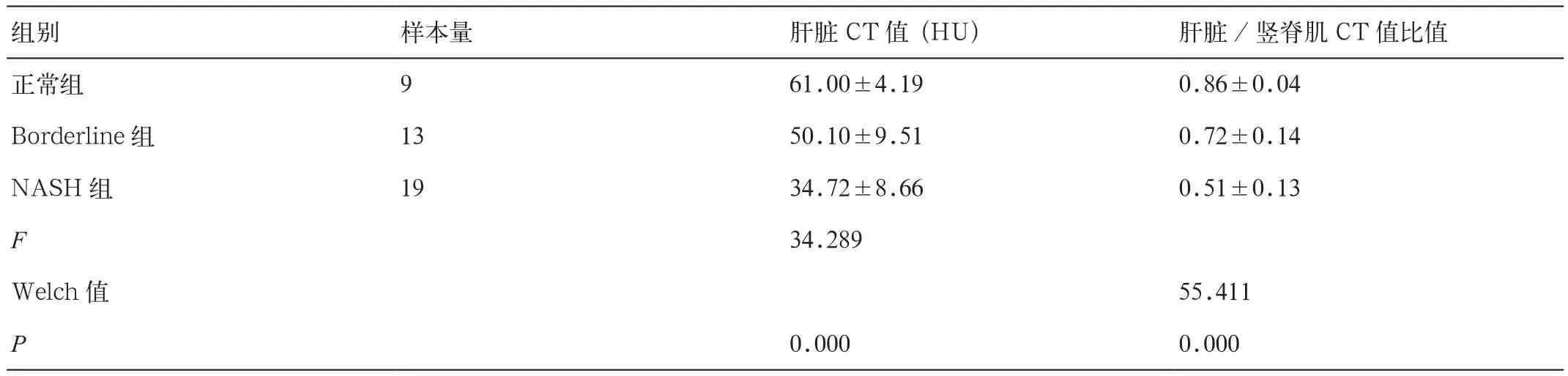
表2 正常组及Borderline组、NASH组的肝脏CT值及肝脏/竖脊肌CT比值的比较
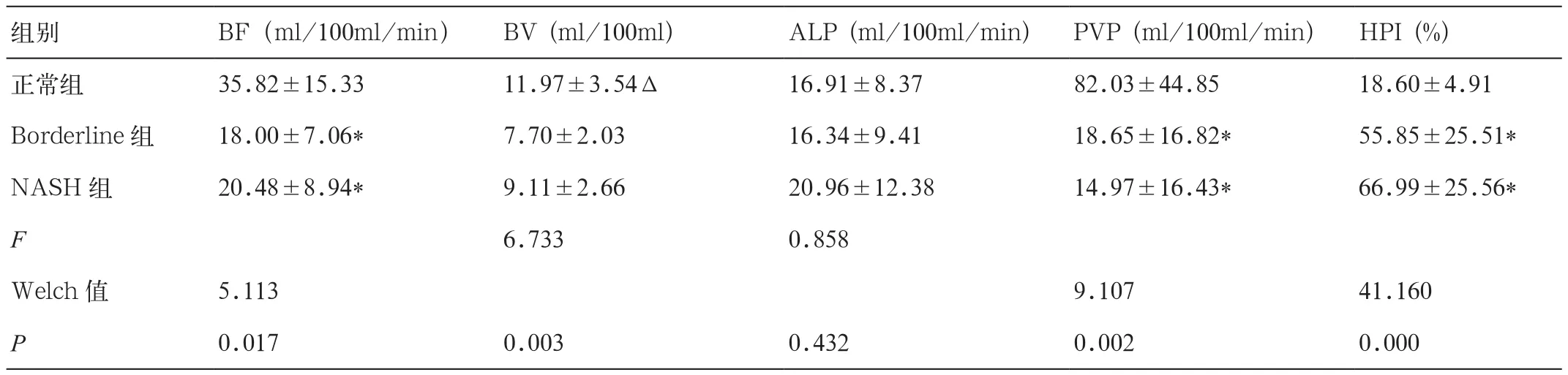
表3 正常组、Borderline组与NASH组实验兔的肝脏CTP参数比较
目前诊断脂肪肝的无创性检查手段很多,如临床生化指标、超声(ultrasonography, USG)、CT平扫、磁共振双回波(dual-echo in-phase and opposedphase,IP/OP)及磁共振波谱(MR spectroscopy,MRS)技术。
由于CT对组织的密度分辨率较高,也是脂肪肝定量评价的常用检查方法之一[10]。大量研究表明肝脏CT值或肝脾CT值的比值与肝脏脂肪含量有较高的相关性,提示CT是进行脂肪肝定量诊断的一种重要影像学方法。目前CT诊断脂肪肝的主要标准为肝脏密度普遍降低,肝脏/脾脏的CT值之比<1.0。肝脏/脾脏CT比值介于0.7和1.0之间者为轻度,介于0.5和0.7之间者为中度,>0.5者为重度脂肪肝[3]。
本研究的CT平扫结果显示实验兔肝脏的CT值和肝脏/竖脊肌CT值比值均表现为随高脂饮食时间或病变程度进行性下降,与文献报道的结果一致,尽管有学者[11]认为CT对肝脏轻度脂肪变性不敏感,不适合评价NAFLD,但本研究NAFLD模型组实验兔均可检测到肝脏CT值的变化,所以我们认为CT平扫可做为定量评价NAFLD中肝脏脂肪变性严重程度的检查方法之一。
肝脏CT灌注扫描主要应用于肝脏局灶性疾病如肝细胞癌的诊断,以及肿瘤治疗后的疗效评价[12-13]。也有研究发现,某些肝脏的局灶性病变或门静脉血栓等,也可出现肝脏一过性的区域性灌注异常。近年来,有学者开始将其应用于肝硬化等肝脏弥漫性疾病的诊断。CTP可显示肝脏血流动力学的改变,包括肝脏的血流灌注下降,肝动脉灌注指数增加,以及平均通过时间(mean trasnsimittion time, MTT)延长等[13]。其病理基础为正常肝小叶结构破坏,新生小叶结构紊乱、扭曲,肝实质内纤维化及结节再生,肝窦内皮细胞(sinusoidal endothelial cells, SEC)的失窗孔以及Disse腔胶原沉积等,使得肝血窦血流受阻,从而导致肝脏区域或整体灌注量下降[12-13]。HPI增加的可能机制是由于门静脉血流减少,肝动脉血流代偿性增加,即所谓的肝动脉缓冲效应( hepatic arterial buffer response, HABR)[14]。
目前,尚未见CTP应用于NAFLD的研究。首先,我们观察到,NAFLD模型组的肝脏实质及脾脏的TDC和正常对照组不同。正常对照组的肝实质TDC呈速升平台型,NAFLD模型组的肝实质TDC呈缓升平台型,爬升斜率变小,正常对照组的脾脏TDC与门静脉TDC平行,呈速升缓降型,而NAFLD脾脏的TDC低平呈缓升平台样改变,我们认为,这是由于NAFLD导致肝血窦狭窄后继发门静脉阻力增加,肝实质门脉灌注下降及脾静脉回流受阻。所以,肝、脾脏TDC的改变实际上间接反应了NAFLD所致门脉压力的升高。
我们的结果表明,NFALD的CTP参数出现了与肝硬化类似的变化,NFALD模型组的BF、BV均较正常对照组减低,提示肝脏微循环灌注及血池容量下降。PVP明显减低,而HPI明显增高则提示类似肝硬化的肝动脉缓冲效应。这一结果说明,尽管NAFLD的基本病理改变与肝硬化不同,但都会导致肝血窦受压、变窄,使肝脏血流动力学出现相似的改变,肝脏微循环灌注量减低。而肝脏微循环灌注减低必然影响各种物质包括脂肪在肝细胞内的代谢活动,反过来加重肝脏脂肪变性及炎症,两者互为因果,互相促进,导致肝脏病变进展。本研究中,尽管NAFLD模型组的ALP有较正常对照组升高的趋势,但是两组之间没有显著性差异,这可能与该参数的重复性较差有关 。此外,BF、BV、PVP和HPI在Borderline和NASH组之间差异没有统计学意义,提示CTP参数在判断NAFLD病变严重程度上欠佳。
实际上,已有学者认识到NAFLD可能会导致肝脏微循环的障碍,并开始应用彩色多普勒评价NAFLD的血流动力学改变。其结果表明,NAFLD患者的门静脉最大流速(peak portal vein velocity,PPVV),平均血流速度(mean portal vein velocity, MPVV)及肝动脉阻力指数(hepatic artery resistance index,HARI)减低。并且肝脏脂肪变程度越重,PPVV、MPVV以及HARI减低越明显。此外,肝静脉频谱形态呈现的波峰减少与肝纤维化的进程相一致,呈衰减型或平坦型[15]。所以,本研究NAFLD模型的CTP参数以及肝、脾TDC的变化与彩色多普勒的发现相符合,即NAFLD在肝脂肪变性和/或脂肪性肝炎的基础上,血流动力学发生了显著的变化,门静脉灌注减低。
非酒精性脂肪肝病实验兔的肝脏CTP中的BF、BV出现下降,门脉灌注量PVP明显下降,同时出现HPI增高,提示NAFLD微循环灌注下降后,可出现类似于肝硬化的肝动脉缓冲效应。
