油茶饼粕多糖的分级及其抗氧化性评价
2018-08-04何小娥黄卫文胡玉玲樊绍刚王文龙
石 浩,何小娥,黄卫文,胡玉玲,樊绍刚,王文龙,*
(1.湖南应用技术学院农林科技学院,湖南常德415100;2.湖南农业大学园艺园林学院,湖南长沙 410128)
油茶(CamelliaoleiferaAbel.)属油茶属茶科,常绿小乔木[1-2],主要种植在湖南、江西两省,占据全国总种植面积的60%以上[3]。在获取茶油的同时,每年油茶饼粕的产量也十分巨大,目前年产量已高达40万吨以上,多年来它被作为一种“废弃物”,而常常被人忽视[4-5]。目前国内油茶饼粕大部分被用作物肥料及动物饲料的原材料中,很少有做进一步的开发利用,油茶饼粕中含有一定量的代谢产物,其中多糖类含量高达30%以上。多糖作为油茶饼粕中的主要物质,具有一定的保健作用,如提高免疫力[6]、抗氧化、抗衰老[7-9]、降血糖[10]、抗肿瘤等[7,11]。因此,对油茶饼粕中多糖类物质的利用与活性研究是非常具有必要性的。
生态环境日益严重的污染以及人类精神、物质生活压力的增加,都将直接或间接导致人体内自由基含量的增加。由于自由基属于体内的一种高能分子,也破坏细胞膜,降低细胞活性,加速细胞内沉积物的生成,常会引发一些心脑血管病、癌症等高发的慢性疾病[12-13],因此对油茶饼粕多糖清除自由基活性方面的研究,以及开发相应清除自由基的保健品尤为重要。近年来,国内外在多糖清除自由基方面的研究比较多[14],但对其纯化多糖与其他物质协同抗氧化作用的研究较少。有相关报道称[15],有些复合剂活性相比单一药剂,具有活性高、成本低等优点,为避免高剂量带来的食品安全问题,有很好的应用前景。
1 材料与方法
1.1 材料与仪器
油茶饼粕 湖南省常德市丁家港镇油茶果经榨取茶油后所得副产物;DEAE-52纤维素、Sephadex G-100葡聚糖凝胶、DPPH自由基、木瓜蛋白酶(酶活≥60万U/g) Sigma公司;Dextran T-10、T-40、T-100、T-200、T-500系列标准多糖 Solarbio公司;VE、VC、氯化钠、无水乙醇、丙酮、正丁醇、氯仿、葡萄糖、98%浓硫酸、苯酚、氢氧化钠、铁氰化钾、三氯化铁、邻苯三酚、盐酸、水杨酸、硫酸亚铁、双氧水、Na2HPO4、NaH2PO4国药集团化学试剂有限公司;有机试剂 均为分析纯。
THZ-92B型可调速控温摇床 上海浦东物理仪器厂;ZW1105051705型紫外可见分光光度计 上海光谱仪器有限公司;SB-3200D型超声波清洗机 宁波新芝生物科技股份有限公司;AUW220D型电子天平 日本shimadzu公司;DR-1001型旋转蒸发仪 郑州长城科工贸有限公司;TG16型台式高速离心机 长沙英泰仪器有限责任公司;DK-98-IIA型电热恒温水浴锅 天津市泰斯特仪器有限公司;Thermo Savznt冷冻干燥仪 上海智岩科学仪器有限公司。
1.2 实验方法
1.2.1 多糖供试液的制备 取10 g油茶饼粕粉末经3.0%木瓜蛋白酶反应3.0 h后,75 ℃热水(1∶30 (g∶mL))、1000 W超声提取,提取3次,每次45 min[17]。抽滤弃去渣,合并滤液,提取液经浓缩至30 mL左右,加入1/3体积的Sevag试剂[氯仿∶正丁醇=4∶1 (V∶V)],混合振荡15 min后,静置10 min,除去水层与溶剂交界处的变性蛋白质。滤液经60 ℃减压蒸馏浓缩至15 mL体积后,加入最终浓度为75%的乙醇,沉淀得粗多糖。粗多糖用20 mL丙酮洗涤多次,得到初步纯化多糖溶液,将其浓缩至浸膏状后,-80 ℃冷冻干燥成粉末,称重约0.76 g,4 ℃条件下保存备用。
1.2.2 多糖组分的分离纯化 取约50 mg/mL的多糖水溶液10 mL,分别相继上样于DEAE-52纤维素柱和Sephadex G-100葡聚糖柱进行柱层析,用0.05、0.1、0.3、0.5 mol/L NaCl进行分段梯度洗脱,每个浓度的洗脱体积为90 mL;洗脱流速为1.0 mL/min,收集洗脱液,5 mL/管,采用硫酸-苯酚法显色跟踪测定,共分离出5个对称性较好、纯度较高的多糖组分,依次命名为:DTA、DTB、DTC1、DTC2、DTD。合并各多糖组分的洗脱液,采用旋转蒸发仪浓,经60 ℃减压缩至浸膏状;浓缩液经-80 ℃冷冻干燥至粉末状,测定其含量、纯度备用。
1.2.3 多糖含量及纯度的测定
1.2.3.1 葡萄糖标准曲线的绘制 移液枪分别精密移取浓度为100 μg/mL的葡萄糖对照品溶液0.15、0.30、0.45、0.60、0.75、1.00 mL于6支20 mL玻璃试管中,加入5.0%苯酚溶液1 mL,并迅速加入浓硫酸5 mL,摇匀,常温静置20 min后沸水浴3 min,取出后迅速冷却至室温,各试管中加蒸馏水补至10 mL,在490 nm处测定吸光值。精密量取蒸馏水1 mL同上述操作,作为空白对照,以糖浓度为横坐标(x),吸光值为纵坐标(y)得回归方程:y=0.0095x+0.0045(R2=0.9993)。
1.2.3.2 多糖含量的测定 取上述所得多糖粉末0.05 g,用蒸馏水溶解至1000倍体积后,取1 mL稀释液采用硫酸-苯酚法测定多糖含量,经换算得总多糖为0.511 g,其计算公式如下。
多糖含量(mg)=Ci×V×N×10-3
其中,Ci为样品测定吸光度在标准曲线中对应浓度(μg/mL);V为样品测定时体积(1 mL);N为样品稀释倍数(1000)。
1.2.3.3 多糖纯度的测定 粗多糖经层析柱分离后,收集合并含相同组分的洗脱液,浓缩至浸膏状后,-80 ℃冷冻干燥至粉末,分别称量和测定各组分多糖的质量,计算纯度。
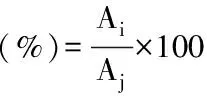
其中,Ai为多糖样品测定质量(mg);Aj为多糖样品称量质量(mg)
1.2.4 多糖分子量范围的确定 采用葡聚糖柱层析法。将浓度为5 mg/mL的Dextran T-10、T-40、T-100、T-200、T-500系列标准多糖0.1 mL分别相继上样,用双蒸水洗脱,每5 mL一管收集流出液,苯酚-硫酸法显色,收集合并洗脱液,求得洗脱体积(Ve),用Dextran T-2000同法测得柱床体积V0,以Ve/V0为横坐标,相对分子质量对数(lgM)为纵坐标,求得回归方程:y=-0.194x+5.9377(R2=0.9991)。各组分多糖均采用同法上柱得体积Ve′,根据Ve′/V0值代入到标准曲线方程中,求得其相应多糖组分的分子量。
1.2.5 多糖组分抗氧化能力的测定
1.2.5.1 还原能力测定 参照郝旭梅等[18]方法并稍作修改。用移液枪移取1.0 mL不同浓度、不同组分多糖溶液于10 mL玻璃试管中,同时加入1.5 mL浓度为0.2 mol/L的磷酸盐缓冲液(pH=6.6)以及1.5 mL浓度为1.0%的K3Fe(CN)6溶液,混匀,在55 ℃的水浴锅中反应25 min后冷水浴冷却,再加入1.5 mL浓度为10%的三氯乙酸溶液,摇匀振荡3 min后加入4 mL蒸馏水和0.20%的FeC13溶液0.5 mL,摇匀,充分反应10 min后测定吸光值A700 nm,每个样品测三次平行,以蒸馏水作为样品空白对照。
1.2.5.2 羟自由基(·OH)清除力测定 参照景永帅等[19]方法并稍作修改。用移液枪移取1.0 mL不同浓度、不同组分多糖溶液于10 mL玻璃试管中,同时加入1.0 mL浓度为15 mmol/L的FeSO4溶液以及1.0 mL浓度为15 mmol/L的双氧水溶液,混匀,常温下反应10 min后加入1.0 mL浓度为15 mmol/L的水杨酸溶液,摇匀,常温下反应30 min后补加蒸馏水1.0 mL,在510 nm处测定样品组吸光值Ai,样品背景吸光值Aj,以及蒸馏水作为样品空白对照吸光值Ao,每个样品测三次平行。
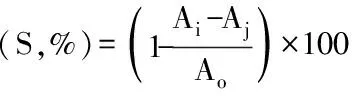
1.2.5.4 DPPH自由基清除力测定 参照刘军军等[21]方法并稍作修改。称取适量粗多糖、不同组分多糖及VC与VE,配成不同浓度的溶液。分别取不同浓度溶液1.0 mL,用50%乙醇补加至4.0 mL,再加0.5 mg/mL的DPPH溶液1.0 mL,摇匀,在室温避光反应30 min后在517 nm波长处测其吸光度Ai;样品背景吸光值Aj;对照组以等体积50%乙醇代替样品溶液,测定吸光度A0,计算公式同1.2.5.2。
1.2.6 Isobologram分析法研究多糖与VC、VE的相互作用 以多糖、VC、VE单独作用的IC50值的比值作为参考,选择多糖与VE的固定比例(质量浓度比)为1∶1、3∶1、9∶1,多糖与VC的固定比例为1∶1、6∶1、36∶1,按固定比例混合后,以同样的方法测定其对DPPH自由基的清除能力,计算清除率及复合组的IC50值。
对药物之间相互作用关系进行统计学分析[22-23]。按如下公式计算IC50add:
式中:R为A、B两种抗氧化剂单独应用时的效价比,即R=IC50A/IC50B;P1为抗氧化剂A在复配组中所占的比例;P2为抗氧化剂B在复配组中所占的比例,P2=1-P1。由实验可以得到复配组实际的IC50 mix值,比较理论上的IC50add和实验得到的IC50 mix,确定是否存在显著性差异,若IC50 mix值小于IC50add值,表示相互作用为协同作用。
再计算相互作用指数(γ),常用其来评价协同或拮抗作用的程度。
式中:IC50Amix、IC50Bmix分别为复配组中A、B两种抗氧化剂的IC50值;IC50A、IC50B分别为A、B两种抗氧化剂单独作用时的IC50值。若γ<1,表示相互作用为协同作用,γ值越小说明协同作用越强;若γ>1,表示相互作用为拮抗作用;若γ=1,表示相互作用为相加[24]。
1.3 数据处理
数据采用Origin制图,各抗氧化指标实验数据采用SAS 9.0统计软件进行显著性分析。图表中不同小写字母表示α=0.05显著性水平,p<0.05表示差异显著。
2 结果与分析
2.1 多糖柱层析洗脱图谱
取约50 mg/mL的多糖水溶液10 mL,依次上样于已经预处理好的纤维素柱和葡聚糖凝胶柱,实验结果由图1可知,共得到5个对称性好,无重叠,纯度较高的多糖组分,分别命名为DTA、DTB、DTC1、DTC2、DTC3、DTD(其中DTC在葡聚糖凝胶柱中得到进一步分离纯化出3个组分)。由此图1可知油茶饼粕多糖经DEAE-52纤维素和SephadexG-100葡聚糖凝胶柱层析后可得到纯度较高的不同多糖组分。

图1 多糖洗脱曲线图谱Fig.1 Curve of polysaccharide elution
2.2 多糖组分含量、纯度及分子量的确定
各组分多糖的分子量大小均不一样,且有较大差别;通过柱分离所得多糖组分,计算各组分的含量及纯度。实验结果如表1所示,可看出随着多糖洗脱体积的增加,多糖的分子量不断的减小;DTA最先被洗脱出来,分子质量最大,在50万左右,其后组分DTB、DTC1、DTC2分别被洗脱出来,分子量依次为20万、10万、5万左右,DTD最后被洗脱出来,分子量最小,在4万左右。各组分多糖的纯度差别不大,在80%左右;含量有一定的差异,DTA、DTB、DTC1的含量在25%左右,其余两个组分在10%左右。

表1 不同组分多糖的确定(n≥3)Table 1 Determination of different components of polysaccharide(n≥3)
2.3 多糖抗氧化能力的测定
2.3.1 还原能力的测定 不同组分及不同浓度下多糖还原性能力的大小有较大的差别,其测定结果如图2所示,各组分多糖随着其浓度的增加,还原能力逐渐增强,具有一定的正相关性,在0.2~1.0 mg/mL浓度范围内,还原力增加了4.3~11.5倍。在(1.0 mg/mL浓度下)不同多糖组分间还原力的大小依次为:DTC1>DTC2>DTA>DTD>DTB,DTC1(0.527)相对于DTB的还原力提高了1.7倍,说明各组分多糖由于其结构以及分子量的不一样,最终导致其自身还原力也相差较大。因此,在今后对油茶饼粕多糖类抗氧化产品开发时可选择10万左右分子量的多糖。

图2 不同组分多糖的还原力Fig.2 Reducing power of polysaccharides from different components注:图中不同字母表明差异显著(p<0.05);图3~图6同。
2.3.2 ·OH自由基清除力测定结果 不同组分及不同浓度下多糖对·OH自由基清除力的大小也具有一定的差异,其测定结果如图3所示,随着各组分多糖底物浓度的增加,·OH自由基清除能力逐渐增强,在0.1~0.5 mg/mL浓度范围内,.OH自由基清除能力增加迅速,如DTC1在0.5 mg/mL时清除率增加了60.50%;0.5~1.5 mg/mL浓度范围内,·OH自由基清除能力增加也较为迅速,但当浓度≥1.5 mg/mL时,·OH自由基清除能力逐渐趋于平稳。在2.0 mg/mL浓度下,不同多糖组分间·OH自由基清除能力的大小依次为:DTC1>DTA>DTC2>DTD>DTB,DTC1(78.92%)相对于DTB提高了31.00%。
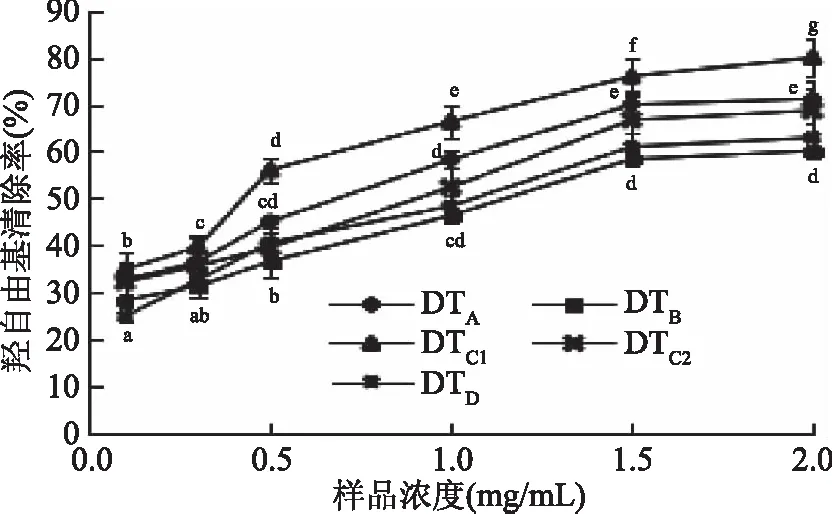
图3 不同组分多糖的·OH自由基清除率Fig.3 Scavenging rate of ·OH radical in different fractions of polysaccharides

图4 不同组分多糖的超氧阴离子自由基清除率Fig.4 Scavenging rate of superoxide anion radical in different fractions of polysaccharides
2.4 多糖、VC、VE清除DPPH自由基能力的比较
在一定浓度范围之内,各组分多糖、VC、VE对DPPH自由基的清除能力与浓度呈量效关系,后均逐渐趋于稳定。由图5、图6可知,多糖具有较强清除自由基的能力,其中DTC1抑制效果最佳,当其质量浓度达到2.0 mg/mL时,对DPPH自由基的清除率可达到80%以上。多糖(DTC1)、VE、VC的IC50值分别为0.833、0.266、0.135 mg/mL,即清除DPPH自由基的能力依次为VC>VE>多糖。DTC1与VC及VE的IC50值比率分别为1∶0.162、1∶0.319,后续选择3组固定比例做复配物抗氧化测定。

图5 不同组分多糖的DPPH自由基清除率Fig.5 Scavenging rate of DPPH radical in different fractions of polysaccharides

图6 VC、VE的DPPH自由基清除率Fig.6 Scavenging rate of DPPH radical in VC、VE
2.5 Isobologram分析法评价多糖与VC、VE的相互作用
2.5.1 DTC1与VC、VE复配后清除DPPH自由基能力的测定 多糖(DTC1)和VC的固定比例均定为1∶1、6∶1、36∶1,DTC1和VE的固定比例均定为1∶1、3∶1、9∶1,VC、VE固定比例中的质量浓度选择0.01~0.50 mg/L,DTC1固定比例中的质量浓度选择0.01~2.50 mg/L较为适宜。以同样的方法测定复合抗氧化剂对DPPH自由基的清除作用(表2);再由表2计算出多糖与VC、VE组成的复配抗氧化剂对DPPH自由基的清除作用的IC50值(表3)。
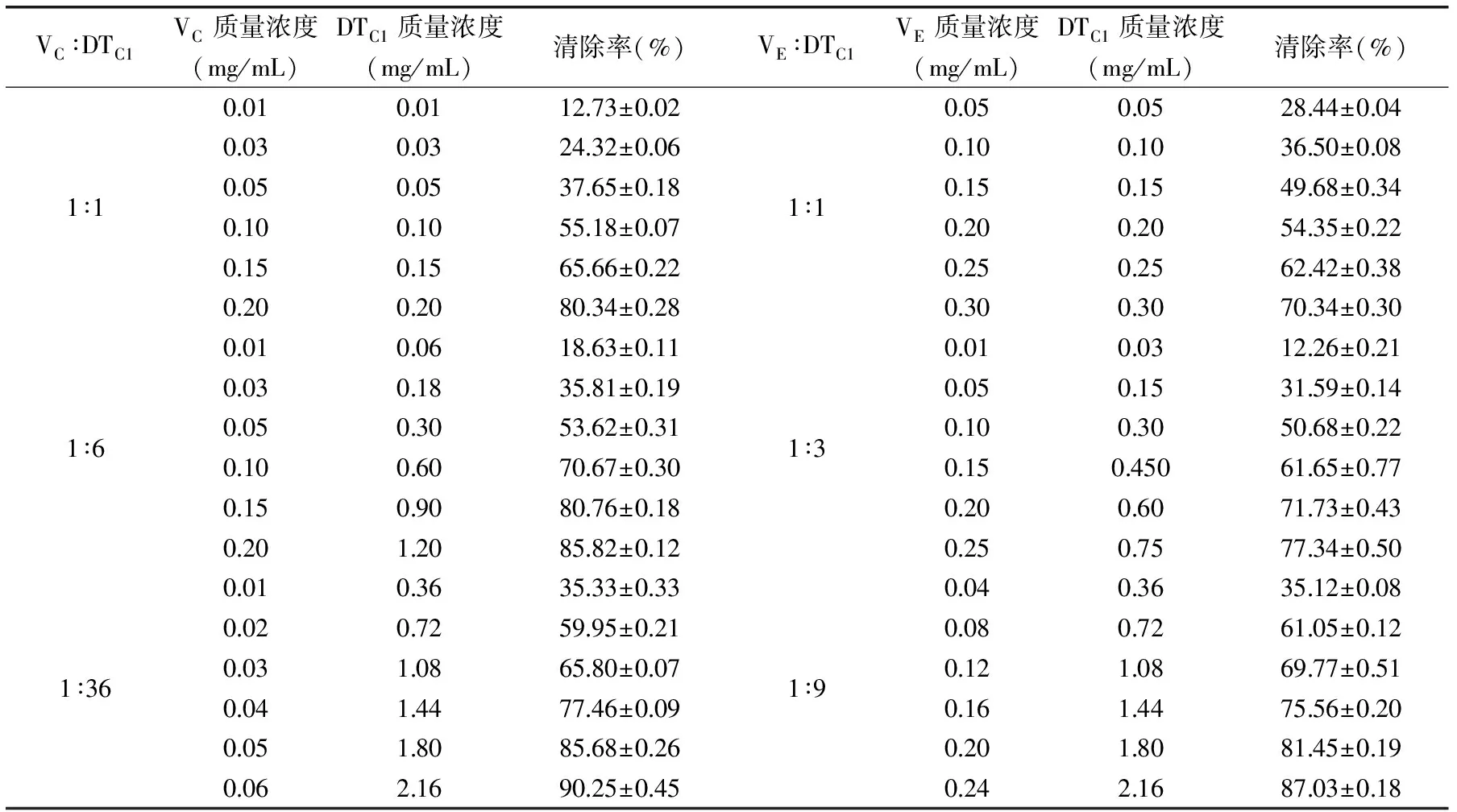
表2 DTC1与VC、VE复配后对DPPH自由基的清除能力(n≥3)Table 2 DPPH radical scavenging capacity of DTC1combined with VC or VE(n≥3)
2.5.2 DTC1与VC、VE复配后的统计学分析 按1.2.6所述方法及相应公式计算复配组(表2)理论上的IC50add值和相互作用指数γ,结果见表3。由表3可出,各种组合的IC50 mix值均小于IC50add值,经过t检验证明两者之间有一定差异性,且相互作用指数γ都小于1,表明多糖与VC、VE的相互作用为协同作用。γ值越小说明协同作用越强,由此可得多糖与VC复配组的协同作用略弱于多糖与VE复配组,两组均是1∶1配比的协同作用效果最好,其次是多糖与VE(1∶36)复配组。
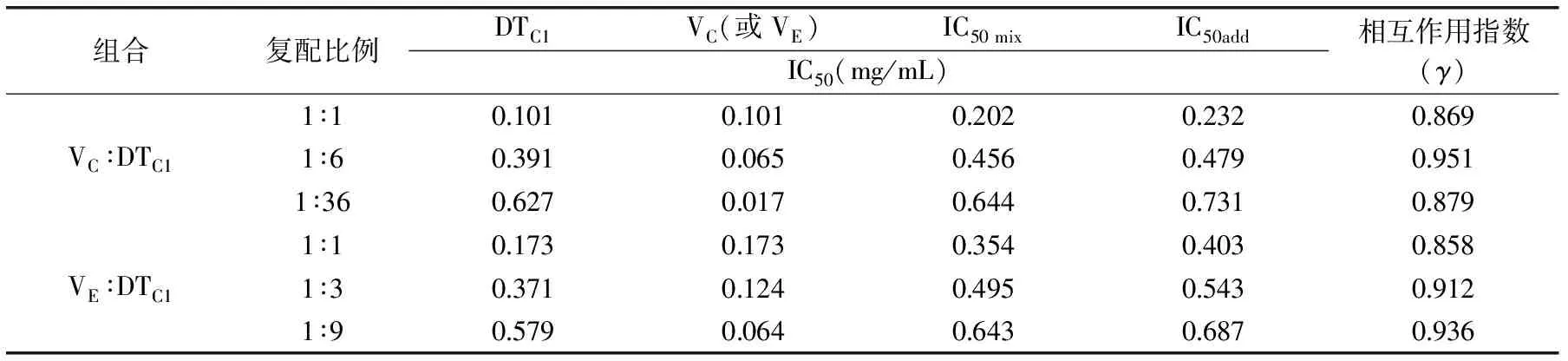
表3 DTC1与VC、VE复配后清除DPPH自由基的IC50值及统计学分析结果Table 3 IC50 value and statistical analysis of DPPH radical scavenging by DTC1 and VC、VE
2.5.3 DTC1与VC、VE复配后的Isobologram分析图 根据图5、图6、表3所测得IC50值标绘在Isobologram分析图上(图7、图8)。将DPPH自由基清除实验中得到的DTC1的IC50值和95%可信限标绘在纵轴上,VC和VE的IC50值和95%可信限标绘在横轴上,将两IC50值相连后构成相加线,将两可信限分别相连后作出相加线95%可信限。若复合多糖(DTC1)效应(复配点IC50)落在相加效应线上或可信限内,则表示两药作用为相加;如落在相加效应线的可信限左侧,则代表协同作用;如落于右侧,则为拮抗作用。由图7、图8可知,复配组的效应点均落在相加线和95%可信限的左侧,表明DTC1与VC、VE复配后存在协同抗氧化作用。
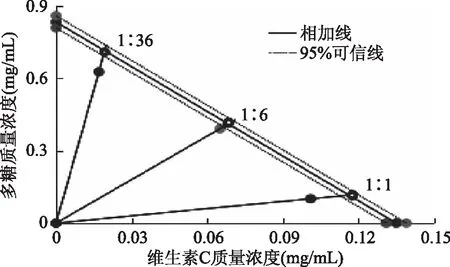
图7 DTC1与VC复配的Isobologram分析图Fig.7 Isobolographic plot of DTC1 from Camellia cakes combined with VC注:相加线上的空心点(○)代表理论IC50add值,实心点(●)代表实验IC50 mix值;图8同。
3 结论

4 讨论
多糖组分得到柱分离,以及不同组分多糖抗氧化性差异可能是由于各组分多糖的单糖组成、极性大小、质量大小、黏度大小、空间构象等一些因素不一样所导致[25-26],在后期实验中可进一步对不同组分多糖结构的测定,探讨其结构、组成与抗氧化能力大小的关系。目前抗氧化剂复配在一起发挥协同作用的机理主要有修复再生或新生、偶联氧化、吸收氧气、改变酶的活性、络合金属离子等[27-29],影响协同作用强弱的因素主要有两种物质的平衡浓度及其配比等。今后可在本文的基础上进行进一步实验,研究多糖协同抗氧化的具体机理及其发挥最佳协同作用的平衡浓度,从而最大程度上节约成本,更好地指导生产与实践。
