ADAM-17抑制剂TNF484对肝癌细胞增殖、迁移和侵袭的影响
2018-08-03张东升周方正郭思言李艳梅
张东升,周方正,陈 洁,郭思言,聂 龙,李艳梅
肝细胞癌(hepatocellular carcinoma, HCC)是一种常见恶性肿瘤,其恶性程度高,临床诊断往往都已较晚,严重威胁着人类的健康,抑制和控制肿瘤的转移是治疗和预防癌症的主要策略[1,2]。肿瘤的侵袭和转移是多基因、多步骤相互作用的过程。目前有研究认为细胞外基质降解酶系统:基质金属蛋白酶家族和去整合素-金属蛋白酶家族(a disintegrin and metalloproteases,ADAMs)参与了肿瘤侵袭及转移过程。
ADAM-17被称为α肿瘤坏死因子转换酶(tumor necrosis factor-alpha converting enzyme, TACE),ADAM-17可以剪切脱落双调蛋白、转化生长因子等多种表皮生长因子受体的配体,直接间接激活表皮生长因子受体(epidermal growth factor receptor, EGFR)相关通路来影响肿瘤细胞的发生、发展及转移[3]。许多研究表明,ADAM-17在许多肿瘤中过表达,促进肿瘤细胞的侵袭和转移过程,提示该基因可能在肿瘤进展中起重要作用,ADAM-17和其他ADAM蛋白酶可能是治疗癌症和其他疾病的潜在靶标[4]。由于其许多家族成员的结构复杂,且在不同的肿瘤中表达不同,对ADAM-17抑制剂的研究尚在早期阶段,因此ADAM-17对肿瘤的抑制作用需要进一步研究,这可能使ADAM-17成为新的潜在临床治疗靶点。本研究旨在探讨ADAM-17抑制剂TNF484对肝癌细胞增殖、迁移和侵袭的影响。
1 材料与方法
1.1 细胞培养及抑制剂 将人肝癌HepG2细胞株和Bel7402细胞在DMEM培养液(GIBCO,USA)中培养,10%胎牛血清(GIBCO,USA),在37 ℃,5%CO2和75%湿度的培养箱中,培养液每3 d更换一次。
1.2 细胞活力检测 将1×104HepG2和Bel7402细胞悬浮在96孔板中的每个孔中,加入不同浓度的抑制剂,在37 ℃培养箱中孵育72 h,正常细胞为阴性对照。孵育后,每孔加入20 μl MTT溶液(5 mg/ml),继续培养4 h。将96孔板在4 ℃下以1200 g离心10 min,小心吸出上清液,然后将每孔加入50 μl二甲基亚砜,置摇床上低速震荡10 min。在酶联免疫检测仪490 nm吸光度下测量各孔的吸光值(OD)。测定细胞增殖及细胞活性。计算公式:抑制率IR=1-试验组的平均OD值/对照组的平均OD值。
1.3 qRT-PCR检测ADAM-17mRNA的表达 各组细胞于6孔板培养72 h后,将不同浓度(0~1 μM)的TNF484(ADAM-17抑制剂,Sigma公司)加入各组细胞培养。按Trizol试剂说明书提取细胞总RNA,反转录成cDNA,以GAPDH作为内参基因。RT-PCR反应条件:95 ℃, 5 min预变性后,94 ℃,20 s,退火温度60 ℃, 20 s,共40个循环,延伸温度72 ℃ 40 s。终止反应。
1.4 迁移分析 使用xCELLigence系统(罗氏公司)检测HCC细胞的迁移能力。在CIM-16孔反应板的下室加入200 μl(2×104)细胞悬液,阳性组加入TNF484,不加TNF484作为阴性对照组。然后将10%含血清的DMEM培养液加入下室。xCELLigence系统对生长于反应孔板上的细胞阻抗进行记录。 经过72 h在RTCA分析仪上进行细胞迁移分析。
1.5 细胞侵袭实验 使用三维共培养模型(Trevigen公司)测定肝癌细胞在TNF484抑制下的侵袭能力。成球和侵袭基质成分的准备按照说明书的要求做。用DMEM和成球基质混合细胞,在3D球培养板的每个孔中加入5×102个细胞,在4 ℃条件下,200 g离心3 min。将培养板放入37 ℃孵育72 h,让球体形成。在加入侵袭基质之前,在4 ℃条件下,300 g离心5 min。然后将培养板放入37 ℃,孵育1 h,促进侵袭胶的形成。在孔中加入10 μM的TNF484, 每24 h记录成球的图像。用GraphPad Prism软件对图像进行分析。

2 结 果
2.1 TNF484抑制剂对肝癌细胞增殖能力的影响 随着抑制剂浓度增加,抑制率也增高,TNF484在100 μM 时对HepG2和BEL7402细胞增殖抑制作用最大(表1)。
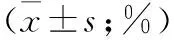

细胞株(μmol/L)HepG2BEL-740205.8±0.94.2±0.5118.1±1.917.9±1.81060.2±2.865.3±2.55075.2±3.173.1±3.310080.0±5.685.0±5.8
注:不同浓度之间抑制率比较,P<0.05
2.2 TNF484抑制剂对肝癌细胞迁移能力的影响 TNF484孵育细胞72 h,10 μM浓度条件下,即可显著抑制细胞的迁移,HepG2细胞的空白对照组及抑制组的细胞分数分别为80.92%±6.10%、55.60%±4.21%,BEL7402细胞的空白对照组及抑制组的细胞分数分别为82.62%±6.15%、59.8%±4.27%,两组之间细胞分数比较,差异均有统计学意义(P<0.05)。
2.3 TNF484抑制剂对肝癌细胞系中ADAM-17表达水平的影响 10 μM TNF484在处理72 h后HepG2及BEL-7402细胞株中ADAM17 RNA表达水平降低,抑制率分别为(45.0±3.1)%及(48.0±3.3)%,与处理前比较,差异均有统计学意义(P<0.05)。
2.4 TNF484抑制剂对肝癌细胞侵袭能力的影响 与空白组相比,10 μM的TNF484显著降低了HepG2及BEL-7402细胞的侵袭能力(图1),阳性对照组第1天细胞的迁移能力分别为空白对照组的(35.7±3.1)%、(39.7±3.5)%,第15天细胞的迁移能力分别为空白组的(30.7±2.1)%、(31.2±2.6)%(P<0.05)。

图1 TNF484抑制剂对肝癌细胞株侵袭能力的影响A.HepG2; B. BEL-7402
3 讨 论
肿瘤的侵袭及转移是多基因、多步骤相互作用的过程,主要包括恶性肿瘤细胞从原发灶迁移黏附到细胞外基质(extracellular matrix,ECM)、降解并穿过ECM和基膜、通过血管进入宿主微环境等步骤。肝癌广泛转移是其造成高病死率的主要原因,因此找到一种能够抑制肝癌侵袭转移的药物,是有效治疗肝癌的关键。
目前的研究认为,ADAM-17在肿瘤的转移和侵袭中起重要作用[5]。ADAM-l7是ADAMs 家族成员之一,属于含锌蛋白酶,具有水解细胞膜上的肿瘤坏死因子的功能[6]。与大多数的ADAMs成员类似,ADAM-17具有多个功能结构域[7],在N端,存在保守的氨基酸序列,称之为半胱氨酸开关,与催化区的Zn2+结合,使ADAM-17处于酶原状态。ADAM-17可以剪切脱落双调蛋白、转化生长因子等多种表皮生长因子受体的配体,直接或间接激活EGFR相关通道。通过激活PI3K/AKT、Ras/Raf/MAPK等多条信号转导途径影响肿瘤细胞基因表达、细胞的增殖分化和侵袭[8,9]。近年来多项研究表明,ADAM-17 在非小细胞肺癌、乳腺癌、卵巢癌、肾癌、结直肠癌和胰腺癌等多种肿瘤组织中高表达,并促进肿瘤的侵袭转移过程[10-12],ADAM-17可能成为肝癌特异性治疗的潜在靶点。
目前EGFR、VEGF等靶向治疗药物已取得满意的临床疗效,ADAM-17 抑制药的研究还在起步阶段,需进一步明确其抑制肿瘤作用[3,13]。TNF484是以琥珀酸为基础的氧肟酸,有很强的TACE抑制性[4]。当前TNF484在肝癌细胞株中的研究较少,本研究发现TNF484对肝癌细胞株增殖能力有明显的抑制作用且呈剂量依赖性,且在迁移和侵袭也有着显著的抑制作用。本实验中,TNF484在10 μM浓度条件下,HepG2和BEL7402细胞株的空白对照组及阳性组即有显著的统计学意义,同时也发现TNF484可以显著降低癌细胞中ADAM-17的表达,与文献[14]报道一致。因此,推论TNF484可能通过降低ADAM-17在HCC中的表达来抑制肿瘤细胞增殖、侵袭及转移,进而抑制HCC的发展。TNF484对肝癌动物模型中肿瘤的生长和侵袭的抑制作用,需要进一步检测。
总之,ADAM-17抑制剂TNF484抑制HCC细胞的增殖、迁移和侵袭。
