兔布鲁杆菌病性脊柱炎动物模型的建立
2018-08-03荀传辉蔡晓宇王传锋买尔旦买买提
荀传辉 蔡晓宇 王传锋 买尔旦·买买提
布鲁杆菌病性脊柱炎,即布鲁杆菌侵袭脊柱引起椎间盘炎或椎体炎时所引发的病变[1],是布鲁杆菌病骨关节系统的表现之一,在布鲁杆菌病中的发病率可高达65%[2-4]。布鲁杆菌病性脊柱炎患者无特异性的临床症状与体征,仅靠临床表现诊断较困难[5];临床上对布鲁杆菌病性脊柱炎误诊并因此延迟治疗的患者仍比较多,最易误诊为脊柱结核[6]。因此,迫切需要深入进行布鲁杆菌病性脊柱炎诊治的研究,动物模型则是其研究的基础,国内外有关构建布鲁杆菌病性脊柱炎模型的文献报道甚少。本实验通过在动物脊椎体内植入布鲁杆菌创建动物模型,需要直接在动物体内进行骨骼钻孔,使用医学手段使动物感染布鲁杆菌,因而选用了兔等较大型的哺乳动物而非鼠类等体型较小的动物[7]。通过研究发现,相比非近交系兔,近交系兔在感染了结核分枝杆菌之后会造成更多的细菌繁殖,其体质更适合菌株生长,因此认为近交系兔较非近交系兔对结核分枝杆菌更敏感[8]。因在临床工作中,布鲁杆菌病性脊柱炎与脊柱结核较难鉴别[9],其在疾病的发病机制上有较多的相似之处[10],所以此次实验选用纯种新西兰大白兔。由于布鲁杆菌感染易致在动物体内全身播散、甚至死亡,治疗成功率低,且布鲁杆菌具有高致病性[11],对实验室条件要求较高,极大地限制了布鲁杆菌病性脊柱炎实验动物模型的研究和发展。然而,由于布鲁杆菌病发病率上升,布鲁杆菌病性脊柱炎的发病率也随之增高,较多患者误诊为脊柱结核,且难治患者增加,故亟需改进布鲁杆菌病性脊柱炎的诊疗方法;因而建立布鲁杆菌病性脊柱炎动物模型,进行相关实验研究是布鲁杆菌病性脊柱炎防治工作中不可缺少的[12]。
笔者于2017年1月1日至12月30日通过对比实验研究,在新西兰兔的椎体钻孔、种植M5羊种布鲁杆菌弱毒苗进行布鲁杆菌病性脊柱炎的造模实验,目的在于:(1)构建兔布鲁杆菌病性脊柱炎模型;(2)从影像学、组织病理学、细菌学检查等方面对模型进行综合评价;(3)为布鲁杆菌病性脊柱炎基础研究提供理想的实验动物模型。
材料和方法
一、实验条件及设备
本研究获新疆医科大学伦理委员会审批。本研究中造模实验由伊犁职业技术学院生物实验室与新疆医科大学动物实验室联合完成。造模术中严格遵守无菌操作、标准预防、动物伦理等原则。布鲁杆菌为M5羊种布鲁杆菌弱毒苗。所需设备有计算机X线摄影(computed radiography,CR)仪(中国东大阿尔派公司生产)、SOMATOM Definition CT(德国西门子生产);MAGNETOM Symphony 1.5 T MRI仪(德国西门子公司生产)、光学纤维仪DFC295型(德国Leica公司生产)、病理图像分析系统(美国 Nikon公司生产)、弗氏完全佐剂10 ml(美国Sigma公司生产)、改良Sauton液体培养基(自制)、改良罗氏培养基(自制)。
二、实验动物及分组
健康新西兰大白兔48只(新疆医科大学实验动物中心提供,许可证:SCKX新2011-0001),雌雄不限,体质量为2.5~3.0 kg。按数字表法随机将48只新西兰大白兔分为实验组16只,对照组16只,空白组16只。所有实验兔均分笼隔离饲养,居住环境、喂养方式无差别。
三、主要实验试剂
新疆天康生物股份有限公司生产的M5羊种布鲁杆菌弱毒苗(M5布氏杆菌活疫苗),注射量:3×108CFU/ml,每只兔注射0.1 ml。
四、动物模型的制备
1.麻醉方法:用氯胺酮、安定、阿托品联合麻醉,氯胺酮、安定、阿托品按 2∶2∶1比例配置,用生理盐水稀释一倍,约 2.5 ml/kg,耳缘静脉缓慢推入。手术时辅助质量浓度为0.5%的利多卡因注射液5~10 ml行局部浸润麻醉。
2.手术方式:取实验组新西兰大白兔16只,将麻醉好的实验动物右侧腹部剃毛,左侧卧位固定于手术板上。常规消毒铺巾,沿左侧第12肋末端向下至髂嵴作长约6 cm的纵切口,经侧方入路显露第5~6腰椎(L5~6)间盘及上下相邻椎体。于第6腰椎(L6)体上终板下5 mm处从右前方向左后方,与椎体冠状面呈30°,采用克氏针钻孔,孔径3 mm,深度5 mm,骨孔道止血后填入明胶海绵[13];采用注射器在明胶海绵上缓慢浸注含M5羊种布鲁杆菌弱毒苗(3×108CFU/ml)的混悬液0.1 ml,骨蜡封闭孔道。对照组新西兰大白兔同上法显露、钻孔、明胶海绵填入后,采用注射器在明胶海绵上缓慢浸注含有液体培养基的生理盐水混悬液0.1 ml,骨蜡封闭孔道。空白组16只不做任何处理。术后将所有动物分笼,于相同环境下喂养。动物房接受紫外线照射消毒,每日1 h。8周内若出现动物死亡,立即进行解剖分析后密封送医院焚烧处理。术后8周影像学检查完毕后,麻醉下解剖所有实验组、对照组、空白组大白兔,取材后处死封闭焚烧处理。
五、检测项目及内容
1.动物一般情况观察:所有实验兔自由活动,观察动物每日活动、精神及进食情况、切口是否感染等。
2.影像学观察:各组实验兔于造模后当日及造模后4、8周行X线摄影、CT扫描三维重建、MR检查,观察椎间盘及椎体破坏、死骨、脓肿形成情况。
3.组织病理学观察:造模后8周,影像学检查完毕后在麻醉下解剖全部实验兔,显露L5~6椎间盘及相邻上下椎体,取椎间盘、上下终板及部分椎体,以及病变组织、脓肿壁、肉芽组织等标本进行常规HE染色,行病理学检查[14]。
4.布鲁杆菌培养:取实验组与对照组内所有成活兔椎旁肉芽组织0.5 g,匀浆后置于自制的改良罗氏培养基上,36 ℃恒温培养,连续观察6周。
5.诊断标准:按Tekkök等[15]的诊断标准,符合以下标准中2条或以上可确诊:(1)血培养或骨髓穿刺培养阳性;(2)标准布鲁杆菌凝集试验阳性;(3)X线、CT、MRI检查或核素骨扫描证实脊柱受累;(4)病理结果证实为非结核性肉芽组织。
六、统计学处理
采用SPSS 17.0软件进行数据分析,组间感染率、死亡率采用卡方检验或Fisher精确概率法进行统计学检验,以P<0.05为差异有统计学意义。
结 果
一、动物成活情况
实验组术后当日麻醉恢复顺利,有2只实验兔于4周内死亡,2只实验兔死于造模术后4~8周,死亡率为25.0%(4/16),以上实验兔死亡后进行解剖未见明显异常。8周后共存活12只(75.0%),2只因术后4周切口未愈合,出现红肿破溃被淘汰,其余实验兔编号为1~10。存活实验兔均出现消瘦、纳差、活动减少等症状。
对照组1只实验兔因麻醉意外于当日死亡;1只因进食、饮水不良于术后第13天死亡,死亡率为12.5%(2/16)。1只因切口感染被淘汰,其余13只兔术后恢复顺利,质量无明显变化,术后8周存活率为87.5%(14/16)。空白组16只实验兔进食好,8周时仍存活,存活率为100.0%。
实验组、对照组与空白组死亡率分别为25.0%(4/16)、12.5%(2/16)、0,采用Fisher精确概率法检验,差异无统计学意义(P=0.143)。实验组与对照组感染率分别为12.5%(2/16)、6.25%(1/16),采用χ2检验进行比较,差异无统计学意义(χ2=0.37,P=0.544)。
二、影像学表现
X线摄影未发现实验组内阳性兔造模椎间隙发生明显改变、椎体破坏、塌陷及高度丧失。CT三维重建未见实验兔椎体出现明显破坏,主要为椎间隙变窄(图1)。MRI对兔椎体及周围软组织、脓肿、脊髓等信号显示清晰,T1WI示造模椎体上端及椎旁呈等信号或略低信号;T2WI示椎体上端及椎旁呈混杂高信号(图2~4)。椎间盘可见信号异常(图5,6)。实验组术后4周X线摄影及CT三维重建检查阳性5只,MRI阳性7只;术后8周X线摄影及CT三维重建检查阳性8只,MRI阳性10只。
对照组大白兔在术后4、8周X线摄影显示椎间隙无明显变化,椎体无破坏;CT三维重建未发现造模椎体孔径较前减小,边缘较正常椎体硬化,但无骨质破坏,可见椎间隙变窄,无脓肿及软组织钙化影;MRI表现为椎体上端及椎旁略低信号改变;T2WI示椎体上端、椎旁稍高信号,椎间盘未见信号异常。
空白组在影像学上无异常表现。
三、大体解剖观察
术后8周影像学检查完毕后麻醉下解剖所有实验组、对照组、空白组大白兔。
1.实验组:兔伤口愈合良好,无窦道形成。剥离椎前肌与椎体粘连后,可见:(1)纤维环颜色变暗,椎间隙变窄;(2)相邻椎体上、下终板未见明显骨质破坏,未能发现原钻孔部位;(3)椎旁软组织及腰大肌肿胀,未见明显脓液;(4)椎旁未见坏死物质及肉芽组织生成;(5)解剖胸腔及腹腔其他脏器未见异常。
2.对照组:兔原椎体钻孔部位孔洞直径缩小,未见脓肿及椎体骨质破坏。
3.空白组:兔椎体及腹腔、胸腔脏器未见异常。
四、组织病理学观察
实验组组织病理学检查:兔病椎旁软组织肿胀区均出现大量淋巴细胞反应及少量类上皮细胞形成(图7~10),无凝固性坏死物质及死骨形成。未见多核巨细胞反应及典型的增生性结节形成。对照组兔组织学检查,显示骨小梁结构正常,其周围有少量炎性细胞浸润,无死骨及类上皮细胞改变。
五、布鲁杆菌培养
实验组的10只大白兔肉芽组织匀浆在自制罗氏培养基上培养,10份标本连续培养6周,未见布鲁杆菌生长。
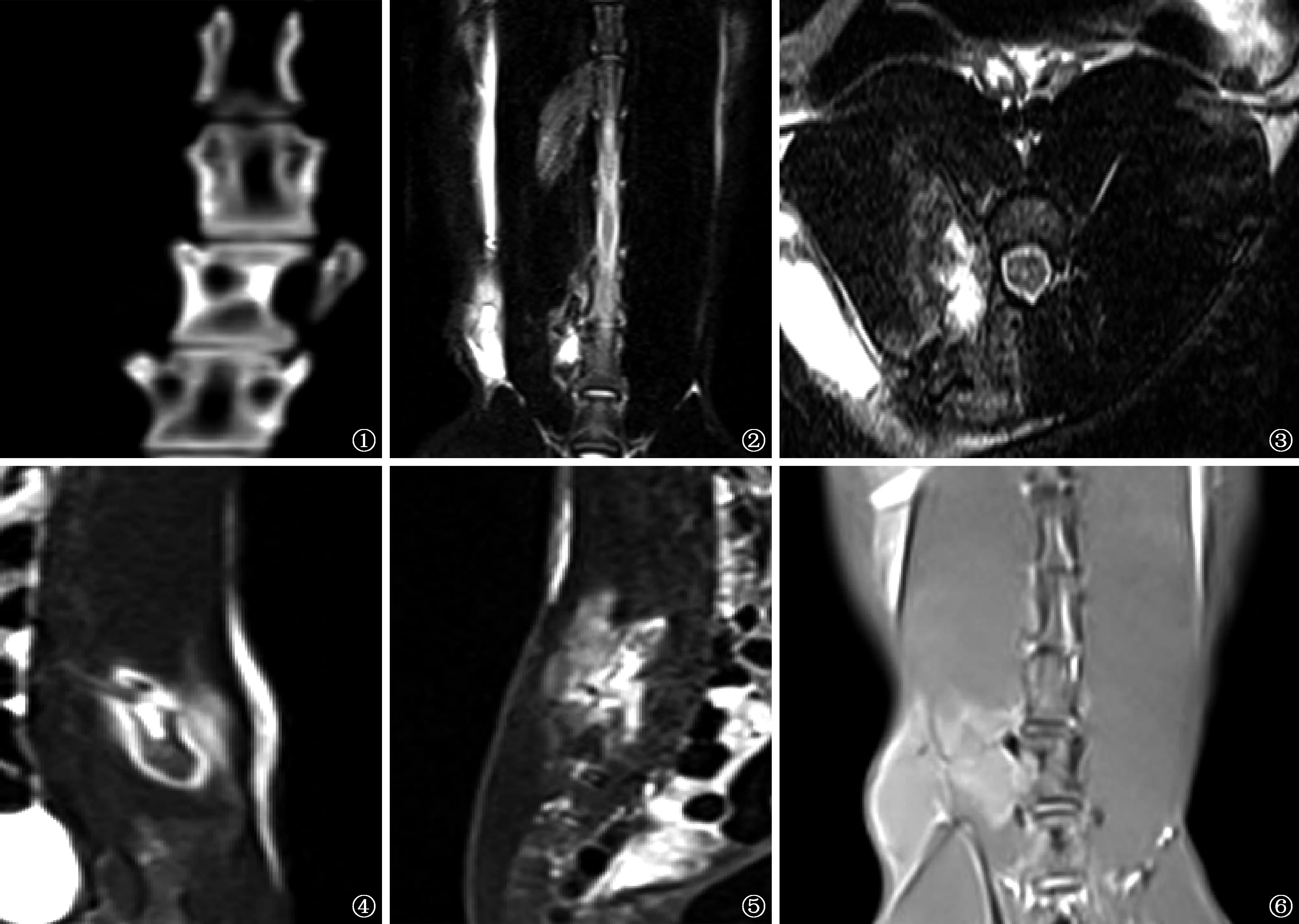
图1 CT三维重建未见实验兔椎体出现明显破坏,主要为椎间隙变窄 图2~4 实验组大白兔行MRI检查,对兔椎体及周围软组织、脓肿、脊髓等显示清晰,T2WI示椎体上端及椎旁呈混杂高信号 图5,6 实验组大白兔行MRI检查,表现为椎体上端及椎旁略低信号改变;T2WI示椎体上端、椎旁呈混杂高信号,椎间盘可见信号异常
讨 论
新西兰大白兔对结核分枝杆菌敏感,常用于结核感染模型的研究。因新西兰大白兔脊椎便于造模手术时的细菌植入,以及其后续实验的清创、植骨等操作均简便易行,且脊柱结核与布鲁杆菌病性脊柱炎在诊断上较难鉴别,故本研究选择新西兰大白兔作为实验动物。本研究中,实验大白兔术后4周即发现椎旁软组织有肿胀及脓肿形成。8周大白兔存活率实验组为75.0%(12/16)、对照组为87.5%(14/16)、空白组为100.0%(16/16)。实验组术后4周X线摄影及CT三维重建检查阳性者5只,MRI阳性者7只;术后8周X线摄影及CT三维重建阳性者8只,MRI阳性者10只。术后8周,组织病理学显示椎旁软组织均有病变组织细胞增生及以淋巴细胞为主的炎性细胞浸润。因布鲁杆菌病性脊柱炎临床上须综合诊断进行确诊,笔者在诊断人布鲁杆菌病性脊柱炎时多采用Tekkök的诊断标准,即结合影像学、病理学、细菌培养基实验室检查结果进行诊断。在人体,布鲁杆菌病性脊柱炎主要表现以全身中毒症状好转后,在脊柱局部形成以自身免疫性反应为主,因炎性反应造成椎间盘坏死、椎体不稳而造成局部的剧烈疼痛。在实际临床工作中,布鲁杆菌的培养阳性率极低,本研究建立动物模型以研究局部炎性反应及病变为重点,在诊断上以病理诊断为主。因此,结合影像学及病理学检查结果说明造模是成功的,可为布鲁杆菌病性脊柱炎做进一步的药物试验、疫苗研究、手术方法、植骨材料等的研究提供理想的实验模型。
一、构建兔布鲁杆菌病性脊柱炎模型的关键
1.选用标准的M5羊种布鲁杆菌弱毒苗及适当的菌量:羊种布鲁杆菌即马耳他布鲁菌,有很强的毒性及传染性,故选用羊种布鲁杆菌做动物实验须在生物安全防护三级实验室(简称“P3实验室”)中进行,但因本次实验须在实验周期中对实验对象进行影像学检查,出于安全方面的考虑且遵守实验室安全制度,故采用M5羊种布鲁杆菌弱毒苗为实验所用菌株。M5羊种布鲁杆菌弱毒苗是一种具有较高侵袭性和传染性的毒株,本研究选用此菌株作为实验用菌,毒力适中,较野生菌可更好地控制菌量,可利用其较好地复制布鲁杆菌病动物模型。本实验组骨孔内浸注0.1 ml的M5羊种布鲁杆菌弱毒苗,浸注菌量适中,实验中无皮肤窦道形成。
2.选择恰当的种植部位:解剖发现成年新西兰大白兔腰椎椎体细长,上、下端粗大,最长矢状径与冠状径分别约为8 mm和10 mm。由两端向中间逐渐缩窄且不规则,中间部分厚度约2 mm左右,均为皮质骨,中间为椎管,与人体不同,兔的下腰椎椎管内仍为脊髓[7]。因此,可行钻孔种植布鲁杆菌的部位仅为上下两端终板,终板边缘距椎间盘不超过5 mm,因此控制钻孔深度在5 mm以内,在该部位种植布鲁杆菌既符合布鲁杆菌病性脊柱炎形成的原理,也是造模椎体体积最大的部位。
3.细菌植入方法得当:如何更好地植入细菌,目前尚无理想的方法。细菌植入方法主要有两种:局部钻孔与局部注射。本研究采用椎体局部钻孔、明胶海绵填塞、石蜡封闭骨孔,布鲁杆菌混悬液浸润在明胶海绵内,可减少或避免细菌随出血向外溢出。
二、兔布鲁杆菌病性脊柱炎模型的影像学特点
影像学检查是观测兔布鲁杆菌病性脊柱炎模型成功与否的重要方法。与脊柱结核造成的椎体骨质破坏、椎间盘信号异常及脓肿形成甚至后凸畸形不同,布鲁杆菌病性脊柱炎主要表现为椎间隙破坏,极少见椎骨骨质的破坏,可有脓肿形成[16]。与人类布鲁杆菌病性脊柱炎相似,本研究中术后8周行X线摄影及CT三维重建复查时实验兔椎间隙狭窄的发生率为50%。实验兔L5~6椎间隙模糊、变窄[17]。MRI可在人类布鲁杆菌病性脊柱炎病变的早期发现病灶、确定病变确切范围,较其他任何影像学检查技术均敏感[18]。与人类布鲁杆菌病性脊柱炎表现相似,MRI能够早期发现实验兔造模椎体上端、前缘炎症变化及椎间盘破坏信号[19]。但由于兔的椎体细小、且椎体皮质骨炎症反应轻,表现为等信号或稍低信号,加之周围软组织信号干扰,故MRI对早期病变椎体进行分辨较困难,但对邻近椎间盘破坏信号表现异常的显示较清晰。
三、兔布鲁杆菌病性脊柱炎模型的组织病理学特征及病原学检查
布鲁杆菌病性脊柱炎局部病理变化与其他部位的布鲁杆菌病病变相似,其病理变化与细菌的数量、毒力及机体的免疫力有关。本研究实验兔组织标本病理检查,可见病变区椎旁软组织均有病变组织细胞增生及以淋巴细胞为主的炎性细胞浸润,未见到多核巨细胞反应和典型增生性结节,这可能与病程时间短、破坏较轻有关。布鲁杆菌培养是诊断兔布鲁杆菌病性脊柱炎的“金标准”[20]。但由于受改良罗氏培养基培养的阳性率低、时间久所限,不能完全准确判定。
四、本研究的不足之处
本研究未进行多批次不同菌株量注入的对比研究,对菌株量的控制尚存在不足;本研究未进行血清滴度试验。
本研究通过在新西兰大白兔的椎体种植M5羊种布鲁杆菌弱毒苗标准菌株,结合X线摄影、CT重建、MRI、组织病理学、细菌学培养等综合检查,结果说明成功建立了与人类布鲁杆菌病性脊柱炎病理变化相似的兔布鲁杆菌病性脊柱炎模型。该动物模型具有造模方法简单、菌株量注入易控制、重复性强、同组实验动物病变的个体差异小、病变较一致等优点。但是,由于布鲁杆菌毒力、菌量,以及感染动物的免疫力、实验室条件限制,建立更加标准的布鲁杆菌病性脊柱炎模型,提高建模成功率,保证生物安全性,尚需做更进一步的研究。
