前列腺中央带前列腺癌与前列腺增生MRI弥散加权成像的多b值分析
2018-08-03广东省东莞市樟木头医院放射科广东东莞523633
1.广东省东莞市樟木头医院放射科(广东 东莞 523633)
2.广东省东莞市人民医院放射科
(广东 东莞 523000)
邱英良1 郑晓林2 邹玉坚2范宪淼2
前列腺癌和前列腺增生是我国中老年男性发病率最高的疾病[1],其中前列腺增生主要发生于中央带的移行区,同时有25%的前列腺癌发生于此处。在临床上,这2种疾病的治疗方案和预后完全不同,明确诊断是关键。MRI具有较高的组织分辨率,临床广泛认为是目前前列腺疾病最佳的诊断方法;但因为前列腺癌的细胞密度大、列腺中央带的良恶性病变均有丰富的血供,故发生在中央带的前列腺癌与增生在MRI的T2WI均呈低信号,两者动态增强表现也相似,难以鉴别。本文对发生于前列腺中央带的癌和增生进行多b值弥散加权成像(diffusion weighted imaging,DWI),通过观察、分析两种病变从低b值到高b值的信号强度,探讨其变化规律,同时比较病变的高b值表观弥散系数(apparent diffusion coefficient,ADC)值的差别,旨在提高鉴别诊断的能力。
1 材料和方法
1.1 临床资料回顾性分析本院于2016年12月至2017年10月行前列腺MRI患者的临床资料,均为男性。前列腺癌15例,年龄63~87岁,平均年龄(72.60±6.52)岁,全部患者经手术和分段法穿刺活检获得组织病理学证实。前列腺中叶增生75例,年龄61~86岁,平均年龄(72.36±7.92)岁,21例患者经手术和分法穿刺活检获得组织病理学证实,其余患者临床资料与影像学检查齐全,间隔6-12月复查,病变无变化。患者临床表现为排尿困难、排尿不尽,下腹部不适等表现,前列腺指诊提示前列腺增大。前列腺癌患者PSA为(76.33±147.99)ug/ml,前列腺增生PSA为(14.25±12.62)ug/ml,2组患者75%PSA分别为(?±147.99)ug/ml(见表1)。本研究经医院伦理委员会批准,病人被知情告知和同意。
1.2 MRI扫描方法采用SIEMENS MAGNETOM Verio 3.0T磁共振扫描仪和体部相控阵线圈行前列腺MRI,扫描范围从精囊腺上缘至耻骨联合下方,包括整个前列腺。扫描序列:T1WI(fast low angle shot gradient echo,FLASH)、T2WI(half-fourier,HASTE)和及小视野高分辨率T2WI(快速自旋回波序列,TSE),参数为TR/TE=4000ms/101ms,带宽=200Hz/像素,FOV(read)=180~200mm,FOV(phase)=100%,层厚3mm,距离因子30%,矩阵288×384,翻转角150°,激励次数2。
弥散加权成像(diffusion weight imaging,DWI),平面回波的自旋回波序列,参数为TR/TE=4000ms/101ms,带宽=200Hz/像素,FOV(read)=180~200mm,FOV(phase)=100%,层厚3mm,距离因子30%,矩阵288×384,翻转角150°,激励次数2。选用9个b值,具体为0,50、100、150、200、400、600、800和100s/mm2,一次成像,以b=0s/mm2比b=1500s/mm2自动生成ADC图。
再行多期动态增强扫描,采用改良后的动态3D VIBE三维容积式内插值法屏气检查(volumetric interpolated breath-hold examination,VIBE),参数为:TR/TE=5.21ms/1.74ms,翻转角15°,带宽=260Hz/像素,FOV(read)=260mm,FOV(phase)=100%,层厚3mm,矩阵192×168。每期采集时间8.5秒产生18幅图像,层厚3mm,距离因子20%,共采集20期,于第3期扫描末注入对比剂,全程扫描时间需170s。使用MR专用双筒高压注射器,经肘正中静脉将对比剂注入,剂量0.3mmol/kg体重,流率3ml/s,并用同速率生理盐水15ml冲管。将多期动态增强图像传入工作站,应用meancurve软件对感兴趣区画取动态增强曲线。随后行大范围的3D VIBE 序列延迟扫描,参数为TR/TE=3.92ms /1.39ms,翻转角9°,带宽=400Hz/像素,FOV(read)=380mm,FOV(phase)=90%,层厚3mm,矩阵320×240。
1.3 图像分析患者纳入要求:患者均行所设定的9个b值DWI成像。小视野T2WI及DWI图像清晰。前列腺癌患者需经组织病理学证实,前列腺增生患者经组织病理学或有完整的临床资料证实。而手术治疗及穿刺后的MRI检查和图像不清晰者被剔除。
1.3.1 分组:将患者分为前列腺癌和前列腺增生2组。
1.3.2 测量每组各个患者不同b值下的病变DWI的信号强度,测量时兴趣区足够大,但又需避开病变边缘;在T2WI上选择病变,于DWI图像上复制相应层面进行测量,以保证测量层面的准确性。计算各信号强度的平均数和标准差。对2组患者同一b值的信号强度进行差异性比较;2组患者相b0-b200、b200-b1000和b0-b1000(单位:s/mm2)的信号强度之差进行比较。
1.3.3 对2组患者b值大小与信号强度值进行相关分析,计算相关系数及绘制散点图,以观察其(信号强度与b值大小)走向的规律性。
1.3.4 在b=0s/mm2与b=1000s/mm2的ADC图上测量病变的ADC值,并比较前列腺癌和前列腺增生ADC的差异性。
1.3.5 统计学处理使用SPSS 16.0版本软件,不同b值的信号强度和ADC值用独立样本t检验,b值与信号强度相关性用pearson相关分析。设P<0.05具有统计学差异。
2 结 果
于T2WI序列,前列腺中央带前列腺癌呈低信号,与T2WI低信号增生结节信号相似(图1、图4)。DWI序列,前列腺癌与增生结节均呈高信号,随着b值增高,两者信号强度均逐渐减低,其中前列腺增生信号强度减低程度高于前列腺癌,在b=1000s/mm2时,前列腺癌信号仍较高,而增生结节信号强度减低至与周围组织相仿,不分不能辨认(图2-3、5-6),两者于b值>200s/mm2情况下信号强度具有显著性差异,2组病变在不同b值时的信号强度与比较结果见表2。2组病变相邻b值下的信号强度之差,前列腺癌信号强度差值均低于前列腺增生信号强度差值,部分具有显著性差异,以b0-1000s/mm2之间差异最明显(见表3)。

表1 前列腺癌与前列腺增生的年龄与PSA情况

表2 2组病变在不同b值时的信号强度与t检验结果
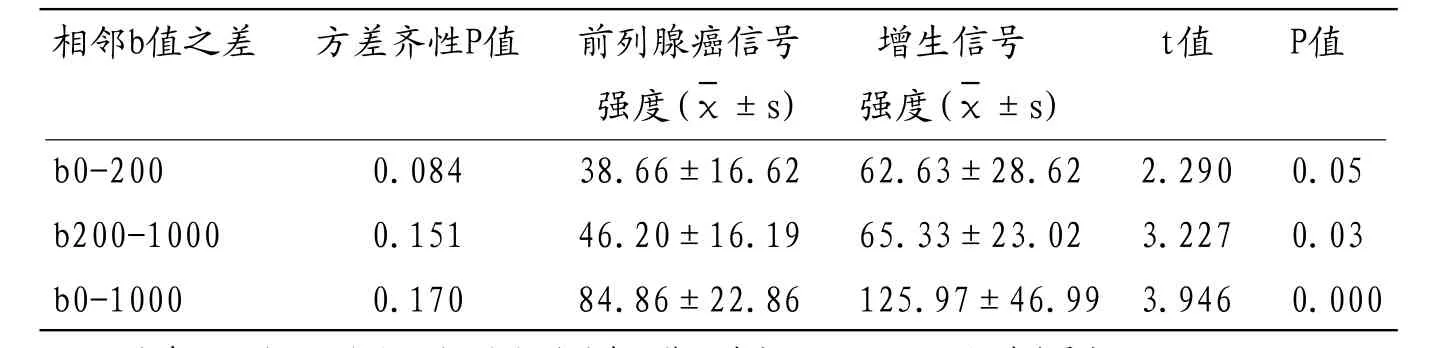
表3 2组病变相邻b值下信号强度之差及t检验结果
测量b0s/mm2与b1000s/mm2之间生成的ADC图,所得前列腺癌ADC值明显低于前列腺增生,分别为(0.79±0.15)mm2/s,为(1.16±0.15)mm2/s,具有显著性差异(t=6.62,P=0.00)。
2组病变的b值与信号强度具有负相关性(图5-6、图7),散点图所示,前列腺癌信号强度随b值增大下降幅度小于前列腺增生,前者相关系数r=-0.952,后者相关系数r=-0.960,即以前列腺增生负相关较明显。
3 讨 论
虽然前列腺癌主要发生于周围带,但据文献统计和手术、穿刺活检证实,有25%的前列腺癌位于中央带[1]。由于前列腺癌的细胞排列致密,MRI中T2WI常表现为低信号,此表现被作为诊断的重要征象之一[2-3]。前列腺中央带增生的病理组织学类型分为腺体增生、纤维组织增生、平滑肌增生,其中纤维组织增生型与平滑肌增生型的结节于T2WI也表现为低信号,且动态增强表现与前列腺癌表现相似[2],故造成诊断与鉴别诊断发生困难。DWI是反映组织水分子扩散状态的序列,能敏感地检出病变,及能根据组织水分子弥散状态的不同对良、病变进行鉴别,在临床应用上具有较高的价值[4-5]。DWI最重要的参数是弥散敏感因子b。传统的DWI常用b0与某一大小的b值进行诊断,但该方法具有一定的局限性,因为它不能确切、全面地反映组织的弥散状态[6]。目前的研究已表明[7-8]在多b值的DWI中,低b值的DWI成像主要反映的是像素内快速弥散成分即毛细血管内与细胞外液的水分子弥散状态;高b值DWI成像反映的是像素内慢弥散,即细胞内水分子的弥散状态。本作者推测如果组织的病理性质不同,例如中央带前列腺癌与前列腺增生,在多b值成像中,两者的信号强度是应该也具有差别,或有哪些各自的变化规律,在此方面文献少有报道。故本文将12个b值应用于前列腺中央带的癌和增生这2种病变,比较信号强度的差别与其变化规律,使前列腺疾病的MRI诊断得到补充。
通过分析、比较,本作者发现随着b值增高,2种病变与正常组织的信号强度均逐渐下降,b值1000s/mm2时,前列腺癌尚表现为较高信号,但增生结节和正常结构信号明显降低,显示不清。对2种病变同一b值时的信号强度进行比较发现,在b0-b150s/mm2(低b值),2种病变的信号强度无统计学的差异,而从b200至b1000 s/mm2(中、高b值),前列腺癌的信号强度明显高于前列腺增生的信号强度,差异具有统计学意义。为了进一步说明本研究结果的可靠性,作者将低b值段、中高b值段和最低b值和最高b值的信号强度之差进行比较,结果是后2项的差别具有统计学意义,表明前列腺癌的信号强度在中、高b值时下降幅度明显低于前列腺增生,以上2种比较结果一致。同时还计算b0与b1000s/mm2之间的ADC值,经比较后,结果是前列腺癌明显低于前列腺增生结节。在前列腺癌与增生结节b值大小与信号强度的相关分析中,可见2种病变均有高度的相关性,但增生结节的相关系数在数值上大于前列腺癌,散点图能显示2种病变在中高b值的信号强度分布具有不同,相对于前列腺增生,前列腺癌呈较平坦、下降缓慢的趋势。

图1 男,64岁,前列腺中央带左侧前列腺癌,小视野T2WI,病变呈低信号结节(箭头)。图2-3 与图1为同一层面DWI,b值大小依次为b0、b50、b150、b200、b400、b600、b800、b1000s/mm2,箭头所指的癌结节随b值增大信号强度减低程度较小,于b1000s/mm2仍呈较高信号。图4 男性,79岁,前列腺中央带左侧前列腺增生,小视野T2WI,病变呈低信号结节(箭头)。图5-6与图4为同一层面DWI,b值大小依次为b0、b50、b150、b200、b400、b600、b800、b1000s/mm2,箭头所指的增生结节随b值增大信号强度减低程度较明显,于b1000s/mm2仍结节与周围腺体信号相等,分辨不清。图7 前列腺癌随b增大的信号强度散点图,信号减低趋势幅度较小。图8 前列腺增生随b增大的信号强度散点图,信号减低趋势幅度较大。
对于MRI常规序列和和动态增强表现类似的前列腺中央带的良、恶性病变,有关鉴别诊断的文献报道较多,其中多序列、多参数成像被认为是有价值的方法[3],但各序列的良、恶性病变征象均有重叠,难以完全鉴别。在DWI方面,有研究结果指出ADC值对前列腺癌分级有帮助[9-10],认为ADC值随着恶性程度增高而降低。另有文献报道[10]高b值(b=2000mm2/s)对前列腺癌显示较清楚,与本文的部分观点相似,但本组资料中,取b值高达b=1000mm2/s,组织信噪比和信号强度较低,故没有取更高的b值观察。用多b值应用于前列腺成像,类似本文的方法进行一系列信号强度分析尚未见报道。本文主要从多b值状态下的信号强度变化进行细致的分析,目的是观察2种病变的信号强度的变化趋势,通过信号强度的变化来探讨病变的性质。在低b值,2种病变信号强度无显著性差异,分析是低b值包含有细胞外水分子、血管内水分子及细胞内水分子信号组成,具有一定的T2透射效应[8],故单凭信号强度无法反应组织特性,有必要在低b值时用特殊的方法将2种病变的细胞内外弥散状态进一步分开,可为前列腺良、恶性病变鉴别提供更多的信息,目前在脑部和鼻咽等部位已有的初步的研究[6,8]。在组织学上,前列腺癌的细胞密度高,细胞外间隙小,细胞内含水丰富,与前列腺增生不同,而中、高b值主要是反映的细胞内的水分子弥散状态,故在中、高b值时,前列腺癌信号强度明显高于增生结节,即前列腺癌弥散受限程度明显高于增生结节,整是反映了病变性质的差异。
本作者认为b值和信号强度是2个重要因素,经观察比较,发现前列腺中央带癌和增生结节在不同b值信号强度的变化有各自的规律,即在中、高b值具有明显的差别,随着b值的增高,前列腺癌的信号强度明显高于增生结节。在b值高达1000s/mm2时,前列腺癌仍然保持较高信号,而前列腺增生几乎无法分辨。本结果在鉴别上具有重要应用价值。同时也提示对低b值进一步研究的必要性。本研究存在的局限性是前列腺癌的病例数相对较少,信号测量值差异性较大,稳定性欠佳,需要收集更多的病例进行分析。本文也没有对低b值的信号特点做进一步研究,相信如果考虑低b值的血流因素,对前列前中央带的良、恶性病变鉴别更有帮助[11-13]。