鲜湿米粉中两种乳酸链球菌素的HPLC-MS/MS检测方法
2018-08-02刘珈伶蒋定之陈宁周
刘珈伶,廖 强,蒋定之,陈宁周
(广西-东盟食品药品安全检验检测中心,广西 南宁 530001)
乳酸链球菌素(Nisin),又称乳链菌肽,是乳酸链球菌代谢产物中一种具有活性的抗菌蛋白或多肽[1],由34个氨基酸残基组成,能够有效抑制大多数革兰氏阳性菌和部分革兰氏阴性菌[2-3],1969年联合国粮农组织/世界卫生组织(FAO/WHO)确认Nisin可用作食品防腐剂[4]。Nisin对蛋白水解酶极敏感,食用后迅速酶解成氨基酸,对人体无毒副作用[5],已在全球60多个国家和地区作为食品添加剂广泛使用。我国卫生部于1990年批准使用,GB 2760《食品安全国家标准 食品添加剂使用标准》对食品中乳酸链球菌素允许使用的范围和限量进行了规定。Nisin主要应用于鲜乳及乳制品、肉及肉制品、罐头食品、烘焙食品、饮料等食品保鲜[6],在化工[7-8]和医药[9]等领域显示了巨大的应用潜力。
迄今已发现A、F、Q、U和Z 5种Nisin,其中以Nisin A和Nisin Z的研究最多,二者结构相似,仅第27 位氨基酸残基不同,Nisin A 为组氨酸,而 Nisin Z为天冬酰胺[10]。食品中Nisin的检测方法有抑菌活性法、免疫学法、生物荧光法及其他方法。抑菌活性法包括比浊法[11]、琼脂扩散法[12]等,其中我国目前执行的GB 1886.231《食品添加剂 乳酸链球菌素》[13]中采用的方法为美国FCC琼脂分散法;免疫学法有酶联免疫吸附法[13]、斑点免疫印迹法[14]、多克隆抗体酶联免疫吸附法[15]等;生物荧光法有ATP生物发光测定法[16]、生物传感器检测法[17]等;其他方法包括高效液相色谱法[18]、分光光度法[19]等。但上述方法存在操作繁琐,检测时间长,特异性、专属性弱,准确性、精确性及重复性低的缺点,无法准确鉴别Nisin的种类。
液相色谱-质谱联用法具有特异性好和灵敏度高的特点,电喷雾电离源(ESI)易形成多电荷离子,特别适于分析极性强的大分子有机化合物[21]。多重反应监测模式(MRM)可实现一次质谱进样对几百乃至上千个目标肽段进行分析[22]。近年来应用液相色谱-质谱联用技术分析检测培养液[23]、乳酪和牛奶[24-27]中Nisin也有报道,国际标准化组织(ISO)标准[28]还规定了乳酪中Nisin A的LC-MS和LC-MS/MS检测方法。目前,在我国使用液相色谱-质谱联用法测定Nisin尚属空白。本文建立的HPLC-MS/MS快速测定鲜湿米粉中Nisin A和Nisin Z的方法,具有高效、准确、可操作性强的特点,可为复杂基质中多种生物防腐剂的检测研究及标准制定提供理论基础。
1 实验部分
1.1 材料、试剂与仪器
鲜湿米粉样品购自广西南宁市区内部分超市、便利店及零售摊点。
Nisin A标准品(C143H230O37N42S7,生物试剂)、Nisin Z标准品(C141H228O38N41S7,生物试剂)均购于上海源叶生物科技有限公司;甲酸(色谱纯,美国Fisher公司);乙腈(色谱纯,德国Merck公司);实验用水为Milli-Q纯水仪制备的超纯水(电阻率18.2 MΩ·cm);pH 3.0的水为用甲酸溶液将超纯水调至pH 3.0±0.1而得。除特殊注明外,所用试剂均为分析纯,所配溶液均为水溶液。
AB SCIEX TRIPLE QUAD 4500高效液相色谱-三重四极杆串联质谱仪(美国AB SCIEX公司);Heraeus MultifugeX3R型高速冷冻离心机(美国Thermo公司);ML204型分析天平(感量0.000 1 g,瑞士Mettler-Toledo公司);Rotavapor R-210型旋转蒸发仪(瑞士Buchi公司);Vortex Genie 2型涡旋振荡器(美国Scientific Industries公司)。
1.2 标准溶液的配制
精密称取乳酸链球菌素Nisin A、Nisin Z标准品各10 mg,分别置于10 mL容量瓶中,加pH 3.0的水溶解并定容至刻度,摇匀制得标准储备液,于4 ℃冰箱储存。精密移取各标准储备液0.1 mL,置于同一10 mL容量瓶中,用pH 3.0的水稀释并定容至刻度,摇匀制得质量浓度为10 mg/L的混合标准工作液。精密移取混合标准工作液适量,用空白基质溶液制成质量浓度分别为100、200、400、800、1 000、1 500、2 000 μg/L的混合标准溶液,临用现配。
1.3 样品前处理
取试样5 g(精确至0.000 1 g)置于50 mL离心管中,加10 mL pH 3.0的水溶液,涡旋1 min,放置30 min后,振摇涡旋5 min,4 500 r/min离心5 min,取上清液过0.22 μm滤膜,取滤液待上机分析。
1.4 高效液相色谱条件
色谱柱:ZORBAX Hilic Plus柱(2.1 mm×100 mm,1.8 μm);柱温:35 ℃;流动相:0.1%甲酸(A相)、乙腈(B相);梯度洗脱程序:0~3 min,80%~10%A;3~6 min,10%A;6~6.1 min,10%~80%A;6.1~9 min,80%A。流速:0.3 mL/min,进样量:10 μL。
1.5 质谱条件
电喷雾离子源;离子源温度:600 ℃;干燥气压力:50.0 psi;气帘气压力:35.0 psi;气帘气流速:30 L/min; 碰撞气流速:6 L/min; 辅助气流速:50 L/min;喷雾电压:5 500 V;扫描方式:正离子扫描;检测方式:多反应监测(MRM);采集窗口:全段采集;驻留时间:100.00 ms; 其他参数见表1。

表1 乳酸链球菌素的质谱参数Table 1 Multiple reaction monitoring parameters of Nisin
*quantitative ion
2 结果与讨论
2.1 样品前处理方法的优化
首先采用C18、HLB和PRiME HLB 3种固相萃取柱考察了固相萃取法对阴性加标样品(质量浓度1 000 μg/L)的提取净化效果,结果显示,Nisin A和Nisin Z均完全吸附于小柱上难以洗脱。随后又分别考察了单独采用不同极性有机溶剂饱和正丁醇水溶液和二氯甲烷对加标样品的提取效果,结果发现上述溶剂对该测定体系的提取效果也极差。已有研究表明,Nisin A和Nisin Z耐酸性和耐热性优良,但在中性或碱性条件下即发生失活,在pH 2.0条件下,可耐受高温处理且无活性损失[29]。随着 pH值的升高,Nisin的溶解度大幅降低,当pH 8.0时难溶于水。因此实验考察了Nisin A和Nisin Z在pH 2.0~3.0的乙酸或甲酸水溶液中的溶解度。结果显示,两种乳酸链球菌素在该条件下溶解性良好,考虑到pH 2.0的溶液酸性过大,不利于质谱维护,且乙酸的提取效果和离子化效果均比甲酸差,最终选择用pH 3.0的甲酸水溶液涡旋提取样品5 min。
2.2 高效液相色谱条件的优化
比较了CAPCELL PAK C18柱(MGⅢ-H)、Hypersil Gold C8柱、ZORBAX Hilic Plus柱等液相色谱-质谱分析中常用色谱柱的分离效果,结果显示Hypersil Gold C8柱因保留时间较短,仅能分析Nisin A,且母离子为m/z567.1,子离子为m/z373.2和m/z431.0。CAPCELL PAK C18和ZORBAX Hilic Plus色谱柱均可分析Nisin A和Nisin Z,但CAPCELL PAK C18柱保留时间短,响应低;ZORBAX Hilic Plus柱为亲水作用色谱柱,适于分析强极性和强亲水性物质,对Nisin A和Nisin Z的峰形尖锐,保留时间延长至3 min后,分离度更好,实验最终选择ZORBAX Hilic Plus柱为分析柱。由于Nisin属于大分子多肽,谱峰难以达到完美的对称,实验调整了流动相A中的甲酸浓度,并使用5~10 mmol/L乙酸铵增强离子化效果,扩大峰值的保留时间,调整谱峰对称。实验结果显示,使用不同浓度乙酸铵调节的效果不理想,子离子峰仍出现分叉;而0.1%甲酸-乙腈为流动相时峰形对称,保留时间适当。实验最终选择流动相为0.1%甲酸-乙腈。
2.3 基质效应的影响
分别考察了空白溶剂、样品提取液在200、 1 000、1 800 μg/L 3个加标水平下的基质效应。结果表明,Nisin A和Nisin Z在提取液中均存在严重的基质抑制效应,其中以空白溶剂的回收率为基准,提取液Nisin A的回收率减少了53%,提取液Nisin Z的回收率减少了58%。由于本文未采用净化处理,且目前市面上未见有Nisin A和Nisin Z的同位素内标,为减少基质效应对定量结果的影响,本方法采用基质标准溶液校正的方式对定量结果进行校正。
2.4 质谱条件的优化
Nisin分子结构中包含氨基丁酸(ABA)、脱氢丙氨酸(DHA)、R-甲基脱氢丙氨酸(DHB)、羊毛硫氨酸(ALA-S-ALA)和己-甲基羊毛硫氨酸(ALA-S-ABA)5种稀有氨基酸,活性分子常为二聚体或四聚体,在ESI源强电场作用下酸性溶液中的Nisin A和 Nisin Z容易质子化,形成稳定的多重电荷离子。分别配制500 μg/L的Nisin A和 Nisin Z标准溶液用针泵连续直接进样,优化了喷雾电压、离子源温度、气帘气、碰撞气、辅助加热气、去簇电压、碰撞气能量等质谱参数,以确定化合物的母离子和子离子。实验监测了Nisin A和Nisin Z的[M+4H]4+及[M+5H]5+峰,发现[M+5H]5+的质荷比更高,对于多个带电分子的分析而言,质荷比越高特异性越强,因此实验选择的子离子质荷比大于母离子,并以强度较大的子离子作为定量离子,以强度略小的子离子作为定性离子。图1为阴性样品中添加200 μg/L Nisin A和 Nisin Z混合标准溶液后的总离子流图,图2为一阳性样品的MRM定量离子色谱图。

图1 阴性样品中添加Nisin A和Nisin Z混合标准物溶液的总离子流图(200 μg/L)Fig.1 Chromatogram of blank sample spiked with Nisin A and Nisin Z(200 μg/L)

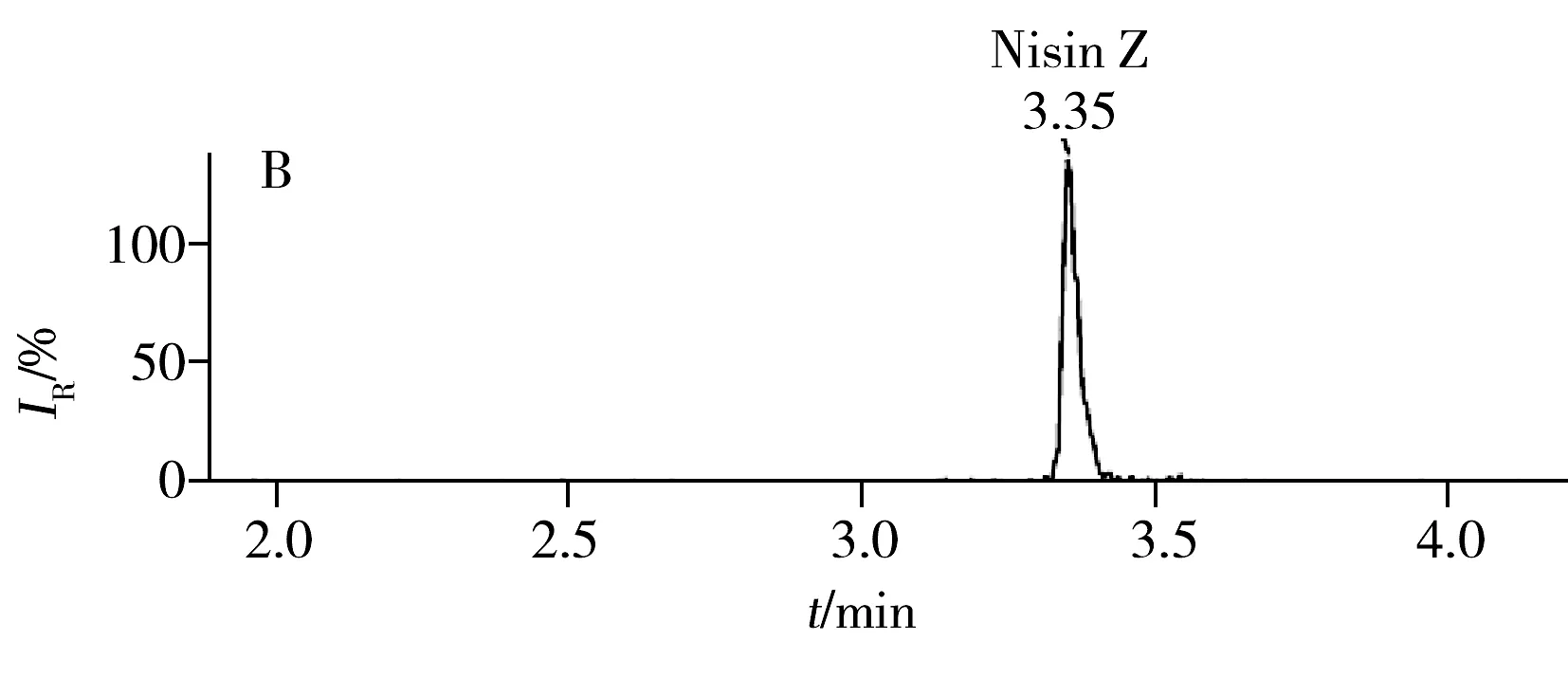
图2 阳性样品中Nisin A(A)和Nisin Z(B)的MRM定量离子色谱图Fig.2 MRM chromatograms of Nisin A(A) and Nisin Z(B) in a positive sample
2.5 分析方法评价
2.5.1线性关系与检出限以系列标准溶液进样,每个浓度进样3次,以各组分峰面积(y)为纵坐标,标准溶液的质量浓度(x,μg/L)为横坐标绘制标准曲线。结果显示,Nisin A和Nisin Z在100~2 000 μg/L质量浓度范围内线性关系良好,线性方程分别为y=36.265x+697.77和y=63.228x+1 796.3,相关系数(r)均大于0.999。但因LC-MS/MS的响应值是绝对响应值,基线噪音较高,流动相的噪音已在103以上,因此本实验中线性方程的截距较大。根据对空白基质的测定确定噪声,以3倍信噪比(S/N=3)计算方法检出限,平行测定3次,取平均值。测得Nisin A和Nisin Z的检出限分别为0.01、0.02 mg/kg。
2.5.2回收率与精密度分别取10 mg/L混合标准工作液0.20、1.00、1.80 mL,加至5 g空白样品中,按样品同法处理,最终定容至10 mL,各水平平行测定6次,回收率结果如表2。Nisin A和Nisin Z的回收率为95.6%~107.0%,相对标准偏差(RSD)为0.2%~1.9%。说明本方法检测结果可靠。以400 μg/L的混合标准曲线溶液连续重复进样6次,测得RSD均小于2.0%,说明本方法所得检测结果重现性好。

表2 Nisin A和Nisin Z的回收率与相对标准偏差Table 2 Recoveries and relative standards of Nisin A and Nisin Z
2.5.3稳定性实验取10 mg/L混合标准工作液1.00 mL,加入空白样品中,按样品同法处理并定容至10 mL,室温下储存,并于制备后0、2、4、8、12 h进行测定,每个时间段平行测定3次。结果显示,Nisin A的质量浓度为979.558~1 000.402 mg/L,RSD为0.85%;Nisin Z的质量浓度为986.927~1 006.954 mg/L,RSD为0.79%,表明供试品溶液在12 h内稳定。
2.6 实际样品的测定
采用本法对市售20批鲜湿米粉样品进行测定,样品类型涉及即食类鲜湿米粉和非即食类鲜湿米粉的切粉(河粉、卷粉)和榨粉(圆粉)。结果有2批样品检出Nisin Z(含量分别为1.7、1.9 mg/kg),1批样品检出Nisin A(含量为2.2 mg/kg),其余均未检出。检出Nisin的批次占总批次的15%,检出Nisin的3批次样品均为保质期大于3个月的即食类鲜湿米粉。本次检测结果显示,鲜湿米粉类产品中有添加乳酸链球菌素的现象。
3 结 论
本文建立了高效液相色谱-三重四极杆质谱测定鲜湿米粉中两种常见Nisin的检测方法。以酸性溶液提取Nisin,以亲水作用色谱柱Hilic Plus柱作为分析柱提高了分离效果,多反应监测模式(MRM)增强了离子的选择性、抗干扰能力和专属性。本方法简单、快捷、准确,所得检测结果满意,并首次实现了将液相色谱-质谱联用技术应用于米粉中微生物防腐剂的检测。方法也适用于醋、酱油等食品中乳酸链球菌素的检测,可为食品安全标准的制定及风险监测工作提供技术支持。
