基于双定性原则的高效液相色谱-二极管阵列检测法分析中药组分
2018-08-02杨三东赵海青谈义萌夏明珠
唐 涛, 杨三东, 赵海青, 谈义萌, 封 娇, 夏明珠, 李 彤*
(1. 南京理工大学工业化学研究所, 江苏 南京 210094; 2. 大连依利特分析仪器有限公司, 辽宁 大连 116023; 3. 大连市色谱工程技术研究中心, 辽宁 大连 116023)
液相色谱法是20世纪发展起来的重要分析方法,被广泛应用于环境监测、食品安全、药物分析等领域[1-3]。但是,随着样品复杂程度的增加,液相色谱的定性能力受到了越来越大的挑战,根据色谱保留时间定性容易受杂质干扰、出现假阳性。以中药组分分析为例,中药的疗效主要取决于有效成分的种类及含量,通常以其中某个组分的含量作为质量控制点。在2015版《中国药典》一部[4]中,新增和修订的957个中药品种有569个涉及液相色谱法,大部分以被测组分的保留时间作为定性依据。但由于中药成分十分复杂,又经过多种配伍,存在与目标组分保留时间基本一致或相近的干扰物,采用液相色谱紫外-可见检测法可能引起定性和定量结果的错误[5]。因此,如何提高液相色谱法的定性能力是近年来仪器分析领域的研究热点之一。
提高色谱系统的分离能力,包括利用亚2 μm的超高效液相色谱[6]、使用具有超高柱效的超长色谱柱[7]及多维分离技术[8,9]等,可以降低定性的难度,但没有真正提高系统的定性能力。另一种方式利用更多的联用技术,包括液相色谱-质谱[10]、液相色谱-核磁共振[11]、液相色谱-原子荧光[12]等,这些方法在研究领域报道较多,但这几类检测器都十分昂贵,普适性不高,推广难度较大。二极管阵列检测器(DAD)作为较成熟的检测器已被多个国外厂家和少数国内厂家商品化,具有同时输出全波段色谱图和实时扫描光谱的功能[13]。Bitas等[14]采用HPLC-DAD法,在255和275 nm条件下完成了虾中6种喹诺酮类药物残留的检测;Ricciutelli等[15]利用二极管阵列检测器获取6个波长的色谱信息,同时定量检测9种橄榄油中的多酚物质。但在应用方面,二极管阵列检测器往往只是被作为一个多波长的、甚至普通的紫外-可见检测器使用,光谱功能在定性上的应用报道不多。在我们的前期工作[16]中,成功研制了二极管阵列检测器,具有良好的仪器研制基础。
基于自构建的新型二极管阵列检测器及其高分辨的光谱扫描功能,以色谱保留时间结合样品吸收光谱图为定性原则,对中药样品进行了分析,有效避免了假阳性结果,为中药组分分析提供了参考方法。
1 实验部分
1.1 仪器、试剂与材料
iChrom 5100高效液相色谱系统,配置有二极管阵列检测器(自构建)、P5102二元高压恒流泵、M5102系统组织器、S5101自动进样器、O5101色谱柱恒温箱和W5100色谱数据工作站,SinoChrom ODS-BP色谱柱(200 mm×4.6 mm, 5 μm)、SinoChrom ODS-BP色谱柱(250 mm×4.6 mm, 5 μm)和SinoPak C18色谱柱(150 mm×4.6 mm, 5 μm)(大连依利特分析仪器有限公司); AE100S电子天平(瑞士Mettler Toledo公司); WB-1010A恒温水浴锅(天津奥特赛恩斯仪器有限公司); Milli-Q超纯水系统(美国密理博公司)。
五味子醇甲对照品(纯度≥99% )和金胺O对照品(纯度≥99% )(中国药品生物制品检定所);甲醇和乙腈(均为色谱纯,美国Tedia试剂公司);乙醇、磷酸二氢钾、三乙胺、碘化钠和亚硝酸钠(均为分析纯,天津科密欧化学试剂有限公司);枣仁天麻胶囊、黄柏、延胡索、黄连、菟丝子、石斛和蒲黄均为市售商品。
1.2 实验条件
1.2.1二极管阵列检测器的评价
杂散光测试:称取10.0 g碘化钠和50.0 g亚硝酸钠,分别配制10 g/L的碘化钠水溶液和50 g/L的亚硝酸钠水溶液。使用注射器将空白水溶液注入检测池,待检测器示值稳定后,扫描背景光谱;再分别注入碘化钠和亚硝酸钠水溶液,扫描透过光谱。观察碘化钠水溶液在220 nm、亚硝酸钠水溶液在340 nm是否透光,透光说明存在杂散光。
氧化钬玻璃滤光片测试:打开氘灯,等能量读数稳定,扫描氘灯光谱,记录每个光电二极管能量值En;将氧化钬玻璃置于检测池前端,稳定几秒后再次扫描光谱,记录能量值En′。计算透过率Tn=En′/En,绘制透过率曲线,并读取特征吸收值与理论值(241.6、279.2、287.6、360.6、445.6和536.3 nm),进行比较,计算偏差。
1.2.2金胺O的测试
金胺O对照品溶液的配制:称取金胺O对照品50.0 mg,用70%(体积分数,下同)乙醇水溶液溶解并定容到100 mL容量瓶中,制成500 mg/L金胺O对照品储备液。分别用70%乙醇水溶液稀释上述储备液,定容至10 mL,得到质量浓度为0.5、1.0、10.0、25.0、50和100 mg/L的金胺O标准工作液。
样品前处理:取2.0 g药材粉末样品于50 mL具塞锥形瓶中,加20 mL 70%乙醇水溶液,超声提取20 min,提取液用0.45 μm有机滤膜过滤,取滤液进样分析。
色谱条件:流动相为35∶65(v/v)的乙腈-0.025 mol/L磷酸二氢钾溶液(含0.2%三乙胺,用磷酸调pH值至3.0);色谱柱为SinoChrom ODS-BP(250 mm×4.6 mm, 5 μm);检测波长为432 nm;流量为1.0 mL/min;进样量为20 μL;温度为室温。
1.2.3五味子醇甲的测试
五味子醇甲对照品溶液的配制:称取2.3 mg五味子醇甲对照品,置于50 mL容量瓶中,纯甲醇超声溶解并定容后作为储备液。准确移取储备液2 mL于10 mL容量瓶中,用纯甲醇稀释后定容,即得9.2 mg/L的五味子醇甲对照品溶液。
枣仁天麻胶囊样品前处理方法:取装量差异下的枣仁天麻胶囊适量,混匀后研细,精密称取0.50 g粉末于100 mL具塞锥形瓶中,精确加入80%甲醇水溶液50 mL,密塞,称定重量。在80 ℃水浴中加热回流20 min,冷却至室温,再称定重量,用80%甲醇水补足减失的重量。摇匀,过滤,取滤液,即得供试品溶液。
色谱条件:流动相为55∶45(v/v)的甲醇-水;色谱柱为SinoPak C18(150 mm×4.6 mm, 5 μm)和SinoChrom ODS-BP(200 mm×4.6 mm, 5 μm);检测波长为250 nm;流量为1.0 mL/min;柱温为30 ℃;进样量为20 μL。
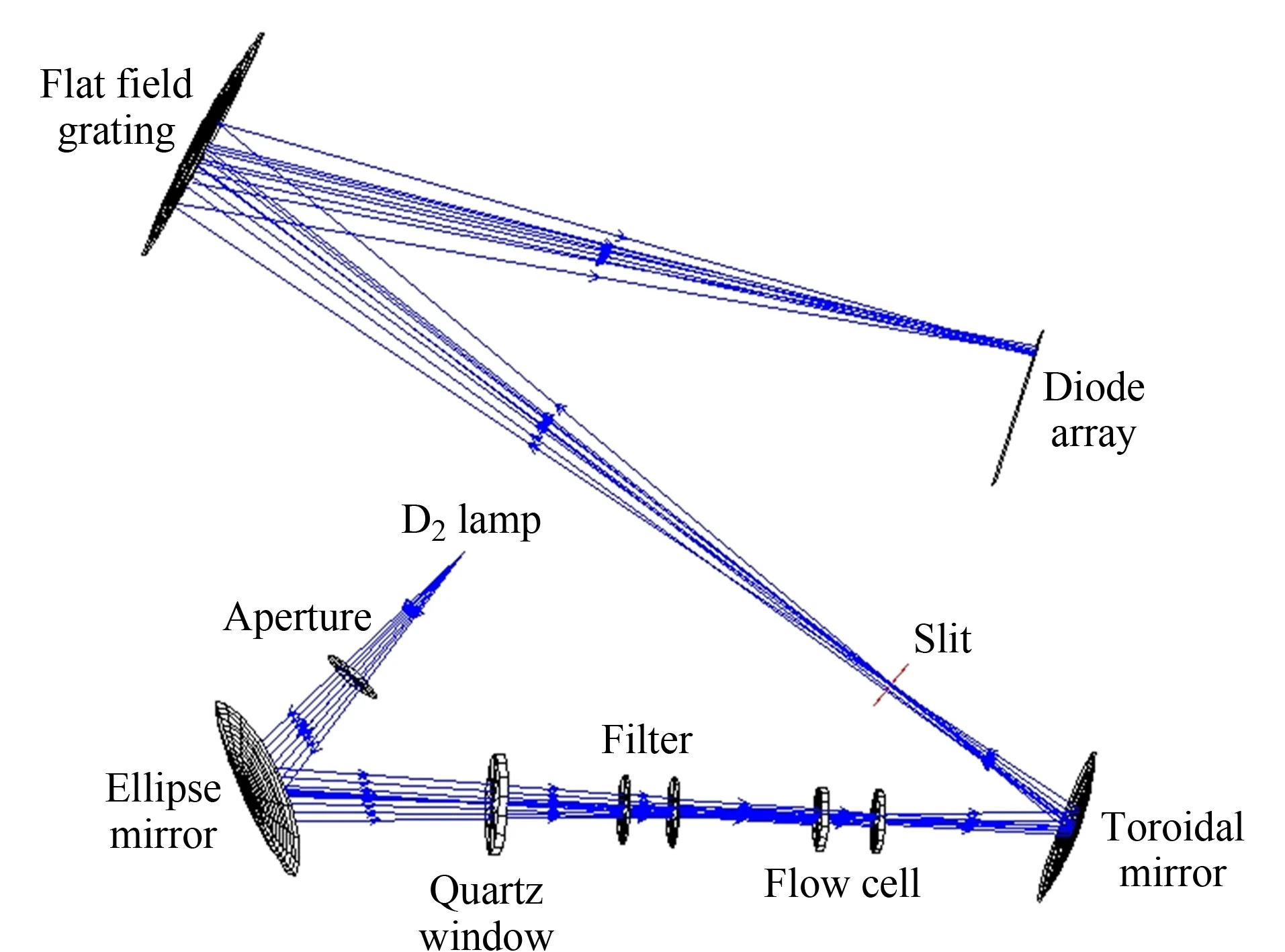
图 1 二极管阵列检测器Zemax模拟图Fig. 1 Zemax simulated diagram of diode array detector (DAD)
2 结果与讨论
2.1 二极管阵列检测器的构建与评价
以椭球镜、轮胎镜和平场光栅为主要光学件,设计并组装了一种全新的二极管阵列检测器,其Zemax光路模拟图见图1。光源和检测池分别放置在椭球镜的两个焦点位置,氘灯发出的光首先通过光阑,经过椭球镜聚焦到检测池中心;通过检测池的出射光照射到轮胎镜上,然后聚焦到狭缝,进一步经过平场光栅分光,成像到阵列探测器上;再经过光电转换成信号值。
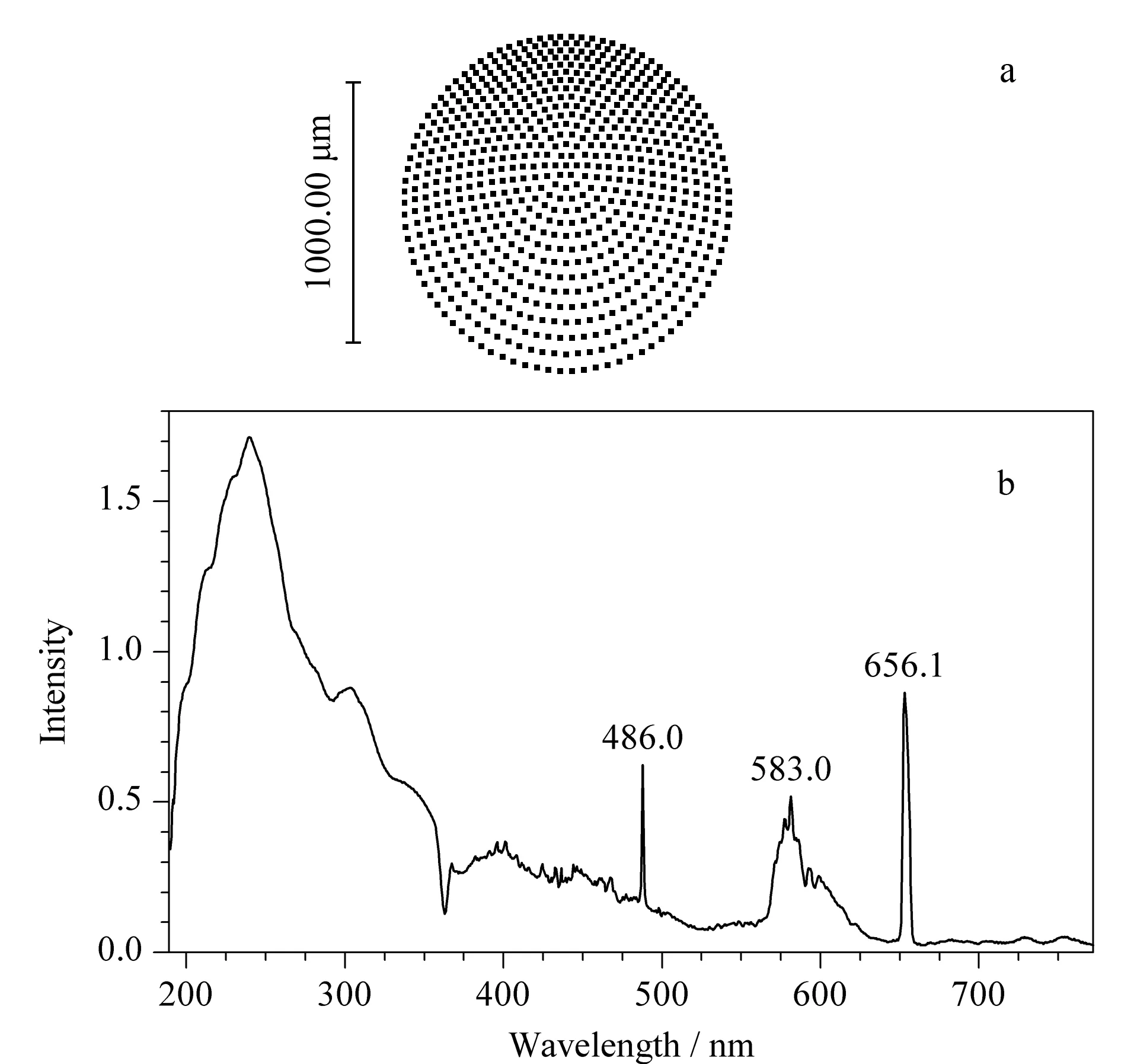
图 2 (a) Zemax成像模拟结果和(b)氘灯光谱图Fig. 2 (a) Simulation results of Zemax imaging and (b) the spectrogram of the deuterium lamp
选取氘灯光谱的3个特征波长254、486和656 nm作为输入参数,利用Zemax软件模拟光路方案成像效果,结果如图2a所示。成像光斑的均方根半径值和几何半径值均小于1 mm, 3个波长成像点位置重合,说明在理论上设计的光路没有色差,成像质量好。利用碘化钠和亚硝酸钠水溶液分别在220和340 nm测试透过率,结果显示无杂散光。传统的二极管阵列检测器,通常采用透镜组的结构,并利用多组黑挡片减弱色差对成像的影响。本文设计的二极管阵列检测器采用离轴非球面反射的原理,设计了双焦点的椭球镜和高反射效率的轮胎镜两个关键器件,从光路设计上将色差和杂散光的影响降到最低。
将氘灯置于光源位置,测试光谱图如图2b所示,特征峰486.0和656.1 nm峰形尖锐。以两点特征波长值与阵列数的对应关系进行线性拟合,得到方程为y=1.13x+186.28,y为特征波长值(单位nm),x为阵列数。进一步利用氧化钬玻璃滤光片的6点特征波长验证系统波长准确性,结果最大偏差为0.8 nm。汞灯是一种理想的多波长线光源,将其置于光源位置,测试光谱图,特征线253.7 nm的半峰宽为1.9 nm。与常规色谱用紫外-可见检测器8~10 nm水平相比,性能提高约5倍,接近商品化紫外-可见分光光度计指标,有利于采集准确的样品光谱信息,这也是利用光谱进行辅助定性的重要保障。
2.2 金胺O测试结果
金胺O是一种化学染色剂,对人体有一定毒性作用,被列为非食用物质,在中药材、中药饮片和中成药中均不得检出。但一些不法商贩将其用于劣质黄柏、蒲黄、延胡索等中药材、中药饮片的非法染色。2015年,国家食品药品监管总局曾通报了9批次中药及中药饮片检出金胺O[17]。
采用50 mg/L的金胺O标准溶液,连续5次进样,保留时间和峰面积RSD值分别为0.42%和0.79% ,说明系统稳定性良好。以标准工作液为分析对象,按质量浓度从低到高进样,以质量浓度为横坐标、峰面积为纵坐标绘制校准曲线,y=66.17x+3.35(y为峰面积,x为质量浓度,单位为mg/L),相关系数r2=0.999 9,说明该方法线性相关性良好。以3倍信噪比对应的质量浓度为仪器检出限,10倍信噪比对应的质量浓度为仪器定量限,得到检出限为0.02 mg/L,定量限为0.06 mg/L。
以市售的黄柏、延胡索、黄连、菟丝子、石斛和蒲黄为检测对象,采用1.2.2节方法进行检测,结果见图3a。以保留时间为考察指标,金胺O对照品出峰时间为12.48 min,黄柏、延胡索、黄连、菟丝子、石斛5种药材样品谱图在对应出峰时间位置均无明显出峰,说明不含金胺O。蒲黄样品谱图中12.55 min有0.58 mAU的未知组分峰检出。为进一步确证,提取了对照品和未知组分的光谱图(见图3b)。未知组分光谱图及特征吸收峰与对照品截然不同,说明未知组分不是金胺O。
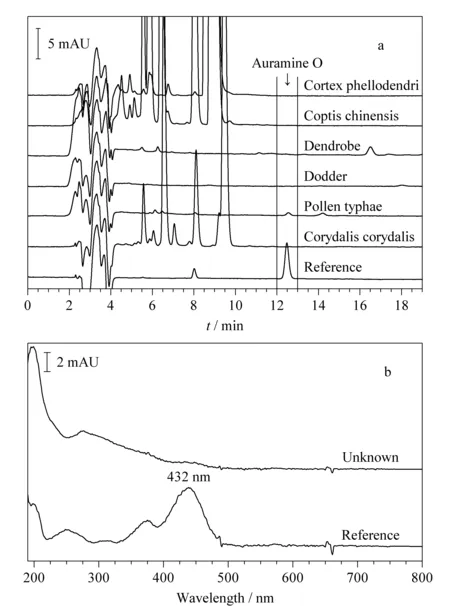
图 3 (a)金胺O对照品和中药饮片色谱叠加图和(b)金胺 O对照品和蒲黄中未知组分吸收光谱叠加图Fig. 3 Stacked chromatograms of (a) auramine O reference and herbal slices, and (b) auramine O reference and unknown component in pollen typhae
2.3 五味子醇甲测试结果
五味子是一味中药,2015版《中国药典》一部[4]中将采用液相色谱法测定五味子醇甲作为五味子含量测定的推荐方法。枣仁天麻胶囊是由酸枣仁、五味子、天麻等组成的复方中成药,主要用于改善睡眠。以市售某品牌枣仁天麻胶囊为样品,按1.2.3节方法测试,采用不同品牌的C18色谱柱分析,结果见图4。由于不同固定相作用力的差异,对照品出峰时间分别为11.29和27.41 min,样品中两个未知组分在图4a和图4b中分别与对照品出峰时间对应,疑似目标成分。
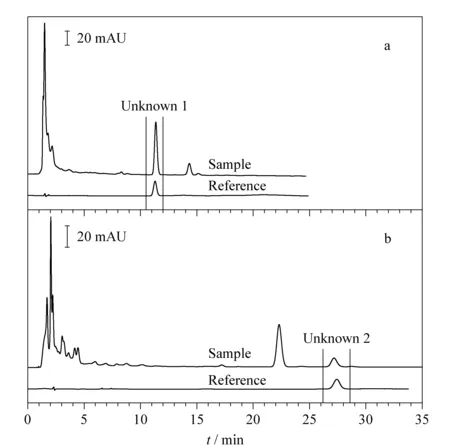
图 4 不同色谱柱分析五味子醇甲对照品和样品色谱叠加图Fig. 4 Stacked chromatograms of the schisandrin reference and the sample with different chromatographic columns a. SinoPak C18; b. SinoChrom ODS-BP.
提取对照品和样品中两个未知组分峰的光谱图,如图5所示,未知组分1在301.2 nm有明显吸收,对照品在此波长下基本没有响应;未知组分2最大吸收峰出现在209.6 nm,次大吸收峰为255.4 nm,对照品的最大吸收峰和次大吸收峰分别为217.1和252.1 nm。比对结果说明,样品中的两个未知峰均不是目标物质五味子醇甲。
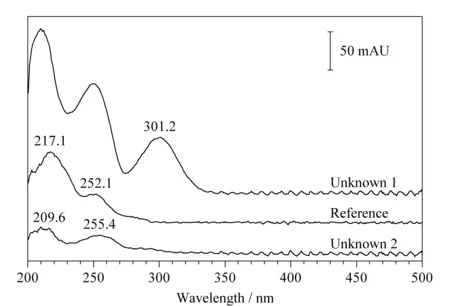
图 5 五味子醇甲对照品和样品中未知组分光谱叠加图Fig. 5 Stacked spectrograms of the schisandrin reference and the unknown components in sample
为了进一步验证,在样品中按1∶1的体积比添加对照品,使用疏水性更强的SinoChrom ODS-BP色谱柱(200 mm×4.6 mm, 5 μm),调整流动相比例,增加甲醇含量至60% ,进行分析,结果见图6。对照品的出峰时间延长至14.58 min,加标样品中五味子醇甲的峰面积与对照品的峰面积之比为1∶2。样品中的两个未知组分保留时间分别为13.58和16.14 min,实现了基线分离。提取加标样品谱图中3个色谱峰的光谱图,结果与图5中对照品、两个未知组分一致,确认未知峰不是五味子醇甲。

图 6 五味子醇甲对照品和枣仁天麻胶囊加标样品的叠加谱图Fig. 6 Stacked chromatograms of the schisandrin reference and spiked Jujube kernel Tianma capsule sample
3 结论
经典的液相色谱分析方法采用保留时间作为定性的主要依据。本文所列举的两个实例(蒲黄中的金胺O和枣仁天麻胶囊中的五味子醇甲)在常规分析中,目标物出峰位置都有未知组分峰出现。如果单以保留时间为依据,均会出现假阳性的结果,会将质量良好的蒲黄错误地认为加入了非法添加剂、将不含五味子醇甲的枣仁天麻胶囊错误地定为优质产品。因此,利用保留时间/吸收光谱双定性原则可以快捷地辨识保留时间相似的杂质峰,微调分析条件可以获得更理想的分离效果,为中药组分研究提供了普适性的参考方法。
猜你喜欢
杂志排行
色谱的其它文章
- 全二维气相色谱-质谱分析煤油基吸热型碳氢燃料烃族组成
- QuEChERS-超高效液相色谱-串联质谱法测定不同植被类型土壤中11种甲氧基丙烯酸酯类杀菌剂
- 离子液体分散液液微萃取-超高效液相色谱-串联质谱法测定食品接触材料中全氟辛酸和全氟辛烷磺酸的迁移量
- 超高效液相色谱-串联质谱法快速测定鸡蛋中氟虫腈及其代谢物残留
- 固相萃取-高效液相色谱-串联质谱法同时测定牛奶和羊奶中莫奈太尔及其代谢产物残留
- Determination of 11 synthetic musks in imported seafood by solid phase extraction and gas chromatography-mass spectrometry
