中国小麦花叶病毒(CWMV)侵染条件下小麦内参基因的选择
2018-08-02姜瑶瑶张天烨朱统泉张恒木陈剑平
吴 讷,陈 炫,姜瑶瑶,张天烨,羊 健,朱统泉,张恒木,*,陈剑平,*
(1.浙江农林大学 农业与食品科学学院,浙江 杭州 311300; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州310021; 3.浙江农林大学 林业与生物技术学院,浙江 杭州 311300; 4.驻马店农业科学院,河南 驻马店 463000)
定量PCR(qRT-PCR)是现代分子生物学中研究基因表达的重要手段之一。与传统的半定量方法和Northern杂交相比,qRT-PCR具有简便而灵敏的特点[1]。在相对定量实验的过程中,起始RNA纯度与浓度、cDNA合成和扩增效率、样品间的差异、不同的内参基因等因素均有可能影响实验的准确性[2]。为了获得更加精确的数据,研究者通常会选择一个或者多个内参基因对实验数据作均一化处理[3]。一般而言,通常稳定表达的持家基因(house-keeping genes)或核糖体RNA(rRNA)常被选作内参基因,如18S核糖体RNA(18S rRNA)、肌动蛋白基因(ACTIN)、微管蛋白基因(TUBULIN)、3-磷酸甘油醛脱氢酶基因(GAPDH)等。然而,研究显示并不存在任意条件下均普遍适用的内参,即使是上述持家基因也仅在一定条件范围内才稳定表达[4]。因此,在具体的实验条件下筛选合适的内参基因是精确定量分析的前提条件之一。
对于动植物内参基因的筛选已有诸多报道,如水稻[5]、拟南芥[6, 7]、草莓[8]、番茄[9]、杨树[10]、大豆[11]、马铃薯[12]、大白菜[13]和人[14]等。对小麦基因表达分析也表明一些持家基因也一定程度上受到时空发育特性和不同胁迫条件的影响,因此,针对不同的胁迫条件,筛选合适的小麦内参基因也尤为重要[15]。中国小麦花叶病毒(Chinesewheatmosaicvirus, CWMV)是引起小麦花叶病的重要病原之一[16],常年威胁着我国黄淮海冬小麦的安全生产。病毒侵染常影响宿主植物基因的异常表达,从而引发症状[27]。为了分析小麦重要功能基因在CWMV侵染条件下的表达模式并探索CWMV的致病机制,本研究以现存的小麦内参基因[15]为基础,通过qRT-PCR和软件分析筛选出了在CWMV侵染条件下合适的小麦内参基因,这也是有关CWMV侵染条件下小麦内参基因筛选的首次报道,所确定的小麦内参基因可为CWMV致病机理、小麦抗病机制的研究奠定基础。
1 材料与方法
1.1 材料
CWMV全长侵染性cDNA克隆载体质粒pCBT7-R1和pCBT7-R2由本实验室构建和保存[17]。烟农22品种小麦种子由烟台市农业科学院小麦研究所提供。
1.2 体外转录CWMV RNA1和RNA2
具体方法和步骤参考文献[17],首先用SpeⅠ限制性内切酶分别线性化pCBT7-R1和pCBT7-R2,纯化回收后,各取0.1 μg纯化产物为模板,按照Ambion mMessage mMachine试剂盒说明书在37 ℃条件下体外转录反应1 h即获得CWMV RNA1和RNA2体外转录物。
1.3 小麦摩擦接种及其室内培养
接种CWMV方法主要参考文献[18]并略加修改。即取上述体外转录产物各100 μL,混匀;用摩擦接种缓冲液(50 mmol·L-1甘氨酸,50 mmol·L-1K2HPO4,pH 9.2)稀释至1 mL,摩擦接种至生长2周的小麦苗上,同时以仅摩擦接种缓冲液的小麦苗为对照。接种后,将小麦转移至人工气候培养箱(Percival E-30),设定培养条件为:温度(17±1)℃,光周期16 h/8 h(L/D),相对湿度60%~80%、光照强度8 000~10 000 lx。
1.4 总RNA提取、纯化及cDNA合成
采用RNeasy®Plant Mini Kit (Qiagen)提取小麦叶片总RNA,应用琼脂糖凝胶电泳和分光光度计(NanoDrop RND-2000,US)对RNA的完整性、浓度、纯度进行检测,结果显示凝胶条带清晰且不降解,D260/D280读数在1.8~2.1则表明RNA符合要求。按照试剂盒说明应用First Strand cDNA Synthesis Kit(TOYOBO)试剂盒将总RNA反转录成cDNA。
1.5 PCR引物设计和实时定量PCR
根据NCBI数据库核苷酸序列信息,利用Primer 5.0软件, 分别设计各小麦基因的qRT-PCR引物(表1),引物由杭州擎科梓熙生物技术有限公司合成。应用SYBR premix ExTaqⅡ试剂盒(TaKaRa)在荧光定量PCR-7900(ABI)上进行qRT-PCR反应,反应程序为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸30 s,40次循环。
1.6 标准曲线的绘制及基因扩增效率
利用标准曲线对各引物的扩增效率进行检测。将各基因PCR产物分别按照10-4,10-5,10-6,10-7,10-8进行稀释,设置5个梯度,每个梯度分别设置3个重复。以稀释后的产物为标准品,进行荧光定量PCR扩增。引物扩增效率(E)与标准曲线的斜率(slope)相关,根据标准曲线的斜率,由方程式E=(10-1/slope-1)×100,计算得出引物的扩增效率。扩增效率在95%~110%的引物符合要求。
1.7 基因表达水平测定
以各样品cDNA的5倍稀释液作为实时荧光定量PCR的反应模板,利用候选基因引物对其进行扩增。采用Ct值比较法,计算不同基因在所有样品中的表达量。对于每个基因,将其在所有样品中最低表达量定义为1。
1.8 数据处理和分析
数据处理和分析采用常用的内参分析软件geNorm(http://medgen.ugent.be /genorm/)和Norm-Finder。首先,根据qRT-PCR结果计算出每个样品的Ct平均值;然后,利用公式Q=E-ΔCt(E为基因扩增效率,一般默认为E=2;ΔCt=每个样品Ct-所有样品中最低的Ctmin),计算出各基因的相对表达量Q;最后,利用geNorm软件对各候选内参基因的相对表达量Q进行表达稳定性统计学分析,以表达稳定性M(软件默认M=0.5为阈值)来确定最稳定的内参基因,M值越大,稳定性越差,当M<0.5时,被认为可以考虑作为内参基因。另外,geNorm软件还引入标准化因子的配对差异分析V(程序默认V=0.15),从而确定合适的内参基因数目。若Vn/(n+1)<0.15,则没必要引入第n+1个内参基因[2]。Norm-Finder软件与geNorm类似,首先,将原始数据先经标准曲线或ΔCt法转换成相对表达量Q;然后,通过方差分析得出基因的表达稳定值M;最后,直接评价基因的稳定性[4]。
2 结果与分析
2.1 候选内参基因的选择及引物特异性
参考相关文献[7, 15, 19],筛选出10个持家基因,包括依赖ATP 26S蛋白酶体调节亚基(ATP-dependent 26S proteasome regulatory subunit,26S)、细胞分裂控制蛋白(cell division control protein,CDC)、类RNA酶抑制蛋白(RNase L inhibitor-like protein,RLI)、泛素连接酶E2基因(E2 ubiquitin-conjugating enzyme,UBCE2)、核糖体蛋白S5(ribosomal protein S5,RPS5)、肌动蛋白1(ACTIN1,Actin1)、肌动蛋白2(ACTIN2,Actin2)、α微管蛋白基因(alpha tubulin,ATUB)、β微管蛋白基因(beta tubulin 5,BTUB)和延伸因子1基因(elongation factor-1-alpha-subunit,EF1A1),这些基因涉及小麦生长发育过程中的多个生物学过程,包括基因转录、蛋白质合成、泛素化过程、细胞的结构与分化等。
利用10对针对上述持家基因的特异性引物,可分别从小麦cDNA 中扩增出大小依次为220、247、252、200、256、185、218、198、258和190 bp的预期条带(图1)。对这些扩增产物分别进行熔解曲线分析,结果显示UBCE2、BTUB扩增产物的熔解曲线含有杂峰,表明二者中可能存在少量的非特异性扩增;其余8个扩增产物的熔解曲线未发现杂峰,因此,这8个基因被选用于进一步分析。扩增效率检测结果显示,这8个基因的扩增效率均在95%~110%之间,线性相关系数范围为0.983~0.993,表明初始cDNA模板量与Ct值之间呈线性相关,符合内参基因的初步要求(表1)。
2.2 候选内参基因的表达稳定性
Ct值是qRT-PCR定量分析中反映基因表达丰度的重要参数[20],在不同处理条件下内参基因的Ct值存在差异,Ct值之间的差异值(ΔCt)反映了内参基因的稳定性。一般来说,ΔCt值越大,表明基因表达水平越不稳定。因此,我们首先通过Ct值比较法分析了上述8个候选基因在小麦根、茎、叶等组织中的表达稳定性。结果如图2所示,在8个候选基因中CDC、26S和RLI在CWMV侵染前后的小麦各组织部位表达稳定,而EF1A1和ATUB表达最不稳定。
2.3 应用geNorm和NormFinder程序分析基因表达稳定性
为了进一步明确8个候选基因的表达稳定性,我们采用了2个程序分别对各基因的相对表达量进行统计学分析。应用geNorm程序分析的结果如图3-A所示,26S、CDC、RLI、RPS5、ACTIN1、ACTIN2的M值都小于0.5,其中稳定性最高的两个内参基因分别为26S和CDC,而ATUB及EF1A1的M值均大于0.5,稳定性较差。与应用geNorm程序分析结果相似,NormFinder程序分析也显示,小麦26S和CDC基因表达最为稳定(图3-B),表明在CWMV侵染条件下,小麦26S和CDC基因是合适的内参基因。

M, 8 000 bp DNA ladder; Lane 1-10, 26S, CDC, RL1, UBCE2, RPS5, ACTIN1, ACTIN2, ATUB, BTUB, and EF1A1, respectively图1 琼脂糖凝胶电泳检测10个持家基因扩增产物Fig.1 Amplified products of 10 house-keeping genes detected by agarose gel

表1 引物序列及扩增产物长度

1-6分别为健康小麦的根、茎、叶和CWMV侵染7、14、21 d后的小麦样品。1-6, Samples from roots, stems, and leaves of health wheat and CWMV-infected wheat plants on 7、17、21 days after infection.图2 8个候选基因在不同样品中的表达稳定性分析Fig.2 Relative expression of 8 candidate reference genes in different tissues

图3 应用geNorm(A)和NormFinder(B)程序分析候选基因表达稳定性Fig.3 Expression stability of candidate genes analyzed by geNorm (A) and NormFinder (B) programs
为了获得更可靠的qRT-PCR数据,一般要求推荐使用2个或以上的内参基因。为了确定合适的内参基因数目,我们又进一步通过geNorm程序分析了标准化因子的配对差异(V)。结果如图4所示,V2/3<0.15,表明第3个内参基因未能显著表示出标准化因子差异。因此,选用内参基因26S与CDC组合能满足精确标准化的要求。
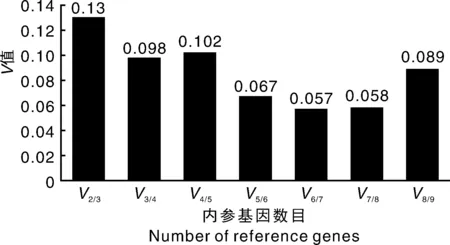
图4 内参基因最适数目的确定Fig.4 Determination of the optimal number of reference genes for normalization
3 讨论
随着qRT-PCR技术和方法的逐步完善,作为qRT-PCR数据分析的前提条件,内参基因的筛选已受到较多的关注,理想的内参基因是在物种不同的发育阶段和组织器官中表达高度稳定,且在受外源生物或非生物胁迫也能保持其稳定的表达水平[21]。基于前期各种植物内参基因的研究结果[6, 8, 15, 22],本研究从10个持家基因筛选出2个在CWMV侵染条件下表达稳定性比较理想的基因,其中,26S是表达最稳定的内参基因,前期的研究也证明26S在小麦种子发育过程以及干旱、低温、高盐等非生物胁迫条件下表达量稳定[23],支持26S可作为小麦基因定量内参的结论,与本研究结果一致。另外,有研究显示EF1A1表达不稳定且与芜青花叶病毒(Turnipmosaicvirus,TuMV)的侵染存在相关性[24];在本研究中,EF1A1的表达不及26S稳定,尤其是在CWMV侵染后表达量变化较大,预示EF1A1可能与CWMV侵染也存在一定的相关性,值得进一步分析。ACTIN是一类常用的内参,但有报道显示此类基因在一定非生物胁迫条件下表达并不稳定[25];本研究中,ACTIN1和ACTIN2的表达都不太稳定,表明二者不是CWMV侵染条件下的最佳选择。这也从另一个角度表明针对不同的胁迫条件下选择合适的内参是十分必要的。
为了提高qRT-PCR数据分析的精度,有时在实验过程中选择2个或者多个内参,利用其几何平均值校正待测基因表达结果[26]。本研究中,应用geNorm和NormFinder程序分析也表明,在所检测的基因中26S和CDC表达最为稳定;通过geNorm程序计算n个基因标准化因子与n+1个基因标准化因子的配对变异值Vn/(n+1),我们也明确了26S和CDC组合是在CWMV胁迫条件下研究基因表达的最适内参组合。这为准确绘制CWMV侵染条件下的小麦基因表达图谱奠定了基础,也有助于深入研究CWMV和宿主小麦基因之间的相互作用。
