温肾固疏方干预绝经后骨质疏松药理研究
2018-08-02沈蕴茹郭海英
沈蕴茹 郭海英
南京中医药大学第二临床医学院,江苏 南京 210023
绝经后骨质疏松症(post menopausal osteoporosis,PMOP)是一种受多种因素影响的代谢性疾病,妇女绝经后体内雌激素降低,骨质疏松症常与脂代谢紊乱导致的心血管疾病伴随发生。绝经后骨质疏松严重影响中老年妇女的日常生活甚至生命安全。近年来多项新研究阐明[1],载脂蛋白E(epolipoprotein E,ApoE)不仅作为重要角色参与脂代谢,也同时会影响骨代谢,雌激素水平也被证实对ApoE有影响[2]。国内外学者多将绝经后妇女骨质疏松与脂代谢异常的着重点放于ApoE,集中研究ApoE对骨代谢与脂代谢的调节作用。温肾固疏方具有温阳补骨、补肾健脾的功效,本研究通过建立大鼠骨质疏松模型,观察温肾固疏方对大鼠的以ApoE为连接点的骨质量、强度以及脂代谢指标的改变,寻找PMOP新的发病机制,并从此得到更加长期有效,易于推广普及的PMOP防治手段。
1 实验材料
1.1 实验动物
健康9月龄未孕SPF级SD大鼠40只,雌性,体重(250±30)g,由南京中医药大学实验中心提供,合格证号SYXK(苏)2014-0001-201508662。
1.2 仪器、药物及试剂
温肾固疏方各药物组成由南京中医药大学百草堂药房提供,方药组成: 熟地20 g、淫羊藿20 g、党参10 g、丹参10 g、枸杞10 g、骨碎补10 g、补骨脂5 g,茯苓10 g,白术10 g,两次煎液过滤合并浓缩。戊酸雌二醇(补佳乐,德国拜耳医药保健有限公司广州分公司,180 A)。10%水合氯醛溶液(中国人民解放军第一医院,20130312)。青霉素(山东鲁抗医药股份有限公司,B140808)。Elisa试剂盒购自于南京森贝伽生物,大鼠OT/BGP试剂盒(20161212),大鼠ApoE试剂盒(20161212),大鼠Lip试剂(20161212),大鼠sRANKL试剂盒(20161212),大鼠BMPs试剂盒(20161212),大鼠OPG试剂盒(20161212)。数字化双能X线骨密度仪(MEDIX-90,法国MEDILINK公司)。CHD-1001 电子式双柱万能材料试验机CHD-1001(东莞诚鼎)。全自动生化分析仪(日本东芝TBA-120FR)。
2 研究方法
2.1 去卵巢大鼠骨质疏松症模型的建立
采用双侧性腺(卵巢)摘除法[3]制备绝经后骨质疏松模型。饲养环境:室温(22±2)℃、湿度控制于50%,恒温、恒湿、清洁、通风环境,自由饮食、饮水,饲养1 w后根据体重将SD大鼠随机分为两组:假手术组(Sham,n=6)、模型组(n=34)。模型组首先腹腔注射35 mg/kg的10%水合氯醛溶液麻醉,然后背部切口行去势手术,剪除双侧卵巢,分层缝合。Sham组大鼠背部切口手术后,仅切除卵巢旁约1 g重的脂肪,不切除卵巢,最后每只大鼠经后肢肌肉注射80000 U青霉素,连续7 d观察。
2.2 分组及干预
造模过程中无因感染等原因而不适合继续干预的大鼠。将摘除双侧卵巢的模型组大鼠(n=34)随机分组,分为:模型组(OVX,n=6),温肾固疏方高剂量组(n=6)、中剂量组(n=6)、低剂量组(n=6)及雌激素组(n=6),剩余4只放血处死。大鼠于上述饲养环境中自由摄食、饮水,每周称量体重一次。各组大鼠均于手术后3 w切口愈合后开始分组治疗干预。用临床拟用计量法(ACD法)拟定大鼠同类药等效剂量,按成人6.30倍计算,给药容积0.5 mL/100 g。温肾固疏方治疗组先计算出中剂量组计量,高剂量组为中剂量组2倍,低剂量组为中剂量组1/2。高剂量组:温肾固疏方,21.21 g生药/(kg·d);中剂量组:温肾固疏方,10.605 g生药/(kg·d);低剂量组:温肾固疏方,5.3 025 g生药/(kg·d)。雌激素组:戊酸雌二醇,10μg/(kg·d)。模型组:给予生理盐水0.5 mL/100 g灌胃;假手术组给予生理盐水0.5 mL/100 g灌胃。各组灌胃持续8 w。
2.3 标本釆集及测定
大鼠末次施治后,禁食24 h,次日取材。处死前称量大鼠体质量,用10%水合氯醛溶液(35 mg/kg)腹腔注射麻醉,右心室抽血处死。血液收集后,4 ℃静置3 h,3 000 r/min, 离心10 min,分离血清。酶联免疫法(ELISA)测定OT/BGP、sRANKL、OPG、BMPs、ApoE、Lip。全自动生化仪测定血清高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、TG、TC,计算AI(AI=LDL-C/HDL-C)。骨质量测定:取大鼠右侧股骨、腰椎全段,放在有机玻璃盒支架上固定,以MEDIX-90骨密度测定仪扫描测定离体大鼠骨密度(bone mineral density,BMD)、骨矿含量(bone mineral content,BMC)。骨强度测定:取大鼠左侧股骨,固定于电子式双柱万能材料试验机上,测定股骨弾性模型、最大承载力、刚性、最大应力。
2.4 统计学方法
3 实验结果
3.1 大鼠骨密度(BMD)、骨矿含量(BMC)变化
模型组与假手术组对比,模型组大鼠股骨、腰椎BMD、BMC明显降低(P<0.05)。与模型组相比,雌激素组、高、中、低计量组大鼠股骨、腰椎BMD、BMC皆有增高,其中股骨BMD、BMC的雌激素组、低、高剂量组增高明显(P<0.05)。腰椎BMD、BMC雌激素组增高明显(P<0.05),BMC高剂量组增高明显(P<0.05),雌激素组与温肾固疏方各剂量组的股骨、腰椎BMD、BMC皆高于模型组。见表1。

表1 温肾固疏方对不同组别去势大鼠股骨骨密度的影响Table 1 Effects of WenShenGuShu formula on BMD and BMC of rat with osteoporosis
注:与假手术组相比,▲P<0.05。与模型组相比,*P<0.05,△P<0.01。
3.2 大鼠股骨生物力学的变化
模型组与假手术组相比,模型组弹性模量、最大承载力、刚性、最大应力皆显著降低(P<0.05)。与模型组相比,雌激素组、低、中、高剂量弹性模量、最大承载力、刚性、最大应力皆高于模型组,其中,雌激素组、中剂量组弾性模型显著增高(P<0.05),雌激素组、高剂量组最大承载力显著增高(P<0.05),低剂量组与高剂量组刚性显著增高(P<0.05),雌激素组、低剂量组与高剂量组最大应力显著增高(P<0.05),高剂量组最为明显(P<0.05)。见表2。
3.3 大鼠血清骨代谢的变化
模型组与假手术相比,模型组血清骨谷胺蛋白/骨钙素(OT/BGP)、OPG、骨形成蛋白(bone morphogenetic protein,BMPs)下降,sRANKL上升。治疗组与模型组相比,OT/BGP皆有上升,其中雌激素、中剂量组有统计学意义(P<0.05),高、低剂量组上升明显(P<0.01);sRANKL皆下降,其中高、低剂量组具有统计学意义(P<0.05);OPG各组均上升,其中雌激素组、低剂量组具有统计学意义(P<0.05);BMPs各组均上升,雌激素组,高、低计量组有统计学意义(P<0.05)。温肾固疏方高、低剂量灌胃对大鼠骨代谢作用明显。见表3。

表2 大鼠股骨生物动力学变化Table 2 Effects of WenShenGuShu formula on biomechanics of femur in rats with osteoporosis
注:与假手术组相比,▲P<0.05。与模型组相比,*P<0.05,△P<0.01。

表3 温肾固疏方对去势大鼠骨代谢的影响Table 3 Effects of WenShenGuShu formula on bone metabolism of rats with osteoporosis
注:与假手术组相比,▲P<0.05。与模型组相比,*P<0.05,△P<0.01。
3.4 各组大鼠血清脂代谢的变化
模型组与假手术组对比,模型组Lipids、ApoE、LDL-C、TC均上升,HDL-C、TG均下降,Lipids、ApoE、LDL-C变化具有统计学意义(P<0.05),动脉硬化指数AI上升(P<0.05)。与模型组对比,雌激素组、低、中、高剂量组血清Lipids下降,低、中、高剂量组有统计学意义(P<0.05),低、高剂量组下降效果明显(P<0.01),雌激素组、低、高剂量组ApoE下降,低剂量组具有统计学意(P<0.05)。低、高剂量组LDL-C下降明显(P<0.05)。低剂量组TG下降明显(P<0.05)。雌激素组、低、中、高剂量组AI均有下降,低、高剂量组有统计学意义(P<0.05),且温肾固疏方低、高剂量组AI低于雌激素组。见表4。
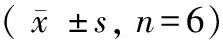
表4 温肾固疏方对去势大鼠脂代谢以及ApoE的影响
注:与假手术组相比,▲P<0.05。与模型组相比,*P<0.05,△P<0.01。
4 讨论
前期研究表明[4],骨质疏松大鼠模型构建后大鼠雌激素水平迅速下降,光镜下观察模型组大鼠病理切片,可见骨松质骨小梁纤细明显,数量减少,部分骨小梁断裂呈典型骨质疏松模型,提示该实验造模成功。本课题研究进一步探讨绝经后骨质疏松的新发病机制以及治疗方案,参照绝经后妇女骨质疏松导致骨折的多发部位,测定大鼠股骨、腰椎的BMD、BMC,温肾固疏方高、中、低剂量组与模型组比较,低、高剂量组大鼠股骨BMD、BMC上升明显(P<0.05),高剂量组大鼠腰椎BMC上升明显(P<0.05)。测定股骨弾性模型、最大承载力、刚性、最大应力,中剂量组弾性模型显著增高(P<0.05),高剂量组最大承载力显著增高(P<0.05),低剂量组与高剂量组刚性显著增高(P<0.05),低剂量组与高剂量组最大应力显著增高(P<0.05)。上述实验结果证明经温肾固疏方治疗后,去势大鼠的骨质量与骨强度皆有提升,有防治绝经后骨质疏松症的作用。
近年来研究发现,脂肪细胞与骨细胞两者由骨髓间充质干细胞分化而来,基于双向分化原理,骨髓间充质干细胞细胞会向脂肪细胞与骨细胞两个方向分化。现阶段研究证明[5],ApoE与Wnt信号通路的LRP受体结合,并能抑制PPARγ的活化,ApoE能够通过调节Wnt通路与PPARγ从而影响β-catennin的表达,诱导骨髓间充质干细胞分化。OPG与sRANKL联合说明Wnt信号通路的改变,sRANKL表达增高说明骨量流失。ApoE通过运输脂溶性维生素K参与骨细胞的生成,维生素K大部分由饮食供给,去势大鼠正常饮食,说明维生素K的结合受到影响,维生素K作为特别的脂溶性维生素只能与受体结合力较强的ApoE相结合运输[6-8],维生素K能将骨钙素中残留的3谷氨酸羧化,该修饰过程对于维持γ-骨钙素的完整性是必不可少的,骨钙素水平下降会导致骨密度下降与骨脆性增加,OT/BGP下降说明去势大鼠骨生成收到影响[9]。BMPs(骨形成蛋白)促进骨代谢作用与Smad 蛋白相偶联,影响骨重建与骨吸收,参与骨髓间充质干细胞的双向分化,抑制内源性BMP-4可以抑制PPARγ的表达,在前脂细胞分化中维持其状态。本研究结果提示温肾固疏方治疗后模型大鼠各项骨代谢指标与上述理论相吻合,低、高剂量组血清OT/BGP上升(P<0.05);低、高剂量组sRANKL下降(P<0.05);低剂量组血清OPG上升(P<0.05);低、高剂量组BMPs上升(P<0.05);高、中、低剂量组血清Lip下降(P<0.05),低剂量组ApoE下降(P<0.05);低、高剂量组LDL-C下降;低剂量组TG下降(P<0.05)。低、高剂量组AI下降(P<0.05),且AI低于雌激素治疗组。上述实验结果提示温肾固疏方通过调控ApoE,改善Wnt/PPAYγ的拮抗作用从而诱导β-catennin的表达,促使骨髓间充质干细胞向骨细胞分化,促进骨形成,防止脂细胞形成,改善脂代谢异常,并促进骨吸收,防止骨变异流失,进而改善绝经后骨质疏松情况。
在中医理论中,“肾主骨”,肾与骨的关系密切,《内经》指出妇女在绝经前后,即“天癸衰”后会出现毛发枯黄,牙齿松动,骨质脆弱等表现。补肾一直以来作为中医治疗骨质疏松的主要方向。国内学者研究认为,ApoE在中医理论中与痰证关系紧密,《仁斋直指方》中提出“肥人气虚生痰,故多痰湿”,说明早于几百年前就有临床经验研究指出脂代谢异常与痰湿体质、证候互相作用。痰湿证候会导致脂代谢异常,脂代谢异常也会反作用于痰湿证候,使痰淤体内,湿气不排,进而导致湿浊在体内堆积,脾胃功能失调。脾胃与肾在藏象关系中联系紧密,先天后天精微互相充养,脾胃功能失调,则后天之精运化失调,后天之精不能充养先天之精,故导致肾气不充,肾脏功能失司,肾精与水谷精微不能充养骨骼,便会进一步引发骨枯、骨萎,也就是现代的骨质疏松症。ApoE在脂代谢与骨代谢调节中起到至关重要的作用,中医理论中也与痰湿证候相关[10-12],影响肾精充养骨的作用。大量临床报告显示绝经前后妇女常同时伴有骨质疏松和脂代谢异常导致的心血管系统疾病、阿尔茨海默病等,单一的他汀类药物或雌激素替代疗法都未能取得更好的疗效,长期服用雌激素可能导致静脉血栓和心血管疾病[13-15],长期服用雌激素的女性患有此类疾病的可能性要较一般女性高出2倍左右[6],并且会导致体重增加与明显的情绪变化[16],故持续使用雌激素替代疗法并非相对完善的治疗PMOP手段。温肾固疏方由熟地20 g、淫羊藿20 g、党参10 g、丹参10 g、枸杞10 g、骨碎补10 g、补骨脂5 g,茯苓10 g,白术10 g按比例配伍制成。根据现代中药研究,骨碎补[17]、熟地[18]、淫羊藿[19]皆有通过调节ApoE对骨髓间充质干细胞的双向诱导分化作用,淫羊藿同时具有保护心血管的功能[20]。温肾固疏方以温肾健脾为治疗原则,具有能够长期服用、副作用小、能在一副汤药中通过草药配伍整体治疗的优越点,并且具有中医的整体治疗观念,能够整体调节绝经后妇女的激素代谢。
本实验通过对去势大鼠骨质量、骨强度、骨代谢以及脂代谢指标的研究,证实温肾固疏方通过调控ApoE从而改善骨代谢,防止骨流失,并能有效改善脂代谢,通过温肾健脾法达到补骨的效果。但由于绝经后骨质疏松症是一种机制复杂的综合代谢性疾病,其机制尚不明确,且实验依旧有改进空间,如大鼠与人类在生物形态学的不同导致部分结论不显著、样本量偏少、大鼠个体差异性等,对ApoE调控绝经后骨质疏松症的机制依旧需要进一步探讨,希望能从中寻找新的防治思路。
