小麦-野生亲缘种属添加系白粉病新抗源筛选及特异分子标记鉴定
2018-08-02麦艳娜董振杰刘文轩
夏 晴,麦艳娜,董振杰,刘文轩
(河南农业大学 生命科学学院,河南 郑州 450002)
小麦(TriticumaestivumL.)是世界三大谷类作物之一,也是我国重要的粮食作物。河南省是我国小麦的最适生态区,小麦播种面积和总产量均居全国之首,河南省小麦生产对我国粮食安全和社会稳定起着重要作用[1]。由布氏白粉菌(Blumeriagraminisf.sp.tritici)引起的小麦白粉病是一种世界性小麦真菌病害,也是影响小麦生产的三大主要病害之一[1]。小麦白粉病主要发生在叶片上,也可发生于植株叶鞘、茎秆和穗部。小麦感染白粉病后,摄入养分减少,叶片早枯,从而影响叶片光合作用,致使成穗率减少、千粒质量下降,品质与产量都受到严重影响[2]。20世纪70年代以后,由于种植密度的提高和水肥使用量的增加,致使小麦白粉病不断扩展蔓延,发病程度逐渐加重。河南省是小麦白粉病的重发区,白粉病多次大面积流行成灾,成为小麦生产亟待解决的重大灾害性问题之一。目前,防治小麦白粉病的主要措施有药物防治和选育抗病小麦品种两大类。喷施农药虽然可以起到一定的防治效果,但会给农民和政府带来较大的经济负担,而且污染生态环境。因此,培育和利用高产、优质、抗病小麦新品种是公认的防治小麦白粉病危害最为经济有效的途径[3]。
培育抗白粉病小麦品种的方法有很多,但目前还是以传统杂交育种为主,而抗病基因是利用杂交育种培育抗病新品种的关键。迄今正式命名的白粉病抗性基因有83个(Pm1—Pm60)[4-6],但目前真正能被育种家利用的抗病基因非常有限。由于白粉病抗源单一品种的大面积推广种植,部分原有的抗病基因随着流行菌株的变化和白粉菌新菌株的出现而成为低效或无效抗病基因[7]。此外,部分抗病基因的载体品种农艺性状差,或伴随有不良性状,真正能用于我国小麦抗白粉病育种的基因资源十分有限。因此,不断发掘与利用抗白粉病基因新资源,创造优异抗病新种质,是我国培育抗白粉病小麦新品种的迫切需求。
小麦抗白粉病基因的来源目前有普通小麦、小麦近缘种属和野生亲缘种属等。其中,小麦野生亲缘种属类型繁多,蕴藏着极其丰富的抗病基因,是小麦白粉病抗病基因的最重要来源。目前有效命名的79个抗白粉病基因中,20个(25.32%)来自10类小麦野生亲缘种属,为小麦抗病育种做出了巨大贡献。但与普通小麦基因相比,来自小麦野生种属的外源基因只有通过诱导外源染色体与小麦重组形成小麦-野生亲缘种属易位系后才能被小麦抗病育种所利用。目前,最常用于鉴定小麦-野生亲缘种属易位系的方法为基因组原位杂交(Genomicinsituhybridization,GISH)和外源染色体特异分子标记。其中,GISH可以直观鉴定小麦与外源染色体的易位,但其有效性依赖于外源染色体与小麦染色体的部分同源性程度和研究者的技术水平,且耗时费力。而分子标记不受环境、基因表达与否等因素的限制,同时具有数量丰富、多态性强以及操作简便的特点[8],为外源染色体易位系的大规模筛选提供了极大便利。外源染色体特异分子标记筛选与GISH鉴定相结合可以极大提高向小麦转移外源抗病基因的效率[9]。
本研究利用河南省流行的白粉病混合菌株对收集的100份小麦-野生亲缘种属添加系苗期接种,进行抗性鉴定和考马斯亮蓝染色鉴定[10],评价其抗性表现,发掘白粉病新抗源;并利用小麦表达序列标签(Expressed sequence tags,EST)开发STS(Sequence tagged site)分子标记,根据小麦全长cDNA序列比对小麦亲缘物种基因组序列开发FlcDNA(Full-length cDNA)分子标记[11],筛选携带抗病基因的外源染色体特异分子标记,为创造抗病新种质、培育抗白粉病小麦新品种提供抗病新基因分子标记选择技术[12]。
1 材料和方法
1.1 供试品种和菌株
供试材料为100份小麦-野生亲缘种属添加系,添加系的亲缘种属来源见表1。以携带免疫白粉病基因Pm21的抗病小麦品种国麦301和高感白粉病的中国春(Chinese spring,CS)作对照。小麦白粉病混合菌株由河南省农业科学院植物保护研究所提供,以高感白粉病小麦品种中国春进行活体繁菌保存。

表1 小麦-野生亲缘种属添加系列表

续表1 小麦-野生亲缘种属添加系列表
注:ALCD1遗传背景材料是英国小麦品种ALCD,其他材料的遗传背景是中国春小麦;#后标注数字用于区分不同登记编号的同一亲缘种属染色体添加系;DA 表示外源染色体二体添加系,DtA表示外源端着丝粒染色体二体添加系;? 表示添加系中的外源染色体同源群目前暂未确定。
1.2 接种及鉴定方法
1.2.1 白粉病苗期抗性鉴定 白粉病抗性鉴定采用人工接菌鉴定法,在河南农业大学恒温培养室内进行,接种小麦白粉病混合菌株。
将100份试验材料与对照品种播种于32孔(6 cm×6 cm)育苗盘内,每份材料播种1穴,每穴5粒,每盘种植1穴中国春作为感病对照。播种后的小麦材料置于18~20 ℃、湿度70%、光照时间16 h/d的环境下培养。至一叶一心且第一片叶完全展开时,将已充分发病的中国春置于待鉴定幼苗培养盘的四周,定期抖落孢子接种白粉菌。待接种7~15 d,感病对照中国春充分发病时,调查记载各材料的白粉病抗性。将初步鉴定对白粉病具有抗性的品种二次播种,接种白粉菌,重复鉴定其抗性。
抗病性鉴定采用盛宝钦[13]提出的0~4级调查标准记载每个植株的反应型。根据叶片受侵染严重程度分为6种反应型,分别为免疫(IT = 0)、近免疫(IT = 0;)、高抗(IT = 1)、中抗(IT = 2)、中感(IT = 3)和高感(IT = 4)。其中,0~2级属于抗病类型,3~4级属于感病类型,划分标准见表2。

表2 小麦白粉病苗期反应型分级标准
1.2.2 考马斯亮蓝染色观察 幼苗接种白粉菌7 d后剪取1~2 cm叶段,在乙醇∶冰醋酸(3∶1,V/V)混合液中过夜脱色,使叶段透明,随后用去离子水漂洗叶段2次。冲洗后用考马斯亮蓝R250∶甲醇∶水∶乙酸(0.05∶50∶40∶10,m/V/V/V)混合液染色10~15 min,染色后的叶段用去离子水漂洗后储存于冰乙酸∶甘油∶水(5∶20∶75,V/V/V)混合液中,在OLYMPUS CX41型光学显微镜下观察叶段上白粉菌的生长和分布情况[14]。
1.3 白粉病新抗源分子标记筛选
对鉴定为抗白粉病的小麦-野生种属添加系试验材料采用SDS法提取基因组DNA。根据小麦EST设计了29个STS分子标记;根据从小麦FLcDNA数据库[15]获取的小麦全长cDNA序列,比对山羊草、黑麦、大麦、水稻、短柄草等物种的基因组序列[16],以比对出的内含子序列为模板设计引物,开发了77个FlcDNA分子标记。PCR引物由上海生工生物工程技术服务有限公司合成。
PCR扩增在TC-XP型基因扩增仪(杭州博日科技有限公司)上进行。PCR反应体系(15 μL)组分为:7.5 μL 2×TaqMasterMix,0.5 μL引物(10 μmol/L),2 μL基因组DNA(100~200 ng/μL),5 μL去离子水。PCR扩增程序为:94 ℃ 10 min;94 ℃ 20 s,退火 20 s,72 ℃ 2 min,35个循环;最后72 ℃ 10 min。PCR产物分别用6种限制性内切酶(AluⅠ、HaeⅢ、MseⅠ、MspⅠ、RsaⅠ、MboⅠ)在37 ℃酶切2 h。酶切产物用含有溴化乙锭的3%琼脂糖凝胶电泳进行分离检测,最后在凝胶成像系统中扫描观察。
2 结果与分析
2.1 白粉病苗期抗性鉴定结果
利用河南省白粉病混合菌株对100份小麦-野生亲缘种属添加系进行苗期抗性鉴定。结果表明,6份材料表现为抗病,占全部材料的6.00%。其中,免疫和近免疫材料有3份,亲缘种属来源分别为沙融山羊草、高大山羊草、尾状山羊草;高抗有2份,亲缘种属来源分别为两芒山羊草、高大山羊草;中抗材料有1份,亲缘种属来源为高大山羊草(表3)。

表3 小麦-野生种属添加系苗期白粉病抗性鉴定结果
2.2 考马斯亮蓝染色结果
考马斯亮蓝染色的结果能够进一步验证苗期表型鉴定的准确性。在麦苗接种白粉菌7 d后取样,考马斯亮蓝染色使小麦叶片组织呈现透明,白粉菌孢子、芽孢及后续发育形成的分生孢子等结构被染成结构清晰、反差明显的深色。以小麦-高大山羊草3Sl#3添加系(CS-AELON DA 3Sl#3)为例,该添加系是在中国春小麦的遗传背景中添加了1对高大山羊草3Sl#3染色体。根据苗期接种表型,中国春为高感,而CS-AELON DA 3Sl#3为高抗;观察考马斯亮蓝染色的结果发现,中国春叶段染色后在显微镜下可以观察到大片菌落和分生孢子,而CS-AELON DA 3Sl#3在显微镜下只可以观察到少量附着胞芽管(图1A),说明表型鉴定与考马斯亮蓝染色观察结果一致,抗性鉴定可靠。
2.3 抗白粉病小麦-野生亲缘种属添加系外源染色体特异分子标记筛选
根据小麦EST和全长cDNA共设计了106个分子标记,利用PCR方法对抗病添加系基因组DNA进行扩增,从中筛选出了12个外源染色体特异分子标记(表4)。其中,XBE404125/RsaⅠ和XBG313367/RsaⅠ 2个标记为STS分子标记,其余10个为FlcDNA 分子标记。本研究开发的29个STS标记中有2个为外源染色体特异分子标记,占STS标记总数的6.90%,而77个FlcDNA标记中有10个为特异分子标记,占12.99%,说明FlcDNA标记在外源染色体中的多态性较STS标记高得多。因此,根据小麦全长cDNA开发FlcDNA标记在外源染色体特异分子标记创制方面有更大的应用潜力。
本研究筛选出的12个特异分子标记在小麦-野生种属添加系材料中有明显区别于感病对照的特异扩增条带。以筛选出的1个STS分子标记(XBE404125/RsaⅠ)和3个FLcDNA分子标记(X3S11/MspⅠ、X3S22/MseⅠ和X3S42/AluⅠ)为例,PCR模板分别为中国春小麦和CS-AELON DA 3Sl#3的基因组DNA,CS-AELON DA 3Sl#3相对中国春均有3Sl#3染色体特异扩增条带(图1B)。

A:小麦-野生亲缘种属添加系白粉病抗性鉴定。左:CS、CS-AELON DA 3Sl#3白粉病抗性的叶片表型鉴定;右:接种7 d后叶段的考马斯亮蓝染色。右上:CS;右下:CS-AELON DA 3Sl#3。B:外源染色体特异分子标记筛选。Marker: 100 bp DNA Ladder; CS、DA 3Sl#3泳道下方为分子标记名称;白色箭头指示外源染色体特异扩增条带图1 小麦-野生亲缘种属添加系白粉病抗性鉴定和外源染色体特异分子标记筛选
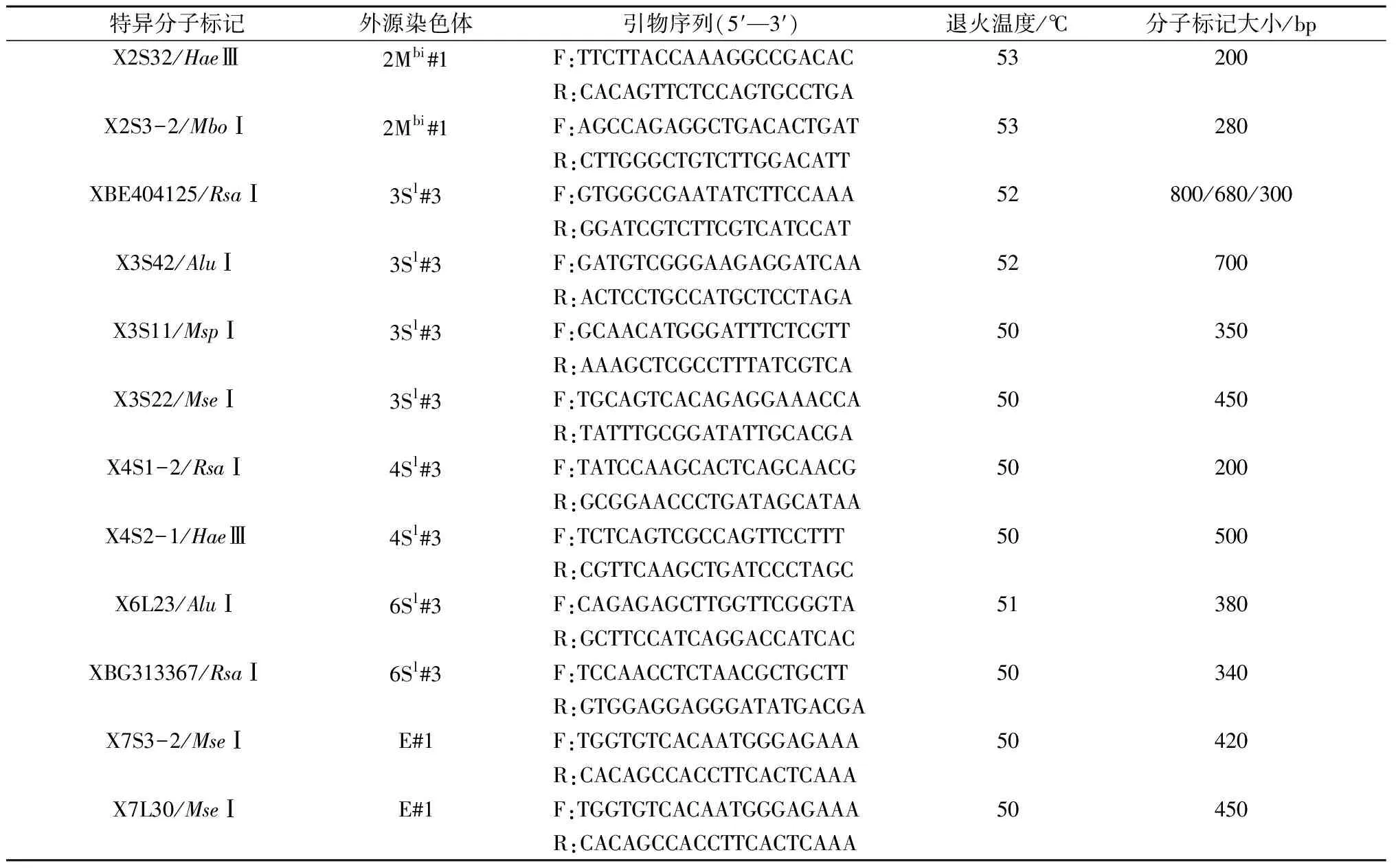
表4 外源染色体特异分子标记列表
3 结论与讨论
本研究利用白粉病混合菌株对100份小麦-野生种属添加系进行苗期接种抗性鉴定,初步筛选出6个小麦-野生种属添加系对小麦白粉病混合菌株具有抗性。这6份添加系除ALCD-AECAU DA E#1外,其他5份小麦-野生种属添加系都是在中国春小麦的遗传背景中添加了1对外源染色体。中国春高感白粉病,因此,可以确定这5份抗病添加系的抗病基因都位于相应的外源染色体上。添加系ALCD-AECAU DA E#1的遗传背景材料是英国小麦品种ALCD,但该品种高感河南省小麦白粉菌,因此该添加系的抗病基因定位在外源染色体E上。目前,已经命名的83个抗白粉病基因中,并没有来源于高大山羊草4Sl#3和6Sl#3,沙融山羊草4Ssh#8,两芒山羊草2Mbi#1和尾状山羊草E#1染色体的抗病基因。所以,这5个染色体上的抗病基因应该都是新的抗白粉病基因。在已正式定名的抗白粉病基因中,Pm13基因定位于高大山羊草3Sl染色体短臂[17],但本研究中小麦-高大山羊草抗白粉病添加系CS-AELON DA 3Sl#3的外源染色体与Pm13基因所在的3Sl染色体来源地不同,本研究中3Sl#3上的抗白粉病基因是Pm13的等位基因还是新基因尚需进一步研究确定。本研究鉴定的抗白粉病材料对拓展小麦白粉病抗性基因来源,培养优良抗病小麦新品种具有重要意义。
小麦野生种属来源的外源抗病基因对小麦抗病育种和白粉病防治起到了关键作用。本研究筛选的抗白粉病添加系都是在小麦遗传背景基础上添加了1对外源染色体。由于添加的是整条外源染色体,不可避免会伴随较多的不良性状。此外,外源染色体在小麦背景中也常常会发生丢失,导致抗病性丧失。所以,外源抗白粉病基因只有通过诱导外源染色体片段与小麦染色体片段重组,创制小麦-野生亲缘种属易位系后,才能作为新抗源用于培育抗病小麦新品种。目前,外源染色体片段鉴定方法有基因组原位杂交[18]和分子标记2种。其中,分子标记数量多、多态性强以及快速简便可靠,是鉴定外源基因的首选方法[19]。本研究筛选到了12个携带抗白粉病新基因外源染色体的特异分子标记,其中10个为基于小麦全长cDNA开发的FlcDNA分子标记,占FlcDNA标记总数的12.99%。由此可见,FlcDNA分子标记相对于目前常用的STS分子标记具有数量多、扩增产物稳定和易于检测等优点,更适用于开发小麦野生亲缘种属外源染色体的特异分子标记。本研究筛选出的分子标记为外源染色体的鉴别和进一步利用小麦-外源染色体易位系把抗白粉病新基因导入普通小麦奠定了基础。
