北太平洋鱿鱼缠卵腺抗氧化酶解寡肽的制备
2018-08-02刘倩茹柏圣达赵国雨徐云峰杨最素
刘倩茹,柏圣达,赵国雨,徐云峰,杨最素
(浙江海洋大学食品与医药学院/浙江省海洋生物医用制品工程技术研究中心,浙江 舟山 316022)
鱿鱼是海洋生物中重要的头足类动物,其生长周期短、繁殖能力强及资源恢复迅速,是一种可持续发展的海洋渔业资源。近年来,随着国内外深海捕捞技术的发展,鱿鱼业已成为中国主要的远洋捕捞和水产加工品种。目前,中国年鱿鱼加工量达40~50万t,居世界第一位,加工品种主要为阿根廷鱿鱼、北太平洋鱿鱼和秘鲁鱿鱼。鱿鱼的肉细腻,风味鲜美,富含高蛋白低脂肪,包含人体所需的多种必需氨基酸,备受消费者青睐。在鱿鱼的加工过程中,一般对其胴体进行加工,产生约有35%的鱿鱼头、内脏及表皮等下脚料,除部分加工成鱼粉外,一般都采用掩埋处理,造成资源的大量浪费,因此学者们对如何综合利用鱿鱼下脚料开展了广泛的研究[1]。现有的研究结果表明,鱿鱼皮胶原蛋白的小分子肽具有良好的降血压、调血脂、抗氧化等多种生理功能,在食品、医疗及保健品方面具有良好的应用前景[2,3]。 鱿鱼墨多肽具有抗肿瘤活性[4],鱿鱼墨黑色素铁能够显著促进大鼠造血细胞的生长,改善缺铁性贫血大鼠的贫血症状,是贫血类保健食品的良好原料[5,6]。鱿鱼内脏含较高的牛磺酸、维生素和锌等成分,可作为强化食品的原料,作为制造酱油或天然调味品的原料[7,8]。 而生殖腺(缠卵腺、精巢、卵巢等)占内脏的20%,这些内脏等副产物,通常被加工成饲料,作为鱼的诱饵[9];鱿鱼缠卵腺等通常只作烹饪食用,生物附加值低并且未及时处理会对环境造成一定的污染。研究表明,雄性鱿鱼精巢组织提取物具有抗疲劳、抗氧化及免疫调节功能,在海洋保健食品中有广阔的应用前景[10]。精巢中可获得鱼精蛋白,具有抑制多种食品腐败菌的生长,且具有促消化、助呼吸、降血压、抑制肿瘤生长等生理活性,鱼精蛋白因其良好的天然性和抗菌性受到广泛关注,已作为化学防腐剂的替代品出现在食品添加剂行列[11]。关于鱿鱼雌性生殖腺——缠卵腺的研究不多,王倩等[12,13]、刘淑集等[14]从鱿鱼缠卵腺中提取糖蛋白,发现其具有较好的抗疲劳、降血脂及提高非特异性免疫的功能,但关于鱿鱼缠卵腺酶解多肽的提取目前鲜见报道。本研究以鱿鱼缠卵腺为原料,通过优化的酶解方法提取多肽,评价其体外的抗氧化活性,以期为鱿鱼缠卵腺的开发利用提高试验依据。
1 材料与方法
1.1 材料与试剂
北太平洋鱿鱼(Todarodes pacificus)缠卵腺,购于舟山本地水产品企业;碱性蛋白酶购于亚太恒信生物科技(北京)有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)购于西亚试剂;菲洛嗪、邻二氮菲、三氯化铁、磷酸氢二钠购于阿拉丁试剂公司;其余试剂均为分析纯购于国药集团化学试剂有限公司。
1.2 仪器与设备
SSW-420-2S恒温水浴锅 (上海民仪电子有限公司);BSA124S型电子天平 (德国SartoriusAG公司);DS-1 组织捣碎机 (上海标本模型厂);PHS-250PH计(上海理达仪器厂);CF16RXⅡ型高速低温离心机 (日本日立公司);Direct-Q 5 UV-R型超纯水系统和Cogentk®μ Scale型超滤系统 (美国Millipore 公司);ALPHA 1-4/LDplus 型冷冻干燥机(德国 CHRIST 公司);紫外分光光度计(752FC)(上海光谱仪器有限公司);Agilent-1260型高效液相色谱仪 (美国安捷伦公司);PPSQ-31A蛋白自动测序仪(日本岛津制作所)。
1.3 方法
1.3.1 单因素试验 选用碱性蛋白酶进行酶解试验,考虑酶解的温度、时间、加酶量、溶液pH和料液比5个因素,将试验分成5组进行,每组均取相同量(10 g)的鱿鱼缠卵腺匀浆5份,比较碱性蛋白酶在不同水解条件下的水解度,以水解物的ANN含量为指标,从而确定较为适合的碱性蛋白酶水解条件范围。氨基氮含量(ANN)与水解度成正相关,采用甲醛电位滴定法测定。
水解工艺:鱿鱼缠卵腺捣碎→匀浆→1 mol/L氢氧化钠调pH→保温→加酶后水解→灭酶(90℃加热15min)→离心(10000r/min、15min)→上清液定容→游离氨基氮含量(AAN)测定。
1)温度。 料液比 1∶6,调 pH 至 8,加 2 500 U/g的酶,在不同温度下(30、35、40、45、50 ℃)酶解 7 h。
2)时间。 料液比 1∶6,调 pH 至 8,加 2 500 U/g的酶,在 45 ℃下恒温酶解不同时间(5、6、7、8、9 h)。
3)加酶量。料液比为1∶6,调pH至8,加入不同量(1 500、2 000、2 500、3 000、3 500 U/g)的酶,在45 ℃下恒温酶解7 h。
4)pH。 料液比为 1∶6,调至不同 pH(7.0、8.0、9.0、10.0、11.0),加 2 500 U/g 的酶,在 45 ℃下恒温酶解7 h。
5)料液比。 加不同料液比(1∶3、1∶4、1∶5、1∶6、1∶7),调pH至8,加2 500 U/g的酶,在45℃下恒温酶解7 h。
1.3.2 正交试验 经单因素试验确定较优试验条件范围,考虑 5 个因素,即温度(A)、时间(B)、pH(C)、加酶量(D)和料液比(E),选取 L16(45)的正交试验,用DPPH清除率来评价不同水解条件下的抗氧化活性。
1.3.3 酶解液超滤 使用超滤杯截取分子量分别为3、5、8、10、30 ku 的超滤膜,将酶解液在 25 ℃环境中分别超滤 12 h,截取获得<3 ku、3~5 ku、5~8 ku、8~10 ku、10~30 ku和>30 ku分子量的酶解液,冷冻干燥后分别测定抗氧化活性。
1.3.4 测定方法 酶解液对DPPH清除率的测定参照文献[15,16]并进行适当改进。酶解液对·OH自由基清除率的测定参照文献[17-19]并进行适当改进。酶解液对O2-清除率的测定参照文献[20-22]并进行适当改进,酶解液对Fe2+螯合能力的测定参照文献[22-24]并作适当改进。酶解液还原能力的测定参照文献[23-25]并作适当改进。
1.3.5 Sephadex G-25层析分离 取抗氧化活性最佳的多肽分子段,冻干样品后进行琼脂糖凝胶G-25层析分离,样品浓度为0.2 g/mL,离心后留取上清液,过0.22 μm滤膜后进行洗脱。洗脱柱尺寸2.6 cm×60 cm;以琼脂糖凝胶G-25填料;柱料颗粒为50~150 μm;上样量 2 mL;取去离子水为洗脱液;流速1.1 mL/min;收集体积为 3.5 mL/管,在 280 nm 处收集各个峰的组分后再进行冷冻干燥,并检测抗氧化活性(以DPPH清除率为标准)。
1.3.6 高效液相分离纯化及目标肽N端序列测定根据上一步各个峰对DPPH清除率的检测得到最佳活性峰组分,大量收集此峰经HPLC反复制备,获得单一峰后,委托北京亿谱生物技术有限公司完成蛋白质的N端序列检测工作。
2 结果与分析
2.1 单因素试验结果
2.1.1 温度 如图1所示,当酶解温度在30~45℃之间,生成的北太平洋鱿鱼缠卵腺ANN会逐渐增多,45℃时达到最高,而到50℃有所下降。因此,正交试验选择的温度范围为40~50℃。
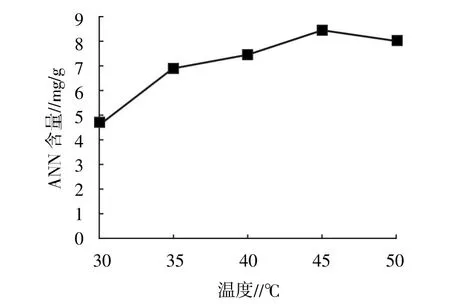
图1 温度对太平洋鱿鱼缠卵腺ANN的影响
2.1.2 时间 如图2所示,当酶解时间在6 h时,生成的北太平洋鱿鱼缠卵腺ANN最多,7 h后逐渐减少。因此,选择酶解时间在5~7 h。
2.1.3 pH 如图3所示,当pH为9.0时生成的北太平洋鱿鱼缠卵腺 ANN 最多,pH 为 8.0、10.0 时,生成的ANN相差不大,因此正交试验选择pH在8.0~10.0。
2.1.4 加酶量 加酶量单因素试验结果如图4所示。当加酶量位于1 500~3 500 U/g,生成的北太平洋鱿鱼缠卵腺ANN随加酶量的增加而增加,可能加入的酶越多,酶与原料接触越充分,效果也越好。因此,正交试验选择加酶量位于2 500~3 500 U/g。
2.1.5 料液比 料液比单因素试验结果如图5所示。当料液比为 1∶3~1∶7时,随着料液比的增加,生成的北太平洋鱿鱼缠卵腺ANN逐渐减少。因此,正交试验选择料液比在 1∶3~1∶5。
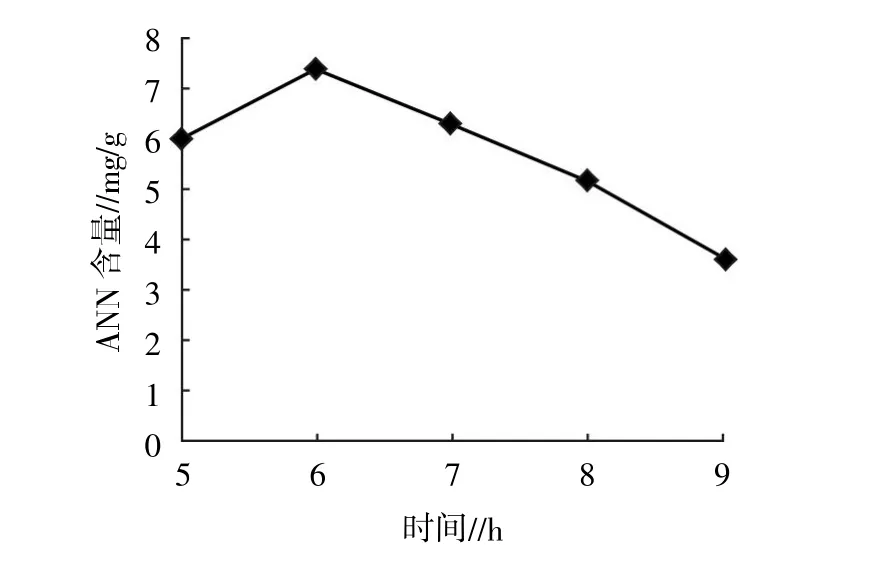
图2 时间对太平洋鱿鱼缠卵腺ANN的影响
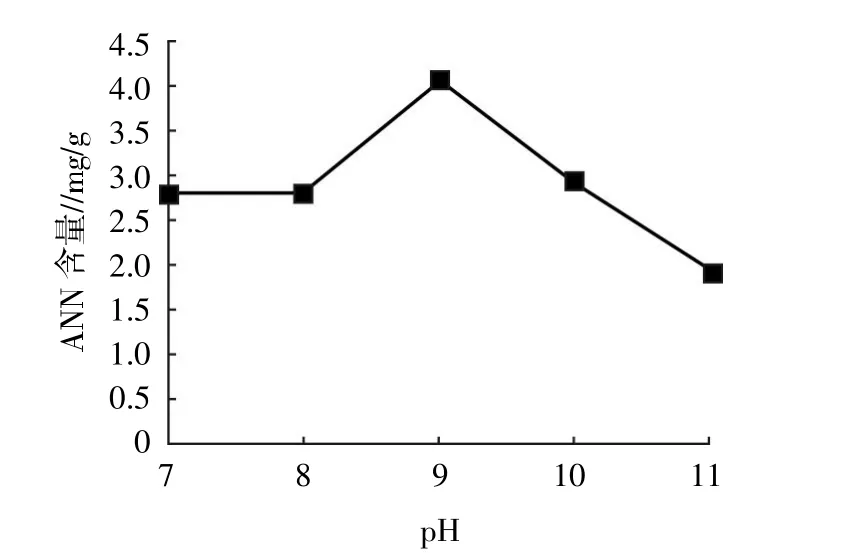
图3 pH对太平洋鱿鱼缠卵腺ANN的影响
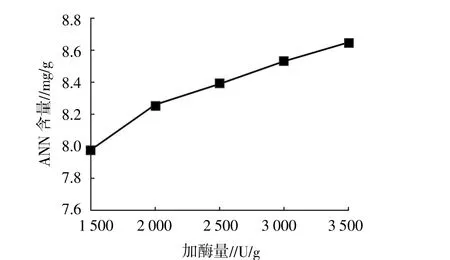
图4 加酶量对太平洋鱿鱼缠卵腺ANN的影响
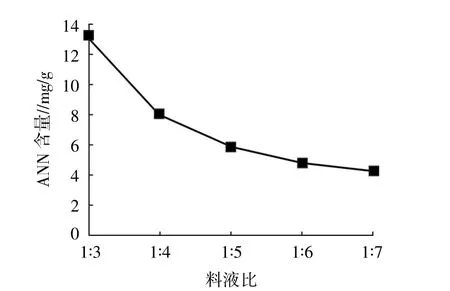
图5 料液比对太平洋鱿鱼缠卵腺ANN的影响
2.2 碱性蛋白酶酶解条件的优化
在初步确定酶解条件的基础上,选择温度、pH、时间、料液比和加酶量5个因素设计4水平正交试验L16(45),确定最佳酶解工艺,结果见表 1。由表1可知,影响碱性蛋白酶水解物羟自由基清除率的各因素中,由大到小排列顺序为B>A>E>D>C,即时间>温度>料液比>加酶量>pH,而且组合A4B3C3D4E4效果最好,即选择温度50℃、酶解时间7 h、加酶量3 500 U/g、pH 9.0、料液比为 1∶6 为最佳酶解条件。
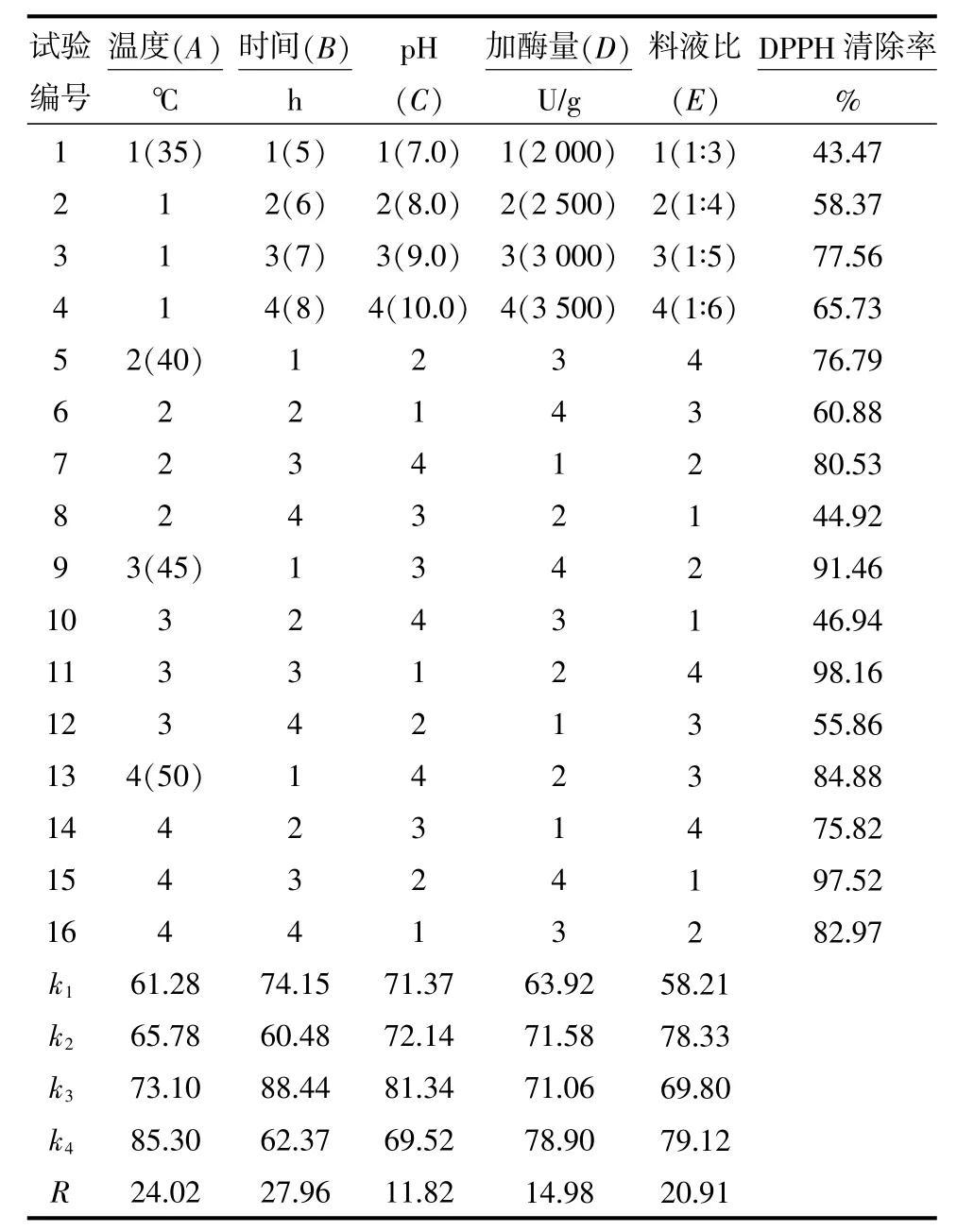
表1 碱性蛋白酶的酶解正交试验结果
2.3 酶解物最佳分子段的选取
将最佳水解条件下得到的水解物经超滤后分离得到<3 ku、3~5 ku、5~8 ku、8~10 ku、10~30 ku、>30 ku不同分子量的多肽,经冷冻干燥,检测浓度为0.5 mg/mL时酶解多肽的还原能力、羟自由基清除率、DPPH清除率、超氧阴离子清除率、Fe2+螯合率,测定结果见图6。从图6至图10可以看出,不同分子量的酶解多肽均有一定的抗氧化能力,但以3~5 ku的酶解多肽清除率最高。因此,下步试验将选取该分子段进行分离纯化。
2.4 Sephadex G-25分离纯化结果
取3~5 ku分子段冻干样品进行琼脂糖凝胶Sephadex G-25层析,于280 nm处出现3个峰,即峰玉、峰Ⅱ和峰Ⅲ,结果见图11。分别收集3个峰组分经冷冻干燥,当浓度为0.5 mg/mL检测其对DPPH的清除率,得出峰玉有较好的清除能力,结果见图12,取峰玉分子段进行HPLC的纯化。
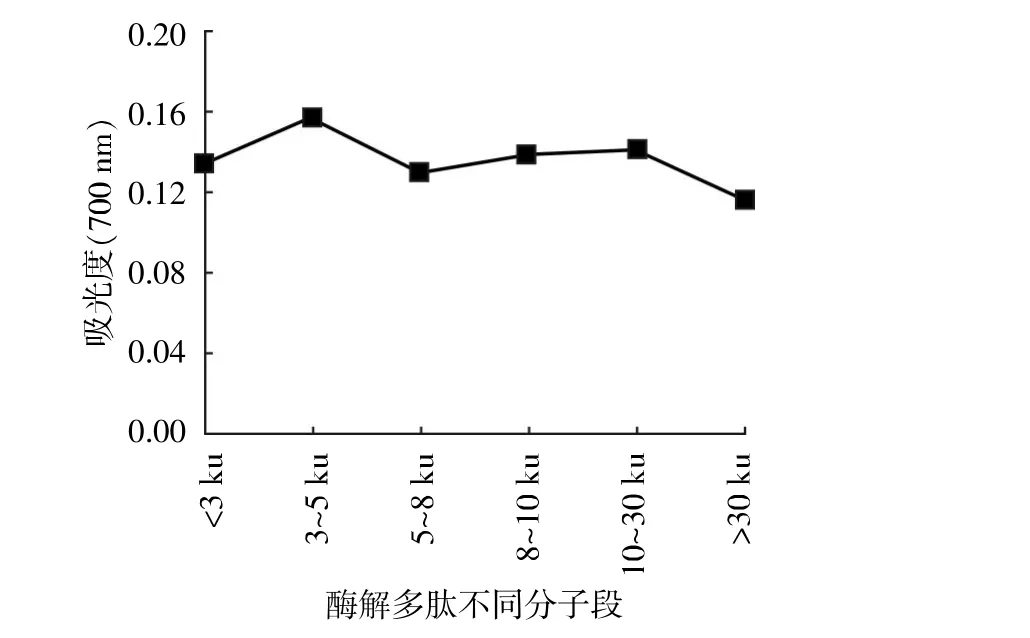
图6 酶解多肽不同分子段的还原能力
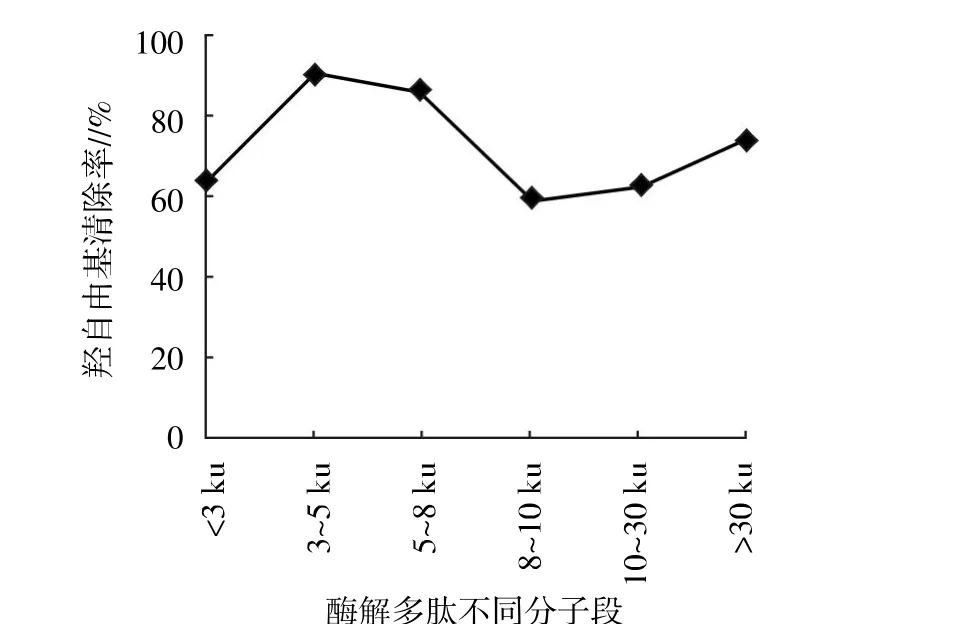
图7 酶解多肽不同分子段对羟自由基的清除率
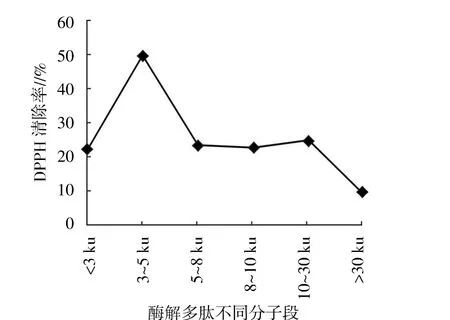
图8 酶解多肽不同分子段对DPPH的清除率
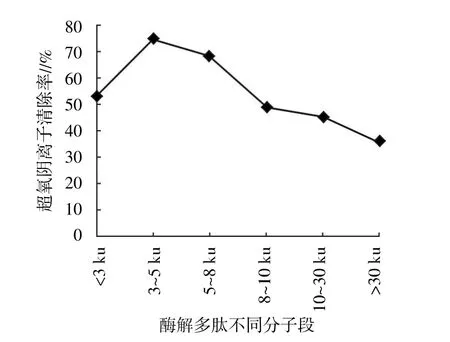
图9 酶解多肽不同分子段对超氧阴离子清除率
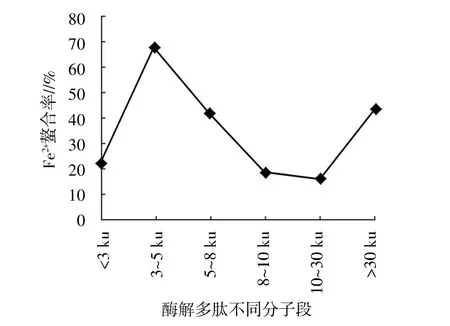
图10 酶解多肽不同分子段的Fe2+螯合率
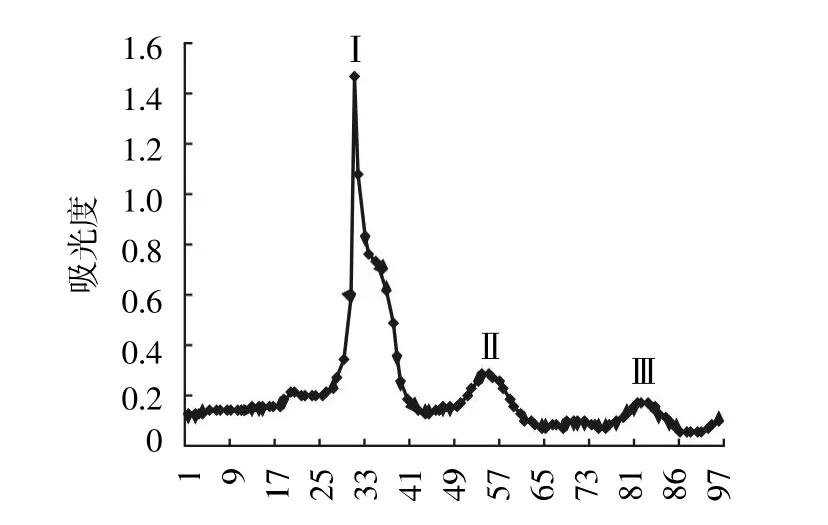
图11 3~5 ku分子段在280 nm处的吸光度
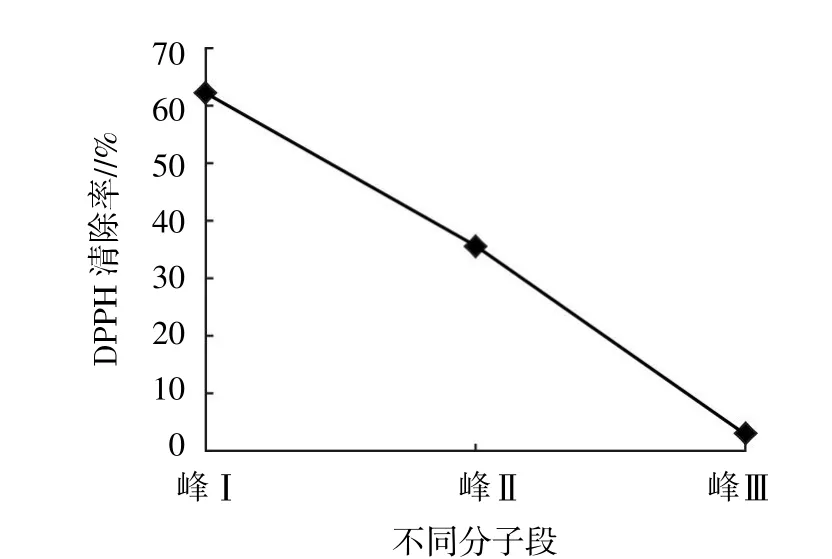
图12 3~5 ku分子段的DPPH清除率
2.5 HPLC分离纯化及目标肽N端序列测定结果
峰玉经HPLC色谱柱反复制备,结果如图13所示。保留时间约为11.8 min时,出现单一峰,经氨基酸序列仪N端序列检测,其氨基酸序列为Ala-Tyr-Ala-Ser-Ser,相对分子质量为 497.50,其结构式见图14。
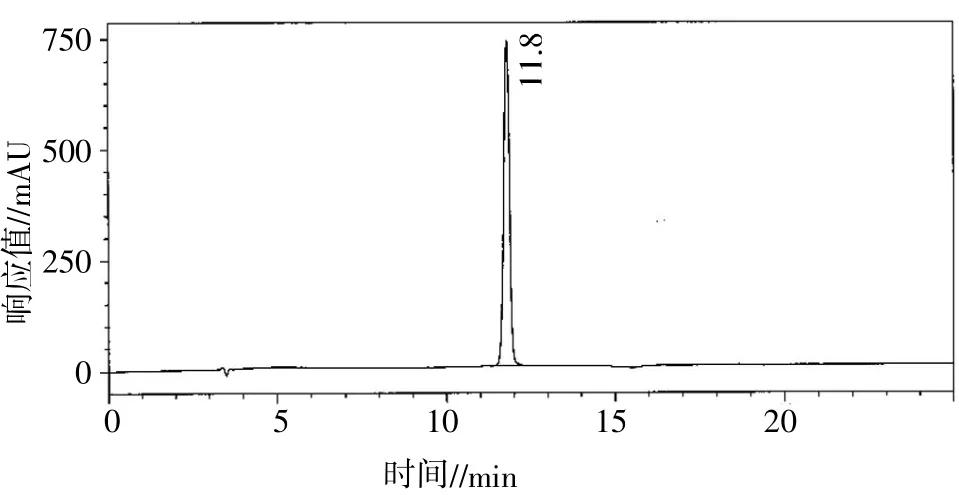
图13 峰玉在219 nm处的高效液相色谱
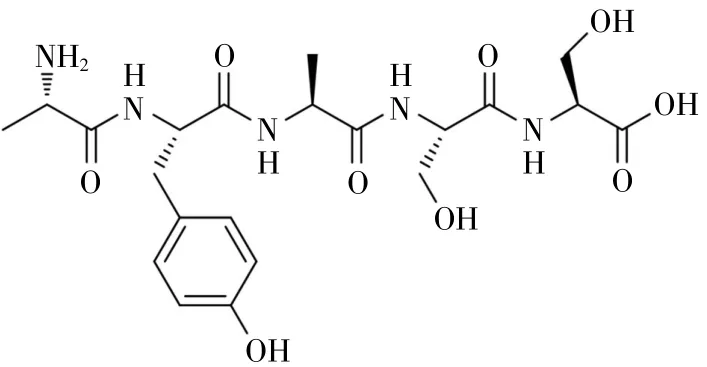
图14 目标肽氨基酸分子结构式
3 小结
以北太平洋鱿鱼缠卵腺为试验原料,结合单因素试验和正交试验,筛选出碱性蛋白酶的酶解条件,即温度50℃、酶解时间7 h、加酶量3 500 U/g、pH 9.0且料液比1∶6。影响碱性蛋白酶水解物DPPH清除率的各因素中,时间>温度>料液比>加酶量>pH。酶解液经超滤获得不同分子段,经抗氧化试验得出最佳抗氧化分子段为3~5 ku。经琼脂糖凝胶G-25层析后,得出3个峰,根据对DPPH清除率的测定,得出峰玉效果明确,当浓度为0.5 mg/mL时其DPPH的清除率为61.87%,后经HPLC分离纯化并经目标肽N端序列检测,得到该目标肽的氨基酸序列为 Ala-Tyr-Ala-Ser-Ser。 因此,认为应用现代生物制备技术酶解北太平洋鱿鱼缠卵腺,可获得抗氧化活性较好的寡肽,发现其内在的价值,增加其附加值,避免优质蛋白的大量流失,可为鱿鱼缠卵腺的精深加工和高值化利用开拓一条新的途径。
