香菇L808单双核菌丝Cx活性和IGS1序列比对分析
2018-08-02宋晓霞黄建春宋春艳陈明杰
宋晓霞,王 倩,赵 妍,黄建春,宋春艳,陈明杰,谭 琦
(上海市农业科学院食用菌研究所,农业部南方食用菌资源利用重点实验室,国家食用菌工程技术研究中心,国家食用菌加工技术研发中心,上海市农业遗传育种重点开放实验室,上海201403)
香菇的营养阶段主要是由两个异源的单核菌丝经质配后形成的双核菌丝,生殖阶段是在菌褶表面的担子中双核经核配、减数分裂形成的担孢子。其他子实体部位都是双核菌丝经组织分化形成,未经过核配[1]。与双核菌丝相比,两个异源单核菌丝的生长速度较慢[2],且没有单独形成子实体的能力。可见,香菇的生长发育过程主要是由受个异源的细胞核基因组协同控制。一般可用交配型对两个异核进行区分,一个是AxBx,一个是AyBy。其中,AxBx单核菌丝具有较高的再生率和较快的生长速度[3-4]。
香菇是一种腐生真菌,在营养和生殖阶段均会向胞外分泌大量的纤维素酶。研究表明:香菇双核菌丝的胞外纤维素酶活性在营养阶段先上升后下降,在原基阶段又上升,在子实体阶段又下降[5]。内切-β-1,4-葡聚糖酶(Cx,EC 3.2.1.4)是纤维素酶系的组分之一[6],又称为羧甲基纤维素酶[7],普遍存在于生物体内,主要通过随机水解糖苷键,将非晶态纤维素和水溶性纤维素衍生物分解成葡萄糖、纤维二糖、纤维三糖和其他寡聚体。羧甲基纤维素酶活性与香菇的平均鲜重呈显著负相关,可作为预测香菇平均鲜重的一个间接性指标[8]。
基因内间隔区(Intergenic spacers,IGS)位于核糖体大亚基和小亚基之间,常用于食用菌菌株鉴定和多样性分析[9-10]。因IGS含有5S rRNA编码基因,故又分为IGS1和IGS2两个区域[11],其中IGS1序列较短,较为保守。Saito等[12]研究16个香菇菌株的IGS1序列发现:不同菌株由于亚重复区的数量不同,IGS1呈现多态性,同一菌株的不同克隆子也表现出多样的IGS1序列。
鉴于香菇双核菌丝的生长发育受两个异源细胞核基因组的协同控制,本研究对香菇L808菌种的双核菌丝和两个原生质体单核菌丝营养生长阶段的Cx活性和IGS1的序列进行分析,以期进一步了解两个单核菌丝所对应的细胞核在双核菌丝分泌Cx和IGS1序列多态性中可能存在的协同作用。
1 材料与方法
1.1 供试菌种
香菇菌种L808由上海市农业科学院食用菌研究所提供。
1.2 培养基
固体培养基:马铃薯葡萄糖琼脂粉(RDA)(美国BD公司)。
液体培养基:葡萄糖20 g,牛肉膏5.6 g,磷酸二氢钾5 g,硫酸镁1 g,蒸馏水1000 mL,pH自然。
1.3 试剂与仪器设备
BCA蛋白含量测定试剂盒,内切-β-1,4-葡聚糖酶(Cx)活性测定试剂盒(苏州科铭生物技术有限公司);Rhire Rlant Direct RCR Kit裂解液(Thermo Fisher Scientific);RCR Magic Mix 3.0(北京天恩泽基因科技有限公司);SanRrep Column DNA Gel Extraction Kit,pUCm-T Vector Cloning Kit,Ultra-Competent Cell Rreps Kit[生工生物工程(上海)股份有限公司]。
直径90 mm无菌塑料平板(Greiner Bio-One GmbH);SX-500高压灭菌锅(Tomy Digital Biology);VS-1300L-U洁净工作台(苏净集团苏州安泰空气技术有限公司);BSR-250培养箱(上海博讯实业有限公司医疗设备厂);ZHWY-2112B恒温摇床(Noki);混匀仪小精灵(Eppendorf);Allegra X-30R 离心机(Beckman Coulter)。
1.4 菌种活化及单核菌丝制备
菌种活化:将冷藏的L808菌种转接到RDA培养基上,25℃黑暗培养7 d,再转至新的RDA培养基上,重复2次以上,备用。
单核菌丝制备:参照王丽宁等[13]制备原生质体单核菌丝的方法获得L808的两个原生质体单核菌丝L808R65和 L808R78。
1.5 菌丝生长速度测定
在洁净工作台上,用打孔器(直径10 mm)分别在长L808、L808R65和L808R78菌丝的RDA培养基上打孔,用接种针各挑3块放入直径为90 mm含有RDA培养基的平板中。每个菌丝设3个重复。25℃ 暗光培养,每4 d测量1次生长速度。由于3个菌丝的生长速度不一致,在L808菌丝已长满平板时,L808R78菌丝前端尚未长到新RDA培养基上,因此L808R78菌丝的在RDA培养基上的形态照片并不与L808和L808R65在同一天拍摄。3个菌丝的生长速度用SRSS 17.0整理与分析。
1.6 Cx活性测定
液体培养和粗酶液制备:在洁净工作台上,用打孔器(直径10 mm)分别在长L808、L808R65和L808R78菌丝的固体培养基上打孔,用接种针各挑3块具菌丝的培养基放入含150 mL灭菌液体培养基的三角瓶(250 mL)中。每个菌丝设3个重复。25℃静置24 h,然后在转速为100 r∕min、温度为25℃的恒温摇床上培养11 d。从静置培养开始,每隔3 d在洁净工作台上分别吸取每瓶发酵液1 mL于2.0 mL离心管中,在4℃下4000 r∕min离心15 min,所得上清液即为粗酶液。整个流程直至培养结束并拍照。
粗酶液蛋白质含量(mg∕mL,表示每毫升粗酶液中的蛋白质含量)测定采用BCA(Bicinchonininc acid)蛋白浓度检测法,内切-β-1,4-葡聚糖酶比活[μg∕(min·mL) prot,将每毫升组织蛋白每分钟催化产生1 μg葡萄糖所需酶量定义为一个酶活力单位]采用3,5-二硝基水杨酸法测定,具体方法参照各试剂盒说明书。
数据分析与整理:采用Excel软件整理分析数据并做图,采用SRSS 17.0进行显著性分析。
1.7 IGS1序列测定及分析
菌丝裂解液:挑少量菌丝于含50 μL裂解液的离心管(0.2 mL)中,并在混匀仪上1650 r∕min混匀1 min。
RCR 反应体系:菌丝裂解液 1 μL,RCR Magic Mix 12.5 μL,无菌 ddH2O 10.5 μL,正反向引物各0.5 μL。正向引物为 IGS-1-R-1:5’-TTGCGACGACTTGAATGG-3’;反向引物为 Le5SrDNA:5’-TAGGATTCCCGCGTGGTCCCCCA-3’。
RCR反应条件及产物检测:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸3 min,25个循环;72℃终延伸5 min。扩增结束后,取4 μL反应产物在1.2%(w∕v)琼脂糖凝胶电泳上检测。
RCR产物回收、连接、转化、克隆和测序:将特异性条带切胶回收(SanRrep Column DNA Gel Extraction Kit)连接至 pUCm-T 载体(pUCm-T Vector Cloning Kit),转入感受态细胞(Ultra-Competent Cell Rreps Kit),经蓝白斑筛选每个菌丝各挑取9个阳性克隆子送生工生物工程(上海)股份有限公司进行测序。
IGS1序列注释与分析:用DNASTAR Lasergene 7.1.0软件中的SeqMan合并同一菌丝IGS1序列完全一致的克隆子,并剔除两端的引物序列。参照NCBI中已有香菇IGS1序列的注释信息对获得的序列进行注释,分别找到28S rRNA、IGS1和5S rRNA区域。用MEGA 7.0比对序列,并用DNAMAN 5.2.2将比对结果输出成TIFF格式。用DNASTAR Lasergene 7.1.0软件中EditSeq统计序列的碱基组成、长度和GC含量。
2 结果与分析
2.1 L808单双核菌丝形态特征
L808双核菌丝在RDA培养基上平均生长速度为(3.08±0.08)mm∕d,边缘整齐。生长前端菌丝稀疏,分枝少,后端菌丝浓密,分枝多。在液体培养基中的菌球较大(图1a);L808R65单核菌丝平均生长速度为(1.15±0.06)mm∕d,边缘整齐,菌丝较L808双核菌丝浓密,分枝多。在液体培养基中的菌球大小居中(图1b);L808R78单核菌丝平均生长速度为(0.65±0.04)mm∕d,边缘不整齐,菌丝浓密成雪白色,在RDA平板和液体培养基中都有色素产生。在液体培养基中的菌球最小(图1c)。
2.2 L808单双核菌丝Cx活性比对
随着培养天数的增加各菌丝胞外蛋白质含量变化幅度和趋势不同(图2a):L808含量变化的幅度最大,从3 d时的28.85 mg∕mL逐步下降到12 d时的15.88 mg∕mL;L808R65含量变化的幅度次之,从3 d时的14.36 mg∕mL 升高到9 d时的20.70 mg∕mL,又在12 d时下降到15.53 mg∕mL;L808R78含量变化幅度最小,主要维持在15.00 mg∕mL左右,仅6 d时的含量低于了15.00 mg∕mL。
随着培养天数的增加各菌丝Cx比活变化幅度和趋势也不同(图2b):L808R78活性变化的幅度最大,从3 d 时的 1.34 μg∕(min·mL) prot上升到 9 d 时的 4.00 μg∕(min·mL) prot,在 12 d 时又下降到2.79 μg∕(min·mL) prot;L808 活性变化幅度次之,从 3 d 时的 0.76 μg∕(min·mL) prot上升到 6 d 时的1.80 μg∕(min·mL) prot,随后又逐步下降至 12 d 时的 1.31 μg∕(min·mL) prot;L808R65 活性变化幅度最小,从3 d 时的2.01 μg∕(min·mL) prot逐步下降到9 d 时的 1.06 μg∕(min·mL) prot又上升至12 d 时的1.91 μg∕(min·mL) prot。
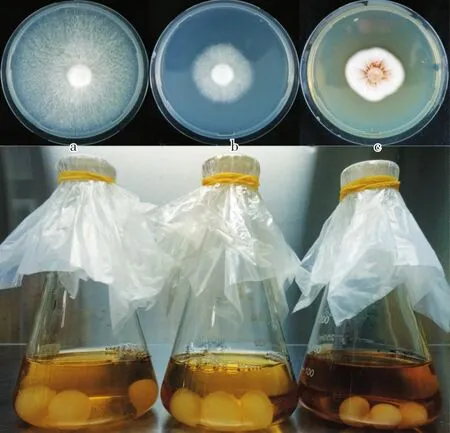
图1 固体和液体培养L808单双核菌丝形态差异Fig.1 Morphological difference among monokaryotic and dikayotic mycelia of L808 on PDA medium and in the liquid medium

图2 L808单双核菌丝不同培养时间蛋白质含量(a)和Cx比活(b)Fig.2 Protein content(a)and specific enzyme activity of Cx(b)among monokaryotic and dikayotic mycelia of L808 at the different cultivation time
2.3 L808单双核菌丝IGS1序列差异分析
通过1.2%琼脂糖凝胶电泳检测(图3a),L808、L808R65和L808R78的 RCR片段长度一致,在1100 bp左右。通过测序,9个L808克隆子明显含有2个不同的IGS1序列:4个克隆的序列一样,命名为L808-c1(GenBank号为 MF177505);5个克隆的序列一样,命名为 L808-c2(GenBank号为 MF177506)。L808R659个克隆的IGS1序列与L808-c1完全一致。L808R78除1个克隆的1个碱基有突变外(A变为G),其他8个克隆的序列与L808-c2完全一致。
L808-c1和L808-c2序列的相似度为96.67%:前者IGS1全长1003 nt(A:278;G:188;T:360;C:177),GC含量为36.39%;后者IGS1全长1041 nt(A:294;G:196;T:371;C:180),GC含量为36.12%。与L808-c2相比,L808-c1仅有两个碱基有替换,主要为碱基缺失(图3b)。
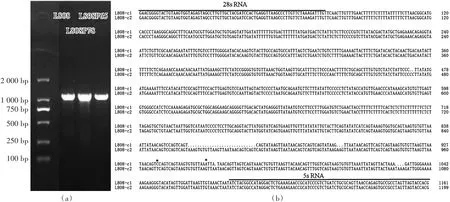
图3 L808单双核菌丝IGS1电泳图谱(a)及L808两个IGS1序列比对(b)Fig.3 IGS1 electrophoresis pattern among monokaryotic and dikayotic mycelia of L808,and alignment between two IGS1 sequences of L808
3 讨论
香菇是一种腐生真菌,在其营养和生殖阶段均会不断向外界分泌胞外酶以分解外界的有机物,从而获取有机营养物。胞外蛋白质是各种胞外水解酶的总合[14],蛋白质含量的不同表明了香菇生长过程中对外界营养物的分解和利用能力。L808在3 d时的蛋白质含量就达到了28.85 mg∕mL,远远高于两个单核菌丝各培养阶段的含量,说明L808在3 d内对外界营养的分解和利用能力就很高。L808R65在9 d时才升高到了20.70 mg∕mL,对外界营养的分解和利用能力居中。而L808R78一直维持在15.00 mg∕mL左右,在第6天还略有下降,对外界营养的分解和利用能力最低。这一变化规律与它们的生长速度有关,无论是在RDA平板还是液体培养基中,L808的生长速度最快,其次是L808R65,L808R78最慢。由于L808双核菌丝的酶活力是由两个异源细胞核协同控制,因此在L808双核菌丝生长阶段分泌胞外酶时可能是L808R65对应的细胞核在起着主效作用。
Cx仅是纤维素酶中的一种,它的活性大小能反映生物分解纤维素的能力。倪新江等[15]发现培养料成分的不同只能影响胞外酶活性的相对大小,而不影响酶活性变化规律。与杨舒贻等[16]同样研究L808双核菌丝的纤维素酶活力变化结果相比,本研究Cx比活变化趋势也是先升高后降低,但出现最高峰的结果不是在第13天而是第6天。估计这与选择张权[17]筛选出的最适L808香菇菌丝生长的液体培养基来培育L808单双核菌丝有关,其做出的酶活最高峰也是在第6天。与L808相比,L808R78出现最高峰的时间要晚,在第9天,但含量却很高,达到了4.00 μg∕(min·mL)prot,远远高于L808和L808R65各个培养时间的活性,说明L808R78分解纤维素的能力最强。由于L808双核菌丝的酶活力是由两个异源细胞核协同控制,因此在L808双核菌丝生长阶段分泌Cx可能是L808R78对应的细胞核在起着主效作用。
本研究中L808双核菌丝共有两个IGS1序列:L808-c1和L808-c2,其中L808R659个克隆子的序列与L808-c1完全一致,L808R788个克隆子的序列与L808-c2完全一致。另一个克隆子的序列仅有1个碱基与L808-c2不同。由于DNA测序很容易产生点突变[18],所以对于获得的拥有1个点突变碱基的L808R78克隆序列是真的突变还是试验误差造成的假阳性,目前很难判断,需要进一步验证。但考虑到两个单核菌丝IGS1位于核糖体DNA(Ribosomal DNA,rDNA)上,而rDNA主要分布在细胞核中的染色体上[19],L808双核菌丝的IGS1序列应该是两个异源细胞核IGS1序列的组合。另外,由于IGS1序列并不直接参与Cx的表达过程,所以单核菌丝的IGS1序列是否与其Cx活性之间存在相关性还需进一步研究,但将IGS1序列作为鉴定和区分L808两个单核菌丝的分子标记还是可行的。
