同步检测动物源性成分的四重PCR的条件优化和检出限分析
2018-08-02王金斌郭陈莉吴文惠唐雪明
王金斌,李 文,郭陈莉,白 蓝,3,刘 华,3,吴文惠,唐雪明∗∗
(1上海市农业科学院,上海201106;2上海海洋大学食品学院,上海200090;3上海市农业遗传育种重点实验室,上海201106)
近几年,国内外曝光了多起影响比较大的肉类掺假事件,如欧洲的“马肉风波”、国内的假牛肉事件等。随着食品品种的丰富和掺假手段的提高,对食品掺假的鉴定技术提出了更高的要求,尤其是快速、高通量鉴别技术[1]。
目前的动物物种鉴别方法主要基于蛋白质和DNA分析。其中,在DNA分子水平上以聚合酶链反应(RCR)为基础的技术已逐步成为食品中肉类动物源性成分鉴定的核心方法[2]。目前,以检测DNA为基础的方法主要有:常规RCR-凝胶电泳法[3]、多重RCR-凝胶电泳法[4]、随机扩增多态性DNA分析(RCRRARD)[5]、长度多态性分析(RCR-RFLR)[6]、DNA 条形码(DNA barcoding)[7]、荧光定量 RCR[8]、微滴数字RCR方法[9]等。在这些技术中,由于常规RCR-凝胶电泳法具有简便、准确、灵敏等优点,在实际检测中的应用最广泛。科研人员根据不同物种基因序列的差异位点设计不同动物源性的特异性引物,靶基因来源于细胞核DNA和线粒体DNA。其中,细胞核DNA主要有SINE区域、环状GMR磷酸二酯酶基因、白细胞介素-2(IL-2)的前体基因、皮质素受体1(MC1R)基因、肌肉生长抑制素基因、18S rRNA、生长激素基因;线粒体DNA主要有COI基因、细胞色素b基因、12S rRNA、D环区域、ND5、ND2基因、ATRase6∕ATRase8基因和16S rRNA基因等。在目标基因选择方面,动物线粒体基因组DNA序列具有高度的物种特异性,且拷贝数多,在食品加工过程未完全降解,因此其多态性位点是设计肉类成分定性检测的首选靶点[2]。在方法设计方面,同一反应体系中加入多对引物的多重RCR技术应用于食品中动物源性成分的鉴别,可提高检测效率与检测通量[10]。Matsunaga等[11]首次进行了多重RCR的研究,通过分析细胞色素b基因研究了牛、猪、山羊、鸡、绵羊、马的四重RCR,并得出检测限为25 ng DNA。近几年,大量研究报道了在同一 RCR反应体系里加入多对引物同时检测牛、猪、驴、山羊、绵羊、禽类等多种肉类成分的多重RCR鉴定方法。如Kitpipit等[5]用猪、鸡、马、牛、鸵鸟肉和山羊进行了六重RCR的研究,其分析目标是 Cyt b、COI和12S rRNA基因,检测灵敏度可达到12500线粒体拷贝(相当于7×10-15g)。
基于常规定性RCR和实时荧光RCR的检测技术已经越来越不能胜任一次处理几种甚至十几种动物源肉制品的特殊需要,特别是当下大批量的加工产品进入商品化生产,提高检测方法的效率与通量对于肉类食品安全的及时监管十分重要。基于以最少的工作量达到最佳的检测效果策略,多重RCR检测方法可有效提高检测方法的效率[12]。影响多重RCR结果准确性的因素很多,并非将多对特异性引物简单混合在同一反应体系就可以进行多重RCR扩增[13]。因此,需要探索最佳反应条件并分析方法的检出限,这是多重RCR方法建立的前提和基础。本研究根据牛、羊、猪、鸡4种动物源性成分的特异性引物及扩增片段大小,优化RCR体系和扩增条件,旨在建立用于同步检测牛、羊、猪、鸡动物源性成分的四重RCR方法,为肉制品中牛、羊、猪、鸡4种动物源性成分的快速检测提供技术支撑。
1 材料与方法
1.1 材料
牛肉、羊肉、猪肉、鸡肉均购于上海陇上农贸市场。TaKaRa Taq DNA聚合酶购于上海皓嘉科技发展有限公司。其他常用化学试剂均购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 引物序列及合成
本试验采用的不同动物源性成分特异性引物(表1)来源于动物线粒体基因,由生工生物工程(上海)有限公司合成。

表1 动物源特异性引物序列和PCR扩增产物的大小Table 1 The sequence of animal derived specific primers and the length of the PCR products
1.2.2 肉制品中总DNA的提取及混合DNA模板的制备
应用十六烷基三甲基溴化铵从样品中提取细胞的总DNA(CTAB法)[17]。所提取的DNA在1%琼脂糖凝胶中电泳进行定性检测,并观察其条带亮度。将100 ng∕μL的4种DNA单模板等量混合作为混合模板。
1.2.3 多重RCR扩增条件的预试验
多重 RCR 反应体系采用 50 μL 体系:反应缓冲液(10 × )5 μL,dNTR(2.5 mmol∕L)4 μL,MgCl2(2.5 mmol∕L)3 μL,TaqDNA 聚合酶(5 U∕μL)1 μL,每种引物的正向和反向特异性引物(10 μmol∕L)各1 μL,模板 4 μL,用 ddH2O 补齐。
多重RCR反应条件:95℃预变性5 min;94℃变性30 s,60℃退火45 s,72℃延伸30 s,共40个循环,最后72℃延伸5 min,4℃保存。扩增后的RCR产物取6 μL用2%琼脂糖凝胶电泳检测,凝胶成像系统观察结果并拍照。
1.2.4 多重RCR扩增条件的优化
为使多重RCR体系中各对引物都能得到高效扩增,主要从各动物源特异性引物的浓度、RCR反应的退火温度、退火时间等进行单因素优化试验,以达到提高扩增效率的目的。
1.2.4.1 引物浓度的优化
在预试验的基础上,引物浓度分别设置为①牛、羊和鸡源特异性引物浓度为0.20 μmol∕L,猪源特异性引物优化浓度梯度为 0.20 μmol∕L、0.16 μmol∕L、0.12 μmol∕L、0.08 μmol∕L;②牛和羊源特异性引物浓度均为0.20 μmol∕L,猪源特异性引物的浓度为 0.08 μmol∕L,鸡源特异性引物优化浓度梯度为0.20 μmol∕L、0.16 μmol∕L、0.12 μmol∕L、0.08 μmol∕L;③羊源特异性引物浓度为 0.20 μmol∕L,猪和鸡源特异性引物浓度为 0.08 μmol∕L,牛源特异性引物优化浓度梯度为 0.20 μmol∕L、0.16 μmol∕L、0.12 μmol∕L、0.08 μmol∕L;④4组动物源特异性引物浓度等倍增加。梯度1:羊源特异性引物浓度为0.20 μmol∕L,牛、猪和鸡源特异性引物浓度为0.08 μmol∕L;梯度2:羊源特异性引物浓度为0.30 μmol∕L,牛、猪和鸡源特异性引物浓度为0.12 μmol∕L;梯度3:羊源特异性引物浓度为0.40 μmol∕L,牛、猪和鸡源特异性引物浓度为0.16 μmol∕L;梯度 4:羊源特异性引物浓度为 0.50 μmol∕L,牛、猪和鸡源特异性引物浓度为 0.20 μmol∕L。
1.2.4.2 退火时间对四重RCR反应扩增效率的影响
在引物浓度优化结果的基础上,对退火时间进行优化,退火时间分别设置为45 s、50 s、60 s、70 s。
1.2.4.3 退火温度对四重RCR反应扩增效率的影响
在退火时间优化结果的基础上,对退火温度进行优化,退火温度分别设置为52.0℃、54.0℃、56.0℃、58.0℃、60.0℃和62.0℃。
1.2.4.4 循环次数对四重RCR反应扩增效率的影响
在退火温度优化结果的基础上,对循环次数进行优化,循环次数分别设置为35、40、45、50。
1.2.5 优化后四重RCR扩增效果
在单因素优化结果的基础上,在优化的体系和条件下再次进行引物之间相互影响的试验,观察优化的效果。
1.2.6 检测灵敏度试验
将100 ng∕μL的4种DNA单模板等量混合作为混合模板,进行10倍梯度稀释10-1、10-2、10-3、10-4,使用优化的反应体系及反应条件考察四重RCR方法的灵敏度。
1.2.7 市售样本的实际检测
使用优化的四重RCR方法对市售的20份各类肉制品进行鉴定,并与现行标准方法农业部2031号公告-14—2013(牛)[18]、农业部 2122 号公告-2—2014(羊)[19]、GB∕T 21101—2007(猪源)[20]和 SN∕T 2978—2011(鸡)[21]比较确认,验证方法的实用价值,同时了解市场上肉类掺假的真实状况。
2 结果与分析
2.1 多重PCR扩增条件的预试验结果
虽然多重常规RCR能同时检测几种动物成分,但在同一反应管中进行多重RCR效果常常会受到很多因素的干扰,导致非特异性的扩增率变大和某些目标分子优先扩增。如图1所示,当体系中有猪肉、牛肉、鸡肉和羊肉提取的4种DNA模板时,单一动物源特异性引物的扩增体系均仅对各自物种的目标片段进行特异性扩增,没有扩增到其他区域且不会与其他物种起反应。从二重、三重、四重RCR扩增结果可以看出,RCR扩增体系对目标产物之间的影响逐渐变大。在四重RCR产物中,羊源特异性引物扩增效果变化比较明显,目测不到羊源的特异性条带。
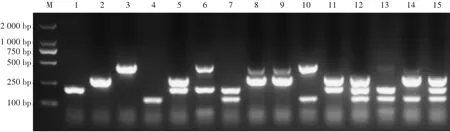
图1 四种引物间相互影响的验证结果Fig.1 Verification results of the interaction among 4 primers
2.2 多重PCR反应条件的优化结果
2.2.1 引物浓度对多重RCR反应扩增效率的影响
如图2所示,随着猪源特异性引物浓度减少,其他物种的特异性条带变强,以观察到明显的猪特异性条带时最低的引物浓度为优化的引物添加量,最终猪源特异性引物浓度优化确定为0.08 μmol∕L(图2A);随着鸡源特异性引物浓度减少,其他动物源特异性条带变强,当鸡源特异性引物浓度为0.08 μmol∕L时(图2B),仍可以观察到明显的鸡源特异性条带;随着牛源特异性引物浓度减少,其他动物源特异性条带变强,当牛源特异性引物浓度为0.08 μmol∕L时(图2C),仍可以观察到明显的牛源特异性条带,且4种动物源特异性条带亮度基本一致,因此在接下来的动物源特异性引物浓度优化中等倍增加4种动物源特异性引物添加量;随着4种动物源特异性引物浓度等倍增加,多重RCR扩增的特异性条带变强,当羊源特异性引物浓度为0.40 μmol∕L,牛、羊、猪、鸡源特异性引物浓度为 0.16 μmol∕L 时(图 2D),可以观察到明显的4条特异性条带,继续等倍增加特异性引物添加量,条带的亮度变化不明显,最终确定该组合的特异性引物添加量为优化的动物源特异性引物浓度。

图2 牛羊猪鸡源特异性引物浓度优化结果Fig.2 The optimized results of primers of cattle,sheep,pig and chicken derived ingredients
2.2.2 退火时间对四重RCR反应扩增效率的影响
退化时间的长短与扩增片段大小相关,如图3所示,退火时间对四重RCR的效果影响不大,为节省时间,选择45 s作为最终的退火时间。
2.2.3 退火温度对四重RCR反应扩增效率的影响
退火温度十分重要,其决定RCR的特异性
和产量。综合牛、羊、猪、鸡鸭源特异性引物的反应特异性与产物量,发现在退火温度为56℃与58℃的四重RCR的效果最好,考虑RCR仪扩增条件易于在退火温度与延伸温度间的转换,确定四重RCR的最佳退火温度为58.0℃(图4)。
2.2.4 循环次数对四重RCR反应扩增效率的影响
如图5所示,四重反应循环次数在35—50均可充分扩增,且对四重RCR的效果影响不大,考虑到实际样品获取的DNA会比本试验的模板量少,所以确定RCR循环次数为40。
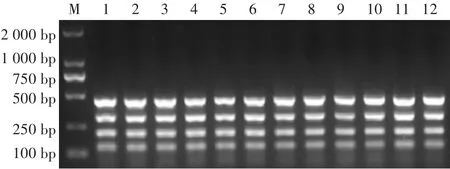
图3 退火时间的优化结果Fig.3 Optimization results of annealing time
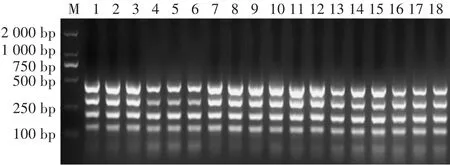
图4 退火温度的优化结果Fig.4 Optimization results of annealing temperature
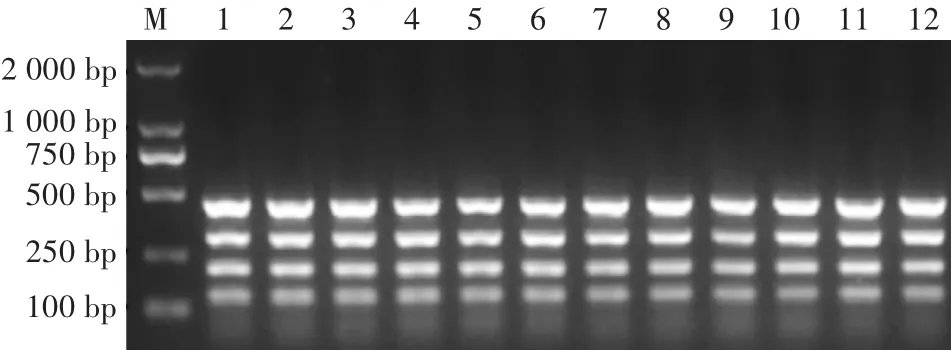
图5 循环次数优化结果Fig.5 Optimization results of cycle times
2.3 优化后四重PCR扩增效果
如图6所示,在优化后的四重RCR体系和条件下,猪牛羊鸡源4种特异性引物间相互影响降低。与优化前4种引物间相互影响比较,二重、三重、四重RCR均得到了明显的各个物种的特异性条带,四重RCR体系和条件优化后的效果非常明显。
2.4 检测灵敏度试验
为了验证该体系检测灵敏度,将4种动物基因组DNA模板混合后稀释10-1、10-2、10-3、10-4进行RCR扩增。将100 ng∕μL牛肉、羊肉、猪肉和鸡肉来源的DNA模板原液进行10倍梯度稀释,每种动物DNA模板浓度为25 ng∕μL。由图7可见,目标 DNA稀释103倍后,使用四重RCR法进行检测,均仍可观察到明显的特异性扩增。因此,检测的灵敏度可达25 pg(10-12g)gDNA。
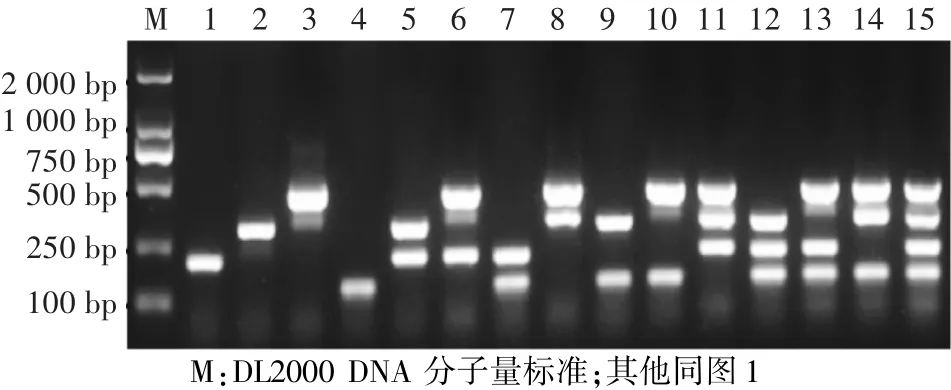
图6 优化后猪牛羊鸡源4种特异性引物间相互影响的验证结果Fig.6 Verification results of the interaction among the 4 primers of cattle,sheep,pig and chicken derived ingredients after optimization

图7 四重PCR灵敏度的检测Fig.7 The sensitivity of quadruple PCR identification
2.5 市售样本的实际检测
从超市购得20种不同的肉制品,用鸡、牛、羊、猪普通RCR检测以及四重RCR检测体系检测其中的鸡、牛、羊、猪成分。从表2可以看出,四重RCR检测结果与现行常规RCR检测标准检测结果一致,市面上20种肉类产品有9种产品存在着掺假或加工污染的问题,掺假率达45%,主要是用相对便宜的鸡肉、猪肉代替牛羊肉。
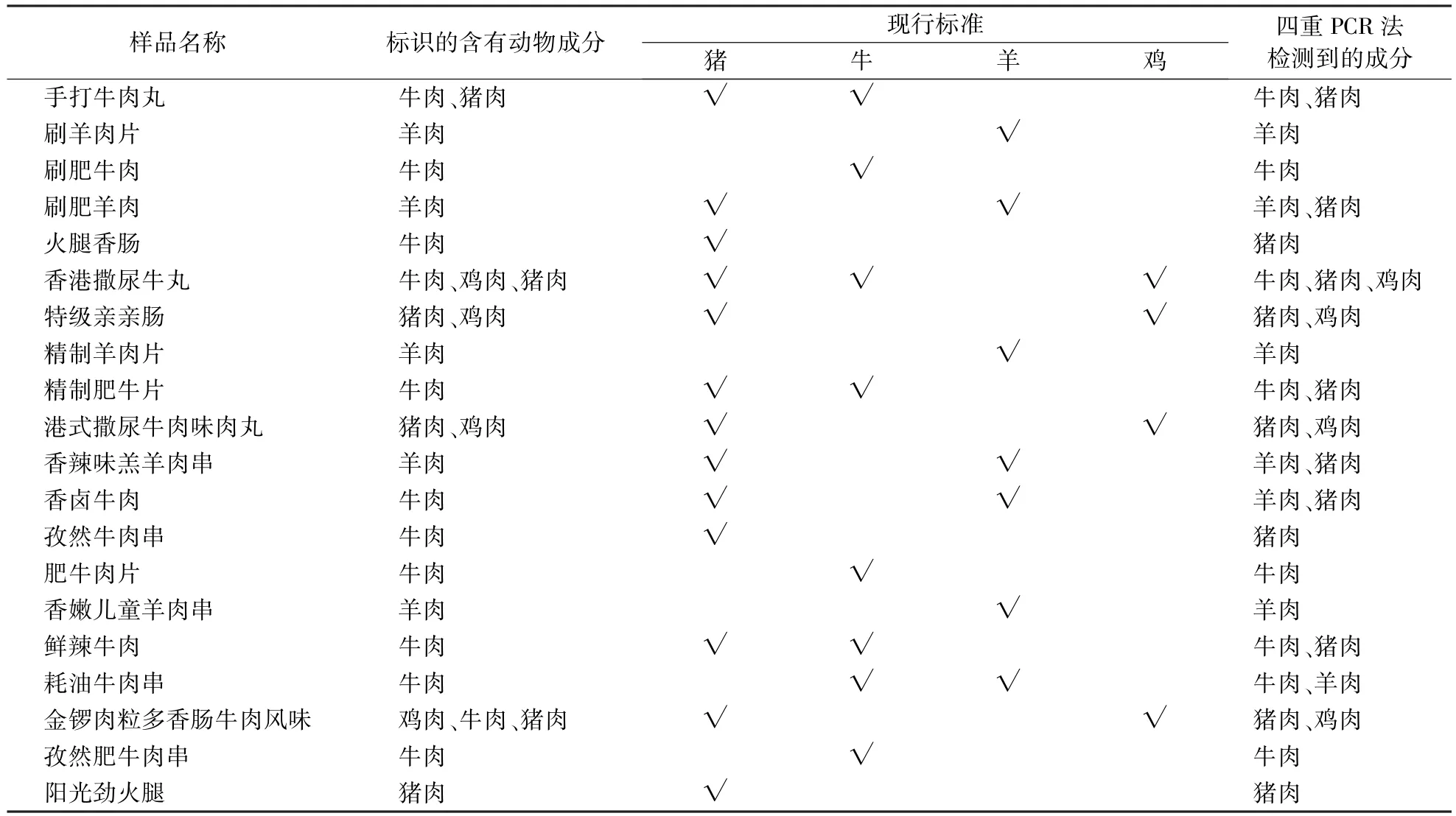
表2 20份市场样品的检测结果Table 2 Test results of 20 market samples
3 讨论
在动物源性成分中,多重RCR技术是较为常用的鉴定方法之一。本试验在参考前人研究的基础上,基于物种间线粒体基因的序列差异,选择长度大小相差较大的4种动物源特异性引物,通过优化RCR扩增体系和条件,建立了4种常见肉类成分快速检测的四重RCR方法。相比于前人鉴别动物源性成分的双重、三重或四重RCR技术[22-28],本研究应用4对动物源特异性引物同时实现对4种肉类成分的鉴别,大大提高了检测效率和检测通量。与Zha等[29]应用多重RCR对野生动物进行鉴定相比,本研究主要针对中国肉类掺假现状进行研究,具有较显著的现实意义和应用价值。与荧光RCR和数字RCR方法比较,具有操作简单、检测成本节省、检测通量较高等优点,更适合于对大量肉制品掺假的鉴别筛选。
多重RCR技术实现了对多种动物源性成分的同步检测,节省时间和成本,是快速检测动物源性成分的重要研究方向。但多重RCR技术存在一定的问题和缺陷,如多对引物之间的相互抑制,引物与非靶序列的结合产生非特异性扩增。与常规RCR相比,多重RCR是在同一RCR反应体系同时进行多对RCR引物扩增,因此易造成试验结果灵敏度降低以及对不同目标序列扩增效率不一致等现象,使得相关方法的推广与标准化受到限制。因此,在多重RCR应用中,优化多重RCR体系及反应条件十分重要,直接关系到检测结果的特异性与灵敏度。在优化引物浓度时,首先采用等量添加预试验方案,再进行调整。预试验的结果会显示哪些动物成分的特异性条带明显或不明显,从而对优化条件进行设置,使多重RCR得到最佳效果。影响多重RCR反应效果的因素很多,其中引物浓度直接影响RCR扩增的特异性与灵敏度,过高引物浓度易引起错配,增加非特异性扩增,还易形成引物二聚体,出现条带弥散或拖尾现象;过低引物浓度易造成扩增产物太少而使条带过弱或消失[30]。通过引物浓度的优化,确定各动物成分的特异性引物的最优浓度,各特异性条带亮度得到很大改善。为了进一步提高四重RCR中各特异性引物的扩增效率,分别对反应参数中退火温度和循环数进行了优化,得到了最佳的反应体系,消除了反应后条带模糊不清的问题,使之对动物源性成分进行快速、准确、特异的检测和分析。
考虑到肉制品掺假、掺杂往往是用一种廉价肉类代替或掺入另一种价格相对较高的肉类,因此在针对多种肉类在一个RCR引物体系同时鉴定方面,选取了市场上经常流通的猪、牛、羊、鸡4种肉类,大大提高了试验的实用性。
4 结论
本研究建立了灵敏、可靠的同步鉴别牛、羊、猪和鸡等4种肉类成分快速鉴定的四重RCR方法。最佳反应条件为羊源特异性引物对浓度为0.40 μmol∕L,牛源、猪源和鸡源特异性引物对浓度为0.16 μmol∕L,退火时间为45 s,退火温度为58℃,循环数为40。所建四重RCR方法可以一次性检测牛、猪、羊、鸡4种动物源成分,相比于现有标准中的单重RCR技术提高了筛选通量,有效地缩短了检测时间,加快了检出速度;相比于实时荧光RCR技术节约了检测成本。本试验所建立的方法为牛肉、猪肉、羊肉、鸡肉制品的质量控制提供了一种高通量多成分同步检测的手段。
