利用CRISPR/Cas9系统敲除斑马鱼bco1基因与bco1l基因
2018-08-01李文龙冯永永李凯彬聂湘平
李文龙,冯永永,李凯彬,*,聂湘平,#
1. 暨南大学生命科学技术学院生态系/水生生物研究中心,广州 510632 2. 中国水产科学研究院珠江水产研究所,广州 510380
维生素A是一种必需生物活性物质,但是动物本身并不能直接合成维生素A。有证据表明,过量的维生素A对动物体具有一定的毒性[1]。因此,动物大都不能直接喂食维生素A而需要摄食植物来源的维生素A前驱物质,然后在体内转化成维生素A。其中β-胡萝卜素是较为重要的来源[2]。β-胡萝卜素-15,15′-加氧酶(β-carotene-15,15′-momoxygenase 1,bco1)是将β-胡萝卜素转化为维生素A的关键酶,因此该酶对动物体内胡萝卜素消化吸收、代谢转运及动物生长发育等都有重要影响。它能够通过对称性裂解将β-胡萝卜素在15′,15′键位置断开,生成2分子的全反式视黄醛,最后生成视黄酸或维生素A[3]。在通过用定点诱变替换小鼠bco1酶中保守的组氨酸和酸性残基以及整个家族中非保守的4个组氨酸和一个谷氨酸来产生突变形式的bco1的研究中发现,bco1的活性中心由4个完全保守的组氨酸和5个酸性残基(His172,His237,His308,His514,Asp52,Glu140,Glu314,Glu405和Glu457)组成,此酶必须通过亚铁离子与4个残基、水、氧分子连接,组成一个特殊的八面体结构才具有活性,4种保守组氨酸和Glu405中的任何一种产生突变都会导致小鼠bco1活性完全丧失[3-4]。Hessel等[5]在敲除小鼠bco1基因的试验中发现,bco1功能的缺失能够导致维生素A缺乏,当进一步喂食富含β-胡萝卜素的饲料后,在小鼠的肝脏、肺脏和脂肪组织均有大量的β-胡萝卜素积累。因此bco1是β-胡萝卜素转化成维生素A过程中关键酶[6]。
Clustered regularly interspaced short palindromic repeats/CRISPR-associated 9 (CRISPR/Cas9) 系统,是利用继锌指核酸内切酶(zinc finger endonuclease,ZFN)和转录激活因子样效应物核酸酶(transcription activator-like effector nuclease,TALEN)之后第三代人工核酸内切酶的基因编辑系统,可用于多种基因组的编辑[7]。该系统最初是细菌应对噬菌体、病毒、质粒或其他染色体编码序列等的免疫系统[8]。其原理是通过特定的小分子RNA识别靶向序列,以此导向核酸内切酶Cas9结合到相应的位点上,并造成平末端双链缺口。裂解位点通常由错误倾向的非同源末端连接(NHEJ)机制不完全修复,通过引入插入或缺失导致基因突变。与第一代基因编辑技术的锌指核酸酶(ZFN)和第二代基因编辑技术转录激活子样效应核酸酶(TALEN)等其他靶向突变工具相比,CRISPR/Cas9的实验设计非常简单快速[7]。目前已有在人类细胞、斑马鱼[9-12]和小鼠等多种基因组靶向修饰上成功应用该技术的例子。该技术可以对基因进行移码突变、定点敲入、两位点同时突变和小片段的缺失等基因修饰。由于其突变效率高、制作简单及成本低的特点,被认为是一种具有广阔应用前景的基因组定点改造分子工具[13]。
斑马鱼(Daniorerio)因其个体小,便于饲养,已作为生物、医学、生态毒理等多个领域的模式动物被广泛研究,在环境毒理及医学等方面研究都有成熟的标准方法[14-17]。斑马鱼繁殖快,单次产卵数量多,而且卵期的胚胎全透明,可以十分便捷地观察整个胚胎发育过程。以斑马鱼受精卵作为胚胎急性毒性暴露实验已成为一种公认的检测物质毒性的有效方法,不仅与成鱼毒性试验有较好的对应关系,而且更为敏感,并且能够完善成鱼实验无法实现的有关发育影响的研究[18-19]。因此,本实验利用CRISPR/ Cas9系统敲除斑马鱼的与bco1编码相关的bco1和bco1l基因,并且通过多代遗传获得具有可遗传突变类型的个体,为深入开展对斑马鱼bco1的功能研究、以及后续对bco1和bco1l基因两者功能与关系的研究奠定基础。
1 材料与方法(Materials and methods)
1.1 实验材料
斑马鱼Tuebingen(Tu)品系野生型由珠江水产研究所提供;引物由生工生物工程(上海)股份有限公司合成;质粒pXT7-Cas9和pMD-gRNA由北京大学的熊敬维与张博教授提供[20-21]。超微量基因型鉴定YSY Buffer(南京尧顺禹生物科技有限公司);Golden Easy PCR System (TIANGEN);凝胶电泳回收试剂盒Gel Extraction Kit D2500-02(Omega);PCR产物回收试剂盒(Axgen);gRNA用体外转录试剂盒MAXIscript®T7 Kit(Ambion);Cas9 mRNA及yfp-nanos3 mRNA用体外转录试剂盒T7 mMESSAGE mMACHINE Kit(Ambion),加尾试剂盒Poly (A) Tailing Kit(Ambion, AM1350);RNA纯化试剂盒RNease Mini kit T4104(Qiagen);基因型检测用载体pMDTM18-T Vector Cloning Kit(TaKaRa);PrimeSTAR Max DNA Polymerase(Takara)。
1.2 实验方法
1.2.1 查找序列
在基因组序列数据库网页http://asia.ensembl.org/中搜索斑马鱼bco1与bco1l相关基因信息,包括核苷酸序列、基因组结构、蛋白质的保守功能结构域等。根据所得该基因信息选定其中涉及所有转录本的外显子一段序列,特别是要优先选择编码蛋白质保守功能结构域的外显子及靠近上游的外显子。根据所选片段设计检测引物并进行验证,确定可以扩增出所需片段,确定能够设计多个sgRNA识别位点以保证检测到有效的sgRNA。
1.2.2 CRISPR的设计与合成
在CRSIPR设计网页http://crispr.mit.edu/中输入选定的序列,可得到所有可用的CRISPR序列以及相应的评分。选取合适位点的CRISPR序列作为检测对象,在选取的CRISPR序列前方添加T7启动子序列TAATACGACTCACTATA及识别碱基G(如所设计CRISPR序列起始碱基即为G,可不加),后方添加部分骨架序列GTTTTAGAGCTAGAAATAGC(由生工生物工程(上海)股份有限公司合成设计的DNA片段),然后以合成DNA片段作为正向引物及骨架通用反向引物PRgRNA: 5′AAAAAAAGCACCGACTCGGT 3′,以pMD-gRNA质粒作为模板,用PrimeSTAR Max DNA Polymerase(Takara)通过PCR扩增出转录所需DNA片段,PCR反应条件为35×(98 ℃、10 s; 55 ℃、5 s; 72 ℃、5 s); 4℃保存,各成分用量按照说明书确定。用2%琼脂糖凝胶进行电泳确定目标片段,PCR产物经过无RNA酶污染的PCR产物回收试剂盒纯化回收后,用2%琼脂糖凝胶进行电泳确定目标片段;再以纯化产物为模板,用MAXIscript®T7 Kit转录成RNA,加入无RNA酶污染的醋酸钠至体系(pH=5.2),再加入无RNA酶污染的无水乙醇至体积分数为70%,置于-20 ℃过夜。过夜沉淀后体系在4 ℃、12 000 g条件下离心20 min,弃上清;以70%无RNA酶污染的无水乙醇清洗沉淀,再在4 ℃、12 000 g条件下离心20 min,弃上清,加10L DEPC-H2O溶解沉淀,取2L以2%琼脂糖凝胶进行电泳,以确定目标片段,并用微量分光光度计(OD 1000, One drop)测定浓度,备用。
1.2.3 Cas9 mRNA与yfp-nanos3 mRNA的合成
Cas9 mRNA与yfp-nanos3 mRNA则在各自的质粒以EcoRI、HindIII酶,在37 ℃下酶切过夜后,用2%琼脂糖凝胶进行电泳确定目标片段,经过无RNA酶污染的PCR产物回收试剂盒纯化回收,再由无RNA酶污染的T7 mMESSAGE mMACHINE Kit转录,并用无RNA酶污染的Poly (A) Tailing Kit进行带帽加尾,用无RNA酶污染的RNA纯化试剂盒RNease Mini Kit T4104纯化后,用2%琼脂糖凝胶进行电泳确定目标片段并用微量分光光度计(OD 1000, One drop)测定浓度,备用。
1.2.4 显微注射
于注射前一天把野生亲本以雌:雄为1:2的比例放置到产卵缸内,并且以隔板隔开,黑暗养殖8 h以上。注射当天早上拉开隔板,待野生亲本产卵后,于Ⅰ-细胞期内,将Cas9 mRNA调整到300 ng·L-1,与yfp-nanos3 mRNA、sgRNA各0.5L混匀进行显微注射。
1.2.5 sgRNA活性检测
在显微注射后的12 h至24 h之间,在荧光显微镜下挑选5个能观察到黄色荧光的鱼卵,制备基因组DNA模板,以各自目标片段检测引物进行PCR扩增,PCR反应条件为94 ℃,5 min;35×(94 ℃、30 s; 58 ℃、30 s; 72℃、30 s);72 ℃,10 min;4 ℃保存,各成分用量按照说明书要求确定。PCR产物经过2%琼脂糖凝胶进行凝胶电泳后用凝胶电泳回收试剂盒纯化,纯化产物与pMDTM18-T载体进行连接,各成分用量按照说明书要求,转化至感受态大肠杆菌中,将热激活后的大肠杆菌涂至含氨苄抗性的LB培养基平板上,培养18 h后挑取12个单菌落分别培养后进行测序,检验是否出现突变、突变效率及突变位点以确定获得有活性的sgRNA。
1.2.6 可遗传突变个体的筛选与培育
同批量注射的斑马鱼受精卵选定作为首建者在实验室养殖,性成熟后配对繁殖,受精卵发育至1 000细胞以上时制备基因组DNA模板,通过PCR检测、凝胶电泳及测序,了解不同F0亲鱼所能产出F1代目标基因的突变情况,检测bco1基因引物为正向引物bco1-S1: 5′AGGCAAGTTAGGGTAATGAT3′,反向引物bco1-A1:5′TCAACTGCACCACAGAGTAA3′;检测bco1l基因引物为正向引物bco1l-S1: 5′CTTGCCTCCCAGAATTGAC3′,反向引物bco1l-A1:5′CTGAGAACAGACCAGGACCATT3′。选取F1代经PCR检测后,进行凝胶电泳时出现明显双条带样品,提示出现了较大片段的缺失或插入突变,便于后续对突变位点的检测;通过测序比对,筛选缺失或插入碱基数非3倍数突变,在此基础上选择产出长片段有效突变的首建者鱼,产卵获得F1代群体。F1代培养至性成熟,通过检测尾鳍的DNA筛选所需基因型的F1代鱼,相同基因型的F1代鱼自交得F2代,待F2代培养至50日龄,通过检测尾鳍的DNA筛选出突变纯合子。
2 结果与讨论(Results and discussion)
2.1 所得基因相关信息
由网页http://asia.ensembl.org/查得bco1与bco1l基因序列信息,bco1基因信息见网页(http://asia.ensembl.org/Danio_rerio/Gene/Summary?db=core;g=ENSDARG00000104256;r=7:65037326-65066446);bco1l基因信息见网页(http://asia.ensembl.org/Danio_rerio/Transcript/Summary?db=core;g=ENSDARG00000103659;r=7:65016199-65028910;t=ENSDART00000168287)(图1)。
根据bco1中蛋白质保守功能结构域和共同区域蛋白质序列,将敲除的目标序列设计在3个转录本共同对应的保守的蛋白质结构域上,对应于bco1-001转录本Exon 4和Exon 5(bco1-002:Exon 3和Exon 4; bco1-003:Exon 2和Exon 3)。其中,Exon 4检测引物为正向引物bco1-4S:5′ATGTAGTTCTGGTCAGGTCA3′;反向引物bco1-4A:5′GTCACGTGGTCAAGTTGTCA 3′;Exon 5检测引物为正向引物bco1-5S:5′AGGCAAGTTAGGGTAATGAT3′;反向引物bco1-5A:5′TCAACTGCACCACAGAGTAA3′(表1)。
根据bco1l基因序列信息,得知其Exon 2和Exon 3之间内含子较短,而Exon 1和Exon 2之间内含子太长,因此将敲除的目标序列设计在Exon 2和Exon 3上,检测引物为正向引物bco1L2-3S:5′CTTGCCTCCCAGAATTGAC3′;反向引物bco1L2-3A:5′TGTAGTTGACCTCCGATGA3′(表2)。
根据以上所获得斑马鱼bco1与bco1l基因的相关信息,分析相关信息发现,bco1与bco1l基因均位于第7号染色体上,且属于前后紧密连锁关系。目前bco1基因已有相关文献报道,而缺乏关于bco1l基因的相关信息,此次试验将两者分开单独敲除,以便后续研究确定两者功能与关系。
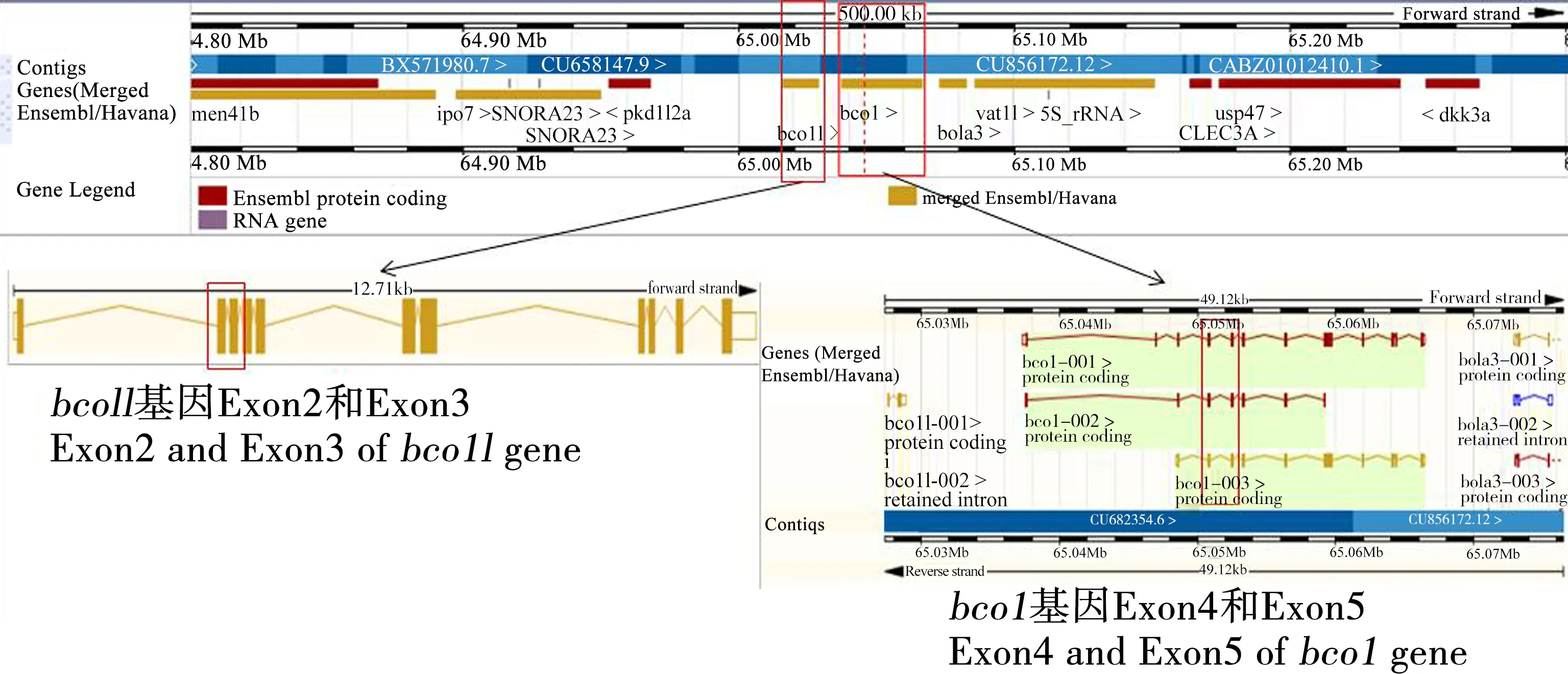
图1 斑马鱼bco1与bco1l基因在基因组上的位置与结构Fig. 1 Locations and genomic structures of bco1 gene and bco1l gene of zebrafish genome

表1 斑马鱼bco1基因Exon 4和Exon 5序列信息Table 1 Sequence information of Exon 4 and Exon 5 of bco1 gene of zebrafish
2.2 sgRNA的设计与有效性的检测
对于bco1基因,此次位点选择在所有转录本共有外显子中的第二、三个外显子上,选取表3中sgRNA进行显微注射,如图2检测到有效sgRNA为bco1-gRNA-4与bco1-gRNA-5,在12个单克隆测序结果中,sgRNA4位点突变样本有10个,sgRNA5位点突变样本有12个,两位点共同突变样本有10个,且2个sgRNA位点临近,故选取这2个sgRNA进行批量注射,获得F0代。
对于bco1l基因,此次位点选择在第二、三号外显子上,选取表4中sgRNA进行显微注射,如图2检测到有效sgRNA为bco1l-gRNA-1与bco1l-gRNA-2,在12个单克隆测序结果中,此2个sgRNA位点突变样本各有1个,并没有两位点共同突变的样本,2个sgRNA位点有所重叠,故选取这2个gRNA进行批量注射,获得F0代。
此次实验成功设计并获得有效的sgRNA,然而2个基因上的gRNA效率相差非常大:bco1基因上选取的2个sgRNA效率可高达100%,而bco1l基因仅有2个sgRNA检测到有效,且效率最高也只达到8.33%(表5)。

表2 斑马鱼bco1l基因Exon 2和Exon 3的序列信息Table 2 Sequence information of Exon 2 and Exon 3 of bco1l gene of zebrafish

表3 根据bco1基因选取的sgRNA靶位点寡核苷酸序列Table 3 Selected sgRNA target site oligonucleotide sequence of bco1 gene

表4 根据bco1l基因选取的sgRNA靶位点寡核苷酸序列Table 4 Selected sgRNA target site oligonucleotide sequence of bco1l gene

表5 斑马鱼bco1与bco1l基因有效sgRNA靶位点寡核苷酸序列及其效率Table 5 Effective sgRNA target site oligonucleotide sequence of bco1 gene and bco1l gene and their efficiency

图2 F1代bco1基因筛选过程及突变类型注: (A) F1代部分突变类型凝胶电泳图,其中M,Marker;WT,Wild type;1#~7#为7种F1代突变个体,各组突变碱基数为1#,-41/0;2#,-31/0;3#,+37/0;4#,-16/+37;5#,-17/0;6#,+11/0;7#,-1/0。(B) 单克隆前后测序结果对比图,其中(1)为4#号双条带样本测序结果,在突变位点后出现双峰;(2),(3)为该样本通过单克隆后的测序结果,分别与野生型序列进行对比得出图(C)的结果。(C) F1代单克隆样本测序结果对比所得突变基因型情况,下划线部分为gRNA位点,蓝色标注为前间区序列邻近基序(protospacer adjacent motif, PAM),红色标注为插入碱基,虚线表示缺失碱基。Fig. 2 Screening process and genotypes identified in F1 generation of bco1 mutantsNote: (A) Gel electrophoresis map of part of genotypes found in F1 of bco1 mutants; M, Marker; WT, Wild type; 1#-7#, 7 types of bco1 mutants in F1 generation, number of mutated bases in each type as 1#, -41/0; 2#, -31/0; 3#, +37/0; 4#, -16/+37; 5#, -17/0; 6#, +11/0; 7#, -1/0. (B) Schematics of monocloning sequencing, (1) is the sequencing result of 4# in (A); (2),(3) are the sequencing results of monoclonal samples of 4# in (A), compared with the sequence of wild type, and then obtained (C); (C) NGG (blue) is the PAM (protospacer adjacent motif) sequence. Insertion is highlighted in red and deletion is represented by a dashed line.

图3 斑马鱼bco1l基因检测得到的部分突变类型注:下划线部分为gRNA位点,蓝色标注为前间区序列邻近基序(protospacer adjacent motif, PAM),红色标注为插入碱基,虚线表示缺失碱基。Fig. 3 Part of genotypes found in bco1l mutantsNote: NGG (blue) is the PAM (protospacer adjacent motif) sequence. Insertion is highlighted in red and deletion is represented by a dashed line.
2.3 可遗传突变个体的筛选和获得
对于基因bco1,F1代筛选过程及检测所得基因型如图2,图中下划线部分为sgRNA识别位点,蓝色标注为前间区序列邻近基序(protospacer adjacent motif, PAM),红色标注为插入碱基,虚线表示缺失碱基。由于该基因所用的2个sgRNA效率较高,而且邻近,因此获得较多双条带的样本,挑选双条带差距较大的样本进行测序,确定突变位点,并通过单克隆样本测序确定两等位基因的突变情况(见图3)。由于筛选出了插入37个碱基(+37)和缺失16个碱基(-16)的基因型(-16/+37)突变体,其基因型较为理想,因此以此突变体进行建系,自交得出F2代。
对于基因bco1l,筛选过程同基因bco1,但由于此基因敲除所用sgRNA效率较低,因此得到双条带样本极少,于F1代检测所得基因型如图3,图中下划线部分为gRNA位点,此处2个gRNA识别序列有4个碱基的重叠,蓝色标注为PAM结构(NGG),红色标注为插入碱基,虚线表示缺失碱基。选取插入14个碱基(+14)的基因型(+14/0)突变体进行保种培养,自交得出F2代。
此次试验中,在选取F0代个体时,通过F0配对自交,制备受精卵基因组DNA模板进行PCR和凝胶电泳验证,保留在凝胶电泳图为双条带并且突变碱基数为非3倍数的亲本产卵以培育F1代。F0代自交获得纯合子后代效率理论上比F0代与野生型杂交获得纯合子后代的效率高。但此次在F1代中并没有获得足够的双突变个体,仅发现有2条双突变个体,但是突变类型完全不同,分别为(-16/+37)基因型和(-17/+11)基因型,因此无法配对留做后续使用。此外,在凝胶电泳图要得到清晰稳定的双条带,除了PCR产物大小要控制在100~300 bp外,对引物的特异性也有一定的要求,并不是能够得出单一野生型条带的引物就一定能够获得清晰稳定的双条带,与所用的PCR试剂也有一定的关系,需要事先摸索条件加以确定。
斑马鱼bco1基因突变体F2代的基因型检测中从260尾F2代中共获得42尾缺失16碱基的突变型(-16/-16)基因型纯合子个体,以供后续研究。并保留10余尾(-16/+37)基因型突变体作为保种培养;bco1l基因突变体F2代的基因型检测中共检测出91尾,其中杂合子65尾(+14/0),野生型26尾(WT),比例为杂合子:野生型=2.5:1,符合孟德尔遗传定律,因此可以认为bco1l基因突变纯合致死。而此前曾以bco1l基因突变体F2代刚孵出的幼鱼进行基因型确认时,检测出突变纯合基因型,比例符合纯合子(5尾):杂合子(10尾):野生型(3尾)≈1:2:1,因此后续进一步实验需确认纯合子批量死亡具体时间,才能进行bco1l基因功能的研究。
因此,通过对斑马鱼Ⅰ-细胞期受精卵进行显微注射Cas9 mRNA与特定的sgRNA,并以yfp-nanos3 mRNA作为显微注射指示剂,可以有效地对目标基因进行定点编辑,获得所需的突变类型,并且获得可稳定遗传个体。
致谢:该研究得到国家科技支撑计划项目:鱼类实验动物新资源的开发与标准化研究(2015BAI09B05)资助;感谢珠江水产研究所提供实验平台及基础设施。
