低强度激光对6周递增负荷训练大鼠上呼吸道黏膜免疫机能的影响
2018-08-01赵杰修王松涛郝选明
覃 飞,赵杰修,王松涛,郝选明*
低强度激光对6周递增负荷训练大鼠上呼吸道黏膜免疫机能的影响
覃 飞1,2,赵杰修2,王松涛3,郝选明3*
1.暨南大学 体育学院, 广东 广州 510032; 2. 国家体育总局体育科学研究所, 北京 100061; 3.华南师范大学 体育科学学院, 广东 广州 510006
目的:长期或一次性大强度运动引发的黏膜免疫抑制,与运动员集训和比赛期间的上呼吸道感染高发密切相关。以6周递增负荷训练诱导大鼠运动性免疫抑制,以不同剂量的低强度激光为干预手段,探讨低强度激光对大负荷训练机体上呼吸道黏膜免疫机能的保护作用。方法:8周龄雄性SD大鼠104只随机分为4组:安静对照组、运动训练组、运动与小剂量激光干预组、运动与大剂量激光干预组。运动各组进行递增负荷跑台训练,每天30 min,每周6天,共6周(第1周速度10 m/min;第2周速度20 m/min;第3周起每周速度递增5 m/min,至第6周为40 m/min)。激光干预组采用氦氖激光鼻腔外照射,1次/训练日,2 min/次。照射功率小剂量组1mw(6.8J/cm2),大剂量组2mw(13.6 J/cm2)。分别于训练前及第2、4、6周末,采集鼻腔冲洗液测sIgA,摘取鼻黏膜组织进行形态学结构评分和免疫组化法测CD4+和CD8+表达量。结果:1)6周递增负荷训练期间,大鼠鼻黏膜免疫功能显著下降。鼻黏膜结构进行性破坏。训练6周末时,鼻黏膜病理评分显著提高,CD4+/CD8+比值和sIgA分泌量明显降低。2)小剂量低强度激光鼻部照射在训练的中后期可显著改善sIgA、CD4+与CD8+及其比值,以及鼻黏膜结构。3)大剂量激光的干预效果随照射疗程的延长呈下降的趋势。结论:6周递增负荷训练可导致大鼠鼻黏膜免疫功能发生明显抑制,鼻黏膜结构进行性破坏,鼻粘膜的体液和细胞免疫功能下降或紊乱。小剂量的低强度激光可明显改善鼻黏膜免疫功能。
运动性免疫抑制;上呼吸道;黏膜免疫功能;低强度激光;递增负荷训练
黏膜免疫系统(mucosal immune system,MIS)是全身免疫系统的重要组成部分,由呼吸道、消化道和泌尿生殖道的淋巴组织和免疫细胞组成,是机体抵抗外界病原体侵袭的“第一道防线”[9]。流行病学调查表明,一次性或长期的大强度训练均可导致运动性免疫抑制(Exercise-induced immunosuppression,EIS), 表现为感染性疾病的发病率增加,其中上呼吸道感染居于首位,这可能与上呼吸道黏膜产生免疫抑制有关[8,18,19]。黏膜免疫抑制既是EIS的表现,同时也是EIS发生发展的促进因素。因此,探讨运动对呼吸道黏膜免疫功能的影响有助于全面阐释EIS的病理损害及其发生发展机制。
低强度激光(Low Level Laser,LLL)是指波长在600~1 000 nm的单色光,可产生类似超声波和针灸等物理因子的光生物学调节作用,具有镇痛、消炎、促愈合等功效[7]。研究表明,LLL对免疫细胞数量、细胞因子平衡、淋巴细胞增殖等具有一定的调节作用[13,15],但将LLL应用于大负荷训练导致的粘膜免疫抑制的治疗,尚缺乏充足的实验证据。
因此,本研究以6周递增负荷训练大鼠为动物模型,以不同照射剂量的低强度激光为干预手段,动态观察与评估呼吸道黏膜(鼻黏膜)的免疫机能变化,以探讨长期大负荷训练对黏膜免疫机能的影响,以及低强度激光的治疗效果,为保护呼吸道黏膜免疫功能,降低运动机体感染性疾病的风险,探索一种有效的干预手段,提供前期实验依据。
1 材料与方法
1.1 实验动物与分组
SPF 级 SD大鼠104只(雄性,8周龄,体重238±34g),购自广州中医药大学实验动物中心,随机分为安静对照组[Control(C),32只]、运动训练组[Exercise(E),24只]、运动与小剂量激光干预组[Exercise + Low power laser(E+LL),24只]、运动与大剂量激光干预组[Exercise+High power laser(E+HL),24只]。E、E+LL和E+HL组进行6周递增负荷跑台训练。训练开始前一天随机抽取安静对照组8只取材测试,作为各组大鼠正式训练前的基础对照值(Week0)。训练开始后各组分别于2nd、4th、6th周末运动后48 h进行取材,取材时点分别记为Week2、Week4、Week6。
1.2 干预方式
1.2.1 运动方案
6周递增负荷训练模型[1,6]:跑台、坡度0°、跑台速度(第1周10 m/min;第2周20 m/min;从第3周开始每周递增5 m/min,至第6周达到40 m/min)。每次30 min,每天1次,每周6次(周日休息),共持续6周。
1.2.2 低强度激光照射方法
采取鼻腔外激光照射[7],氦氖激光(632.8 nm),光斑面积为0.018 cm2。每日训练结束2 h后对大鼠进行不同剂量的低强度激光照射:单手固定大鼠,光纤探头照射鼻甲两侧,每次2 min,每日1次,每周6次,共6周。小剂量组(E+LL)辐射功率1mw,能量密度6.8 J/cm2,功率密度0.06 mw/cm2。大剂量组(E+HL)辐射功率2mw,能量密度13.6 J/cm2,功率密度0.12mw/cm2。
1.3 检测指标
1.3.1 取材
分别于0、2nd、4th、6th周末运动后48 h取材。10%水合氯醛腹腔注射麻醉,收集鼻腔冲洗液后,断头并快速剥离鼻中隔,放入10%中性甲醛溶液中固定。
1.3.2 鼻腔冲洗液的采集
暴露气管,在第2~3软骨环间行一T形切口,将一次性采血针剪去针头后的细导管向头部方向插入气管约2 cm,移液枪吸取500 μl的PBS,通过采血针的细导管冲洗鼻咽部,收集从鼻部流出的冲洗液,冲洗3次。2 000 rpm离心 15 min,取上清液分装,-80 ℃保存待测。
1.3.3 sIgA含量的测定
测试鼻腔冲洗液的蛋白总量后,采用夹心法酶联免疫吸附试验(ELISA)测定鼻腔冲洗液中的sIgA含量,检测步骤按照试剂盒说明书进行。
1.3.4 鼻黏膜HE染色及黏膜损伤评级
制作鼻黏膜HE切片,分别在4×10、10×10、40×10倍物镜视野下观察大鼠鼻黏膜形态结构,并进行损伤程度评分,采用4等级评分标准,从0~3分代表形态结构损伤逐渐加重,具体评分标准见图1中的图注[4-5]。
1.3.5 CD4+和CD8+淋巴细胞的免疫组化测试
采用SP法进行鼻黏膜免疫组化检测,DAB显色,常规脱水、透明、封固。在10×10、40 ×10倍的光镜视野下,分别对相邻切片的CD4+、CD8+阳性T淋巴细胞进行统计。每张切片采集10个视野,运用ImagePro plus软件进行阳性面积定量分析,得出IOD(积分光密度)、Area(阳性面积),通过Density = IOD / Area 计算出平均光密度。
1.4 统计处理
2 研究结果
2.1 鼻黏膜的形态结构变化

图1 大鼠鼻黏膜形态结构评分标准及评分结果(HE×400)
Figure 1 The Histomorphology of Nasal Mucosa and Its Damage score(HE×400)

实验结果显示,C组大鼠鼻黏膜结构完整,形态结构无显著异常。E组随运动负荷不断加大,鼻黏膜结构损伤评分总体呈上升趋势。6周训练结束后,E组鼻黏膜纤毛层部分脱落,腺体增生肿胀,出血明显,大量炎性细胞浸润,以中性粒细胞为主,形态结构评分显著高于C组(<0.01,而E+LL组大鼠鼻黏膜结构得到改善,形态结构评分显著低于E组(<0.05)。E+HL组训练初期(WK0-WK2)鼻黏膜结构损伤较为严重,形态结构评分显著高于E组和E+LL组(<0.01。训练后期(WK2-WK6)E+HL组虽然评分逐渐下降,但鼻黏膜损伤情况依然严重,且与E组情况类似。
2.2 鼻腔冲洗液sIgA含量变化
C组大鼠鼻腔冲洗液中的sIgA含量各周无显著变化。训练初期(WK0-WK2)参与训练的3组大鼠鼻腔冲洗液sIgA含量均无显著性变化。训练2周后(WK2-WK6)随着运动负荷的逐周增加,E组、E+HL组大鼠鼻腔冲洗液sIgA含量均显著下降,其中E组下降幅度非常显著(至6周训练结束时,与0周基础值相比下降57%)。而E+LL组大鼠鼻腔冲洗液sIgA含量虽有下降,但下降趋势平缓(0.05),至6周训练结束时仅下降11%,且在WK4(↑72%,0.05)和WK6(↑107%,0.05)均显著高于E组。
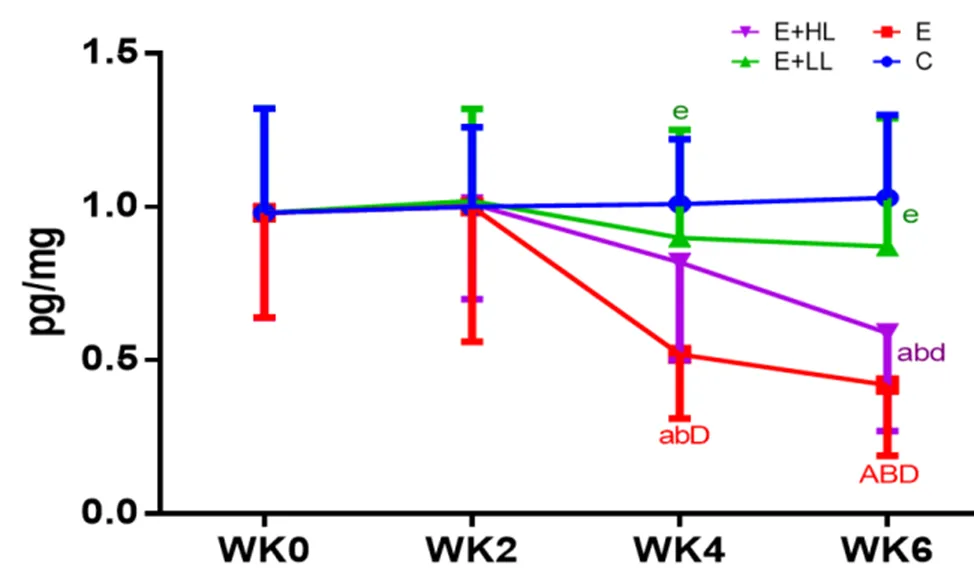
图2 各组大鼠鼻腔冲洗液sIgA 含量的变化
Figure 2 The Changes of SIgA of Nasopharyngeal Lavage Fluid in Different Groups
注:与Week0比较:a<0.05,A<0.01; 与Week2比较:b<0.05,B<0.01; 与Week4比较:c<0.05,C<0.01; 与C组比较:d<0.05,D<0.01; 与E组比较:e<0.05,E<0.01; 与E+LL组比较:f<0.05,F<0.01.
2.3 鼻黏膜CD4+和CD8+阳性T淋巴细胞的表达变化
图3所示,大鼠鼻黏膜组织CD4+阳性T淋巴细胞的分布。CD4+阳性表达主要分布在淋巴细胞的胞浆,呈棕黄色颗粒状,在上皮层和固有层均有分布。图5(a)为鼻黏膜组织CD4+阳性T淋巴细胞表达的定量统计结果。整个训练过程中,C组CD4+阳性表达量无显著性变化。E组和E+HL组CD4+阳性表达变化趋势一致(下降→上升→再下降),且6周末时两组均显著低于4周末时(<0.05)。而E+LL组鼻黏膜CD4+阳性表达呈上升趋势,且在2、4、6周末时均显著高于E组(<0.05),在4和6周末时显著高于E+HL组(<0.05)。6周末时E+LL组与E组、E+HL组相比,鼻黏膜CD4+阳性表达分别升高127%和192%。

图3 各组大鼠鼻黏膜组织CD4+阳性T淋巴细胞的表达(SP×400)
Figure 3 The Expression of CD4+ T Lymphocytes of Nasal Mucosa in Different Groups(SP×400)
注:A1-A4:E组各取样时点鼻黏膜组织CD4+阳性表达;B1-B4:E+LL组各取样时点鼻黏膜组织CD4+阳性表达;C1-C4:E+HL组各取样时点鼻黏膜组织CD4+阳性表达。黑色箭头所示为阳性表达蛋白。
图4为大鼠鼻黏膜CD8+阳性T淋巴细胞的分布。图5(b)为鼻黏膜组织CD8+阳性T淋巴细胞表达的定量统计结果。随着运动负荷的增加,E组CD8+阳性表达总体呈上升趋势,E+HL组和E+LL组在训练初期(WK0-WK2)下降后,然后开始上升,且E+HL组上升趋势更明显。2周末时E+HL组和E+LL组CD8+阳性表达显著低于E组(<0.01),4周末时E+LL组显著低于E组(↓67%,<0.01)和E+HL组(↓61%,0.01)。
图5(c)为鼻黏膜组织CD4+和CD8+阳性表达比值(CD4+/CD8+)的定量统计结果。E组和E+HL组在6周递增负荷训练过程中,均呈现下降→上升→再下降的变化趋势。E+LL组在训练0~4周持续上升,至4周末时达到最高,然后下降,且WK2和WK4时显著高于C、E和E+HL组(<0.01),WK6时显著高于E组(<0.05)。

图4 各组大鼠鼻黏膜组织CD8+阳性T淋巴细胞的表达(SP×400)
Figure 4 The Expression of CD8+ T Lymphocytes of Nasal Mucosa in Different Groups(SP×400)
注:A1-A4:E组各取样时点鼻黏膜组织CD8+阳性表达;B1-B4:E+LL组各取样时点鼻黏膜组织CD8+阳性表达;C1-C4:E+HL组各取样时点鼻黏膜组织CD8+阳性表达。黑色箭头所示为阳性表达蛋白。
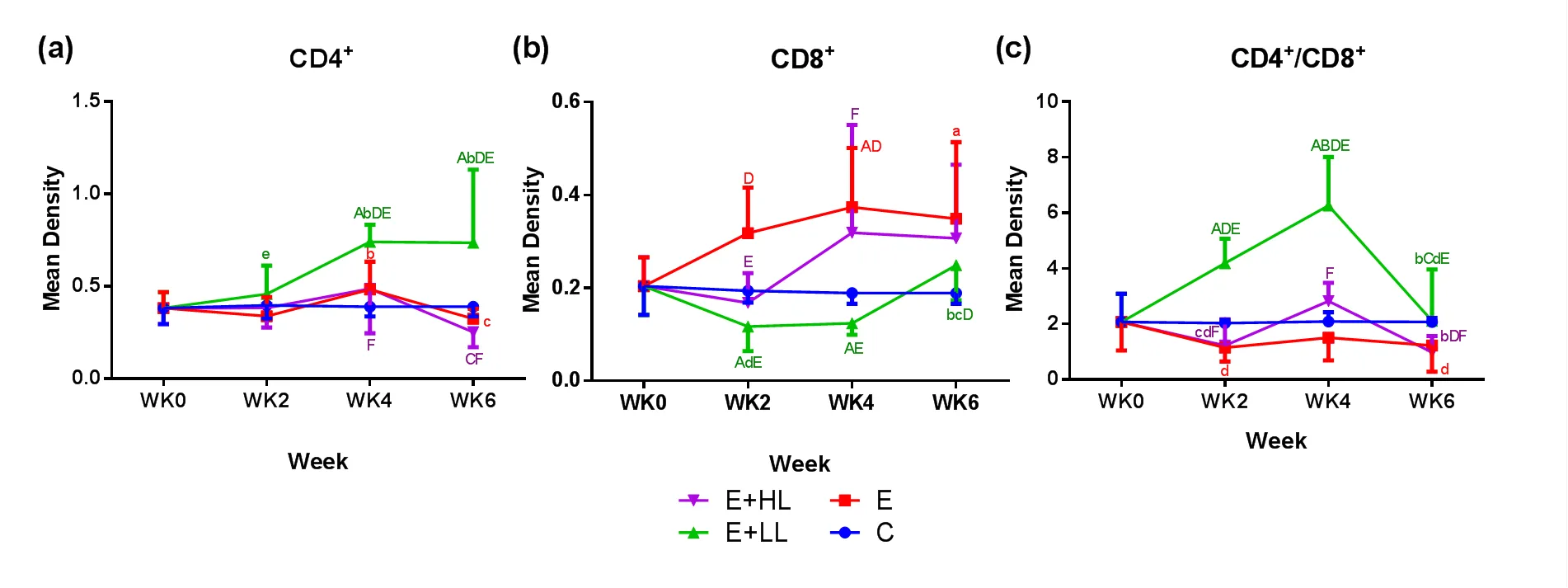
图5 各组大鼠鼻黏膜组织CD4+和CD8+阳性T淋巴细胞表达量及比值
Figure 5 The Content of CD4+ and CD8+ T Lymphocytes of Nasal Mucosa in Different Groups and Their Ratio
注:与Week0比较:a<0.05,A<0.01; 与Week2比较:<0.05,B<0.01; 与Week4比较:<0.05,C<0.01; 与C组比较:<0.05,D<0.01; 与E组比较:e<0.05,E<0.01; 与E+LL组比较:<0.05,<0.01. (a)鼻黏膜组织CD4+阳性表达量;(b)鼻黏膜组织CD8+阳性表达量;(c)鼻黏膜组织CD4+/CD8+比值。
3 分析与讨论
3.1 低强度激光对6周递增负荷训练大鼠鼻黏膜形态结构的影响
黏膜遍布全身各处,是抗体和效应细胞活化的主要部位,对于维持机体免疫耐受状态具有重要作用。黏膜结构受损可直接影响抗体分泌水平和效应免疫细胞数目,导致免疫耐受状态紊乱,进而发生炎症、过敏、菌群失调等问题。其中,鼻黏膜是机体最易与外界环境接触的粘膜系统,是病原体进入机体的第一道门户之一。
研究报告和流行病学调查表明,长期大强度训练或一次性力竭性运动可因剧烈通气或诱发炎症而导致鼻黏膜损伤、变性及坏死[9,16]。说明大强度运动对鼻黏膜结构完整性影响较大。本研究采用鼻黏膜形态结构评分法,对大鼠鼻黏膜损伤进行量化评价,结果表明(图1),训练开始后,E组大鼠鼻黏膜结构总体呈渐进性损害,训练中后期出现纤毛层部分脱落、腺体肿胀且数目减少、出血,以及中性粒细胞为主的大量炎性细胞浸润。由于纤毛层内含有大量杯状细胞,主要负责粘液的合成与释放。纤毛层受损以及大量炎性细胞在固有层血管和腺体周围聚集,可导致腺体肿胀、坏死,粘液生成受阻,进而影响溶菌酶和以 sIgA 为主的抗体的分泌水平[2]。结构改变是功能改变的基础,单纯训练组大鼠鼻黏膜结构的进行性损害为6周递增负荷训练大鼠鼻黏膜免疫抑制的发生发展提供了结构基础。
本研究的实验结果说明,小剂量激光干预组(E+LL)的照射剂量适宜,6周递增负荷训练导致的鼻黏膜结构损伤得到有效改善。但E+HL组大鼠鼻黏膜结构在训练初期就发生严重损伤,并超过E组,这可能是激光剂量相对较大,直接导致了照射部位的黏膜损伤。提示,在进行鼻腔照射时应关注受试者的主观感受,若有刺痛和出血等不适情况时应及时调整剂量或停止治疗。
3.2 低强度激光对6周递增负荷训练大鼠鼻黏膜体液免疫功能的影响
鼻黏膜体液免疫功能,主要是通过完整的黏膜结构和分泌型免疫球蛋白A(secretory IgA, sIgA)对外界入侵的病原体进行抵抗。sIgA在鼻黏膜免疫功能中可抵御病原体经由上皮的入侵,阻止微生物附着聚集成菌落以及中和毒素。
研究表明,无论是一次性力竭运动,还是长期大强度训练均可导致sIgA分泌水平显著下降[10-11]。根据本实验的结果可知,随着运动负荷逐渐增大,鼻黏膜结构损伤加重,导致sIgA分泌量持续下降,提示鼻黏膜防线的崩溃。结合本研究中鼻黏膜形态结构的改变以及sIgA的下降趋势,提示,在运动时应采取正确的呼吸方法,避免长时间过度用力呼吸。若运动后感到鼻咽部明显不适,应及时就医,避免黏膜过度损伤而导致的鼻黏膜免疫抑制。
本实验通过不同剂量的鼻部低强度激光照射后,发现小剂量激光组照射疗效更好,可减弱运动导致的sIgA分泌量下降趋势。训练中后期(4~6周)与E组相比,小剂量激光组鼻腔冲洗液sIgA含量显著增加(),且接近C组水平()。这可能是低强度激光对黏膜的结构、腺体合成与分泌、浆细胞活性,以及免疫细胞归巢受体等均有一定的调节作用[14,17]。而大剂量低强度激光照射组,照射后期干预效果不佳,这可能是照射剂量较大,导致照射部位出现损伤,或由于存在照射时程和/或累积剂量的抛物线效应,而出现干预效果下降或消失的现象。朱平等研究也证实,激光治疗存在照射时程和/或累积剂量的抛物线效应[7]。综合分析两组不同剂量的低强度激光干预效果发现,鼻黏膜组织sIgA对光照剂量反应敏感,且耐受性较差,因此,在照射中应合理控制照射剂量和照射疗程,使其达到最佳照射效果。
3.3 低强度激光对6周递增负荷训练大鼠鼻黏膜细胞免疫功能的影响
鼻黏膜免疫系统的细胞免疫包括上皮淋巴细胞、黏膜固有层免疫细胞、游离T细胞等。其中上皮层和固有层含有大量的T细胞,固有层CD4+T淋巴细胞能促进免疫球蛋白合成,而CD8+T淋巴细胞可抑制其合成[3,12]。本研究发现,CD4+/CD8+比值在训练初期(WK0-WK2)下降明显,训练中期和后期变化不大,在2周末和6周末均显著低于安静对照组,且CD4+/CD8+比值下降,主要是由于CD8+T淋巴细胞升高所致。上述变化结果说明,长期高负荷训练,大鼠上呼吸道黏膜存在一定程度的细胞免疫功能下降现象。
分析低强度激光的干预效果发现,E+LL组可有效改善6周递增负荷过程中T淋巴细胞数量及其亚群的失衡,表现为整个训练过程中CD4+T淋巴细胞显著上升,而CD8+T淋巴细胞趋于下降,提示,小强度激光照射对鼻黏膜的细胞免疫功能具有明显改善作用。而E+HL组大鼠鼻黏膜CD4+T淋巴细胞阳性表达量在整个训练周期中变化不大,提示,剂量增大可能会减弱激光对CD4+T淋巴细胞合成的促进作用。且大剂量激光可在训练早期显著抑制鼻黏膜CD8+T淋巴细胞的上升,但训练中后期干预效果减弱。提示,大剂量激光照射随着照射时程的延长,改善效果达到最大后并可能下降。
4 结论
1. 6周递增负荷训练可导致大鼠上呼吸道黏膜免疫功能明显抑制,表现为整个训练周期中呼吸道黏膜结构进行性破坏,粘膜的体液免疫和细胞免疫功能下降或紊乱。
2. 不同剂量的低强度激光鼻部照射对6周递增负荷训练大鼠上呼吸道黏膜免疫功能产生不同的影响。小剂量激光可明显改善6周递增负荷训练大鼠的鼻黏膜结构,以及黏膜的体液和细胞免疫功能。而大剂量激光对6周递增负荷训练大鼠上呼吸道黏膜免疫功能的改善作用随着干预疗程的延长而下降。
3. 低强度激光对运动性黏膜免疫抑制的调理作用受照射剂量、照射部位和照射疗程等因素的影响。因此,当增加激光照射剂量时应注意对照射部位及周围组织的影响,并控制照射时间和或照射疗程。
[1] 耿青青. 长期递增负荷运动对调控骨髓B细胞发育分化的E2A、EBF、PAX5的影响[J].体育科学, 2012, 32(11): 76-82.
[2] 何维主编. 医学免疫学[M]. 北京: 人民卫生出版社, 2005: 170-174.
[3] 李国平, 杨恬. 黏膜免疫系统的研究进展[J]. 细胞与分子免疫学杂志, 2001, 17(6): 594-596.
[4] 王明星. 鱼腥草对大鼠鼻黏膜纤毛运动影响及黏膜刺激性的实验研究[D]. 南京: 南京中医药大学, 2011: 5-11.
[5] 于洋. 鹿鹅鼻炎方对变应性鼻炎模型大鼠Th1/Th2细胞及相关细胞因子影响研究[D]. 北北京中医药大学, 2016: 62-63.
[6] 张馨蕾, 郝选明, 阮洋, 等. 长期递增负荷运动对胸腺细胞凋亡及其细胞周期调控蛋白的影响[J]. 体育科学, 2015, 35(12): 52-57.
[7] 朱平. 低强度激光临床应用手册[M]. 北京: 人民军医出版社, 2014: 22-32.
[8] BOULET LP, TURMEL J, IRWIN RS,Cough in the athlete: CHEST guideline and expert panel report [J]. Chest, 2017, 151(2): 441-454.
[9] COLBEY C, COX AJ, PYNE DB,Upper respiratory symptoms, gut health and mucosal immunity in athletes [J]. Sports Med, 2018, 48(1): 65-77.
[10] ENGEBRETSEN L, SOLIGARD T, STEFFEN K,Sports injuries and illnesses during the London Summer Olympic Games 2012 [J]. Br J Sports Med, 2013, 47(7): 407-414.
[11] HE CS, TSAI ML, KO MH,Relationships among salivary immunoglobulin A, lactoferrin and cortisol in basketball players during a basketball season [J]. Eur J Appl Physiol, 2010, 110(5): 989-995.
[12] HARIRI B M, COHEN N A. New insights into upper airway innate immunity [J]. Am J Rhinol Allergy, 2016, 30(5): 319-323.
[13] KELLESARIAN S V, MALIGNAGGI V R, MAJOKA H A,Effect of laser-assisted scaling and root planing on the expression of pro-inflammatory cytokines in the gingival crevicular fluid of patients with chronic periodontitis: A systematic review [J]. Photodiagnosis Photodyn Ther, 2017, 18: 63-77.
[14] KUCEROVÁ H, DOSTÁLOVÁ T, HIMMLOVA L,Low-level laser therapy after molar extraction [J]. J Clin Laser Med Surg, 2000, 18(6): 309-315.
[15] MEHANI SHM. Immunomodulatory effects of two different physical therapy modalities in patients with chronic obstructive pulmonary disease [J]. J Phys Ther Sci, 2017, 29(9): 1527-1533.
[16] PACQUE P F, BOOTH C K, BALL M J,The effect of an ultra-endurance running race on mucosal and humoral immune function [J]. J Sports Med Phys Fitn, 2007, 47(4): 496-501.
[17] VIDOVIĆ JURAS D, LUKAC J, CEKIĆ-ARAMBASIN A,. Effects of low-level laser treatment on mouth dryness [J]. Coll Antropol, 2010, 34(3): 1039-1043.
[18] WALSH N P, OLIVER S J. Exercise, immune function and respiratory infection: An update on the influence of training and environmental stress [J]. Immunol Cell Biol, 2016, 94(2): 132-139.
[19] WALSH N P, GLEESON M, SHEPHARD R J,. Position statement. Part one: Immune function and exercise [J]. Exe Immunol Rev, 2011, 17(6): 6-63.
The Effect of Low Power Laser on Mucosal Immune Function of upper respiratory tract in Rats during 6-week Incremenatal Training
QIN Fei1,2, ZHAO Jie-xiu2, WANG Song-tao3, HAO Xuan-ming3*
1. Jinan University, Guangzhou 510032, China; 2. China Institute of Sport Science, Beijing 100061, China; 3. South China Normal University, Guangzhou 51006, China.
PURPOSE: Nasal mucosal immune suppression, induced by long-term high-intensity training, could lead to an increasing risk of upper respiratory tract infections. This study aimed to examine the effect of laser irradiation on nasal mucosa structure and its immune function. METHODS: 104 male Sprague Dawley rats (aged 8 weeks) were randomly divided into 4 groups: Control (C), Exercise (E), Exercise + Low power laser (E+LL, 1 mw, 6.8 J/cm2), and Exercise + High power laser (E+HL, 2 mw, 13.6 J/cm2). The rats in all Exercise-related groups performed an incremental treadmill exercise protocol: 30 min/day, 6 days/week, 6 weeks; 10 m/min velocity in 1stweek, 20 m/min in 2ndweek, with 5 m/min/week increment for the following weeks. The laser treatments were He-Ne laser (2 h after exercise, 2 min) at two irradiation point (each side of the nasal ala). Samples of all groups were collected in the beginning of training, as well as in the end of week 2nd, week 4thand week 6threspectively. Nasal mucosal structure were observed by HE staining, sIgA concentration of nasopharyngeal washings were examined by ELISA, and the expression of CD8+and CD4+T lymphocytes of nasal mucosa were analyzed by immunohistochemistry. RESULTS: 1) Following changes () occurred in E group during 6 weeks: seriously damaged mucosa structure, gradually decline of sIgA level and ratio of CD4+/CD8+were observed in nasal mucosa. 2) Compared with E group, the structure of nasal mucosa obviously improved, and the sIgA concentration, CD4+cells, and the ratio of CD4+/CD8+of nasal mucosa markedly increased in E+LL group. 3) The E+HL group did not show significant improvement as those as EL group (). CONCLUSION: Long-term high-intensity exercise training would lead to destruction of nasal mucosa structure and the declining of nasal immune function. Low power laser irradiation has a protective effect on nasal mucosa immune function.
G804.5
A
1002-9826(2018)04-0107-06
10.16470/j.csst.201804012
2018-02-13;
2018-06-06
广东省科技计划(社会发展领域)项目(2017A020220010; 2017A020220001),国家体育总局体育科学研究所基本科研业务费专项(基本17-18和17-19)。
覃飞,女,讲师,博士,主要研究方向为运动免疫与健康, E-mail:qf_8707@163.com
郝选明,男,教授,博士,主要研究方向为运动免疫与健康,E-mail:hxm@scnu.edu.cn
