TiO2/Fe-TiO2复合材料的制备及其对甲醛降解性能的研究
2018-07-31张茂亮杨艳娟白召军万欣娣王今华李建伟李骁男杨宁宁
张茂亮 ,杨艳娟 ,白召军 ,万欣娣 ,王今华 ,李建伟 ,李骁男 ,杨宁宁
(1.河南建筑材料研究设计院有限责任公司,河南 郑州 450002;2.天津城建大学,天津 300384)
0 引言
家具及装饰材料中的甲醛缓慢挥发使室内甲醛含量不断升高,而这一缓慢的挥发过程需持续3~15年[1]。甲醛作为室内有害气体广泛而持久的危害着人类的身体健康[2-3]。正因如此,对于室内甲醛的治理成为了不可忽视的问题。
目前人们采用的去除室内甲醛的手段主要有:通风换气、物理吸附、空气负离子净化及光催化降解等[4-6]。其中,光催化降解以其广泛的适用性、降解产物无毒无害、可重复利用等优点倍受青睐。
在诸多光催化材料中,TiO2具有无毒无害、良好的化学稳定性、抗腐蚀等诸多优点[7-8],利用TiO2光催化剂降解室内甲醛气体已成为目前重要的研究方向[9]。研究发现,TiO2光催化材料的禁带宽度为3.2eV,只有在紫外光下才能被激发。此外,TiO2光生电子-空穴对具有较快的复合速率导致光生载流子的寿命短,从而降低了TiO2光催化材料的太阳光利用率,使其应用受到了制约。为了扩大TiO2在可见光下的光响应范围,提高催化效率,可通过对TiO2进行改性、金属离子或非金属离子掺杂、共掺杂、表面敏化和半导体复合等途径实现。半导体之间相互复合能够促进载流子的分离,扩展催化剂体系的光响应范围,因此该类方法越来越被人们所接受。现阶段,对于Fe-TiO2的研究也越来越多,大多数研究是针对制备单一的Fe-TiO2材料展开的,而对于Fe-TiO2半导体复合方面的研究还不够深入全面。本文利用物理混合方法,将n型TiO2半导体与p型Fe-TiO2半导体复合,制备具有p-n结的TiO2/Fe-TiO2复合光催化剂,以期提高光催化效率。
1 实验
1.1 原材料
硝酸:分析纯,天津市化学试剂厂;无水乙醇:分析纯,天津大学科威公司;钛酸丁酯:分析纯,天津市光复化工研究所;硝酸铁:分析纯,天津市光复化工研究所;甲基蓝:分析纯,天津大学科威公司;甲醛:分析纯,天津市化学试剂厂;油酸铵:分析纯,酷尔化学(北京)科技有限公司;水:蒸馏水。
1.2 主要仪器设备
精密电子天平:FA2004型,上海舜宇恒平科学仪器有限公司;电子天平:TD 10002型天津市天马仪器厂;台式高速离心机:TG18G型,湖南凯达设备有限公司;水热釜:济南恒化科技有限公司;恒温磁力搅拌器:SH-2型,天津市泰斯特仪器有限公司;电热鼓风干燥箱:101-1B型,天津市华北实验仪器有限公司;智能纤维电阻炉:SX3-4-10型,天津中环实验电炉有限公司;可见分光光度计:7230 G型,上海精密科学仪器有限公司;甲醛检测仪:4160型,美国Interscan公司;X射线衍射仪:日本理学RigakuD/max-2500 v/pc;扫描电镜:日本Hitachi S-4800I;透射电镜:日本 HITACHI H-7650;紫外可见分光光度计:北京TU-1901;X射线光电子能谱仪:美国Thermo ESCALAB 250Xi;电化学工作站:天津兰立科化学电子高技术有限公司的LK2005A型。
1.3 试验方法
1.3.1 试样制备
(1)Fe-TiO2光催化剂的制备
在80 ml无水乙醇中缓缓滴入20 ml钛酸丁酯,采用磁力搅拌器搅拌1.5 h得到混合溶液A1。将一定质量的Fe(NO3)3溶于40 ml无水乙醇中并加入浓硝酸使该溶液的pH值达1.5,然后磁力搅拌1.5 h制得混合溶液A2。把制备好的溶液A2逐滴加入溶液A1中,在滴加过程中及滴加完毕后强烈搅拌12 h得到溶液A。将溶液A加入100 ml水热釜内在200℃条件下反应24 h。将反应后的产物加入离心机中,使用无水乙醇高速离心洗涤3遍并用同样方式用蒸馏水再洗3遍。洗涤后将试样100℃烘干至恒重,研磨后放入马弗炉中升温至400℃保温 2 h得到 Fe-TiO2粉体(B1)。通过改变 Fe(NO3)3的用量控制Fe-TiO2粉体中Fe/Ti的摩尔比,制得摩尔比分别为 0、0.3%、0.5%、0.7%的 Fe-TiO2粉体,分别标记为 TiO2(B2)、0.3%Fe-TiO2、0.5%Fe-TiO2、和 0.7%Fe-TiO2。
(2)TiO2/Fe-TiO2光催化剂的制备
称取一定质量的Fe-TiO2纳米粉体放到30 mL的0.1 mol/L的油酸铵溶液中,剧烈搅拌2 h,无水乙醇洗涤、100℃烘干至恒重、研磨后,将上述Fe-TiO2纳米粉体和纯TiO2粉体在5 mL水溶液中搅拌1 h,干燥研磨后得到TiO2/Fe-TiO2复合光催化剂。其中在TiO2/Fe-TiO2复合光催化剂中Fe-TiO2与 TiO2质量比为 7.7∶100。
将制得的一定质量的Fe-TiO2纳米粉体B1加入到60 ml浓度为0.1 mol/L的油酸铵溶液中,搅拌2.5 h,用无水乙醇洗涤、100℃烘干至恒重、研磨后与纯TiO2粉体B2混合并加入10 ml蒸馏水搅拌1 h得到混合液B。所得混合液B经干燥研磨得到TiO2/Fe-TiO2复合光催化剂。其中复合光催化剂中B1与B2的质量比为7.7∶100。
1.3.2 降解性测试
(1)对亚甲蓝溶液降解性测试
为了简化实验步骤,可先对所制备得到的样品进行降解性试验,从中挑选出降解性能最好的一组光催化剂,并使用优选出的试样进行光催化除甲醛试验。用分光光度计测试浓度为10 mg/L的亚甲蓝溶液的吸光度AO,称取0.2 g试样,加入盛有20 ml浓度为10 mg/L的亚甲蓝溶液的表面皿中。用30 W紫外灯作为激发光源,每30 min取1次上清液测定溶液的吸光度Ae。按式(1)计算其降解率D:

式中:AO、Ae——分别为初始吸光度和一段时间后的吸光度。
(2)对甲醛气体降解性测试
将10 ml甲醛溶液溶于190 ml蒸馏水中,取0.025 ml稀释后的甲醛溶液加入放有质量为0.12 g光催化剂的不见光的容积400ml三口烧瓶中,待其在瓶中挥发3 h后采用甲醛检测仪检测瓶中甲醛气体的初始浓度PO为0.08 mg/m3,开启30 W日光灯可见光激发光源并开始计时,过后每隔一定时间测试甲醛浓度Pe,并按式(2)计算在不同时间段的甲醛降解率η:

式中:PO、Pe——分别为初始浓度和一段时间后的浓度,mg/m3。
1.4 表征方法
利用X射线衍射仪对试样进行XRD分析;用扫描电镜对样品的表面形貌进行分析;用透射电镜对样品的微观结构进行分析;用紫外可见分光光度计对样品的透光率进行测试,入射光波长范围为300~600 nm;用X射线光电子能谱仪对试样的光电子能谱进行测试,在实验数据处理中,以C1s(284.80e V)DR为定标标准。
2 结果与讨论
2.1 TiO2和Fe-TiO2的表征分析
2.1.1 TiO2和Fe-TiO2的XRD分析
图1为不同Fe掺杂量Fe-TiO2试样经400℃煅烧后的XRD图谱。

图1 不同Fe掺杂量Fe-TiO2试样的XRD图谱
由图 1可知:(1)4 组样品在 2θ=25.3°,37.7°,48.0°处均有明显的特征锐钛矿衍射峰,特征峰较为尖锐,表明结晶性较好。(2)随着铁掺杂量的增加,衍射峰强度有所降低。
2.1.2 TiO2和TiO2/0.5%Fe-TiO2的扫描电镜分析
图 2(a)、(b)分别为纯 TiO2和 TiO2/0.5%Fe-TiO2样品的SEM 照片,图 2(c)、(d)分别为纯 TiO2和 TiO2/0.5%Fe-TiO2样品的TEM照片。

图2 不同试样的SEM和TEM照片
从图 2(a)、(b)可以看出,2 种样品均为球状,说明铁的加入并未对纯TiO2形貌造成改变。从图2(c)、(d)可以看出,2种样品中球形颗粒尺寸为20 nm左右,TiO2/0.5%Fe-TiO2中没有发现Fe2O3晶格,可能是由于大部分Fe3+取代了晶格中的Ti4+。
2.1.3 不同Fe掺杂量Fe-TiO2试样的UV-vis光谱分析(见图3)
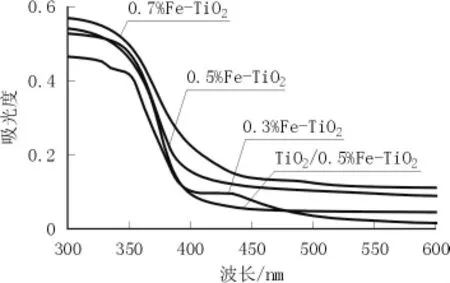
图3 不同试样的UV-Vis-DRS曲线
从图3可看出,向纯TiO2中分别掺入0.5%、0.7%Fe-TiO2后,可见光区的响应范围得到了扩展,纯TiO2的光吸收边缘约为400 nm,掺入Fe-TiO2后提高至400~600 nm。禁带宽度由原来的3.1 eV分别降至3.02、2.90 eV呈递减趋势。掺Fe-TiO2样品光吸收红移的原因为:过渡金属Fe3+具有未充满的d轨道,Fe3+与其它离子配位时,d轨道分裂为能量不同的能级,适当波长的外来辐射导致电子在这些不同能级跃迁。由于掺杂能级处于禁带中,能级间的能量差不大,只要能量较小的激发光源就可实现这一跃迁。同时掺杂离子在TiO2光催化剂中形成电子陷阱,提高了量子效率,进而有助于光催化效率的提高。
TiO2/0.5%Fe-TiO2复合光催化剂与纯TiO2相比,禁带宽度同样降低。这是由于p-n结减少了电子空穴对的复合,以及Fe3+已经进入了TiO2晶格中取代了Ti4+,形成了掺杂能级,降低了TiO2的带隙宽度。
2.1.4 TiO2和0.5%Fe-TiO2的XPS光谱分析
TiO2和0.5%Fe-TiO2试样的X射线光电子能谱图见图4。
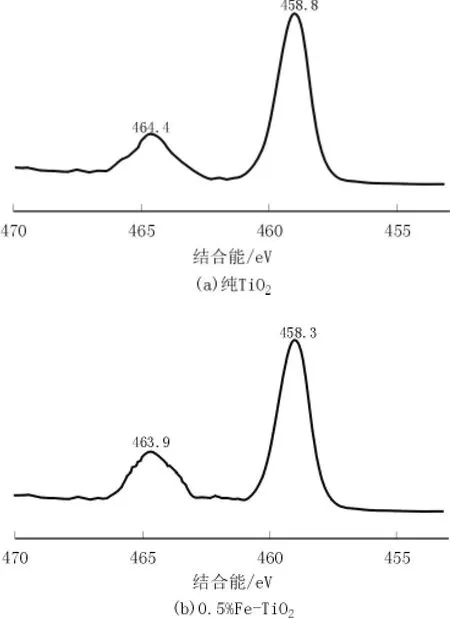
图4 不同试样的X射线光电子能谱
由图4可知,纯TiO2在458.8 eV和464.4 eV处出现Ti2p特征峰,而0.5%Fe-TiO2的Ti2p特征峰出现在了463.9 eV和458.3 eV处,Ti2p特征峰产生位移表明:掺加Fe3+进入TiO2晶格内部,使Ti2p的结合能减小。同时由于引入了掺杂能级,TiO2导带中的光生电子向微粒表面迁移,产生了氧空位,氧空位的产生引起的电荷不平衡状态需要Ti4+价态的降低补偿,进一步降低了Ti2p的结合能。
2.1.5 TiO2/0.5%Fe-TiO2光催化剂的电化学性能分析
为了证明复合催化剂中存在p-n结,可利用催化剂制备成薄膜并测试其电化学性能。薄膜制备方法为:在制备TiO2纳米粉体前驱体溶液放入水热釜前,在洁净干燥(相对湿度小于60%)、恒温(20~30℃)环境中采用拉膜机提拉法镀膜,选用ITO玻璃作为基片。先将洗净的基片浸入已配好的溶胶中1 min,以使溶胶与基片表面充分接触;然后以3 cm/min的速度垂直地提拉基片;湿膜移入100℃恒温箱中烘干处理10 min,最后将薄膜放入到马弗炉中,于400℃下保温2 h。将热处理完已经镀上一层TiO2薄膜的ITO玻璃放入到已制备完成的Fe-TiO2溶液中,重复上述拉膜、干燥和热处理的步骤,最后得到TiO2/0.5%Fe-TiO2复合型薄膜。
采用电化学工作站测试TiO2/0.5%Fe-TiO2复合型薄膜的电化学性能。其中将制备的TiO2/0.5%Fe-TiO2薄膜作为工作电极,铂电极作为辅助电极,Ag/AgCl作为参比电极,扫描电压范围为±1.2 V,扫描速度为50 mV/s。TiO2/0.5%Fe-TiO2复合薄膜的电化学性能见图5。
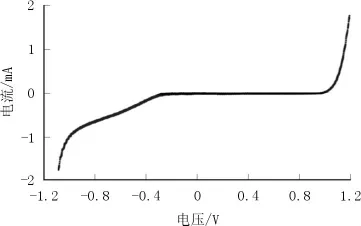
图5 TiO2/0.5%Fe-TiO2的循环伏安曲线
图5表明,复合薄膜在反向电压的作用下,电压在一定范围内几乎不通过电流;而当正向电压逐渐增大超过一定数值时,电流呈指数增长,其符合I-V曲线契合了二极管的特性,即电流随着电压正向通过,反向截止,证明了p-n结的存在。
2.2 反应过程条件对TiO2/Fe-TiO2光催化性能的影响
2.2.1 Fe3+掺杂量对TiO2/Fe-TiO2降解亚甲蓝效率的影响(见图6)
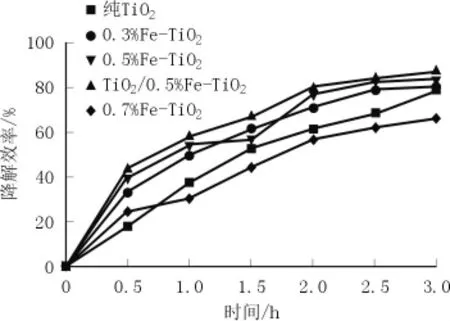
图6 不同Fe3+掺杂量Fe-TiO2降解亚甲基蓝的效率
从图6可看出,TiO2/0.5%Fe-TiO2复合催化剂对亚甲蓝的降解率最高,可以达到87%。当Fe3+掺杂量从0增加至0.5%时,降解效率提高,这可能是由于掺入适量Fe3+在TiO2的禁带引入了掺杂能级,增大了微粒表面的缺陷,降低了反应能;但当Fe3+掺杂量继续增至0.7%时,降解率降低,这是由于过量的Fe3+并未全部进入TiO2晶格中,经高温热处理后形成了Fe2O3,从而影响了降解率。
2.2.2 可见光下光催化剂对甲醛的催化效率
图7为纯TiO2和TiO2/0.5%Fe-TiO2在甲醛浓度为室内允许最大上限0.08 mg/m3时,对甲醛气体降解3 h的效果。
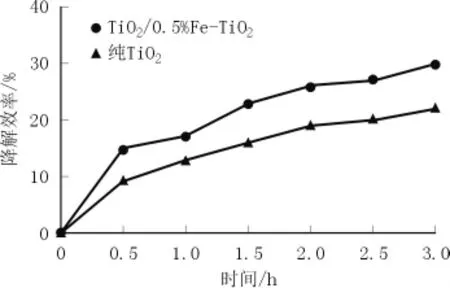
图7 可见光下光催化剂对甲醛的降解效率
由图7可见,在可见光下,复合光催化剂TiO2/0.5%Fe-TiO2对甲醛气体的降解率为30.3%,其降解效率高于纯TiO2。这是因为复合粉体Fe3+替代了Ti4+,降低了禁带宽度,拓展了可见光的响应范围。同时在内电场的作用下电子-空穴对有效分离。
3 结论
(1)通过 TEM、XRD、XPS分析可知,Fe3+进入了 TiO2晶格中并取代了Ti4+,从而提高了催化效率。当Fe3+的掺杂量为Ti4+摩尔的0.5%时,其光催化性能最佳。
(2)Fe3+的掺杂扩展了可见光的响应范围,TiO2/Fe-TiO2复合光催化材料中存在同质p-n结。
(3)紫外光作为激发光源时,当亚甲蓝溶液浓度为10mg/L,TiO2/0.5%Fe-TiO2用量为0.2 g时,其降解效率最高,可以达到87%。可见光作为激发光源时,当甲醛浓度为室内允许最大上限0.08 mg/m3,TiO2/0.5%Fe-TiO2用量为0.12 g时,在400 ml空间内其降解效率高于纯TiO2,3 h对甲醛气体降解率可达30.3%。
