基于常规X线的光栅成像改善微钙化X线摄影的对比度
2018-07-31王升平李新斌朱晓骅李瑞敏陈志强彭卫军
王升平,李新斌,朱晓骅,付 怡,李瑞敏,张 丽,陈志强,彭卫军
1.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032;
2.清华大学工程物理系,教育部粒子与辐射成像重点实验室,北京,100084
乳腺癌是女性最常见的恶性肿瘤[1],乳腺X线摄影是筛查和诊断乳腺癌的主要成像工具[2],但仍有10%~20%的可触及肿瘤难以检测到[3]。随着乳腺癌筛查的普及,越来越多的无法触及的乳腺隐匿性病变被发现,但这些病灶在乳腺X线摄影上往往仅表现为微钙化[4],特别是导管原位癌(ductal carcinoma in situ,DCIS)[5-6]。此外,致密型乳腺常会遮蔽微钙化,容易漏诊或误诊为乳腺肿瘤[7]。超声对微钙化的显示率明显提高[8],但诊断效能受限于机器或操作者等因素,可能忽视微钙化从而低估恶性病变。数字乳腺断层融合X线摄影(digital breast tomosynthesis,DBT)技术提高了乳腺病变的检出率[9-12],但由于噪声较大和运动伪影等因素降低了微钙化的检出,有遗漏病变的可能[13]。X线光栅相衬成像是近年来兴起的新技术[14-17],灵敏度比吸收成像高3个数量级,在乳腺成像中有明显优势。Wang等[17]在实验室常规多色X线源条件下获得了乳腺微钙化的光栅成像,显示了光栅成像在微钙化检测中的巨大潜力和临床应用前景。本研究通过微钙化模型光栅成像,探讨不同组织厚度和微钙化大小条件下光栅成像对微钙化的显示情况。小的微钙化(图1)。按X线方向猪肉的厚度分为3组,分别是2、4和5 cm组;将钙化颗粒嵌入猪肉中,使用钢筛筛出5组(16、22、26、30和40目),每组10粒,猪肉厚度为2 cm。

图1 微钙化模型使用的猪肉(A)和钢筛(B)
1 材料和方法
1.1 微钙化模型制备
采用磷酸钙(tricalcium phosphate,TCP)[分子式为Ca3(PO4)2,属高温型的α相属单斜晶系,相对密度为2.86 g/cm3)]模拟微钙化,新鲜瘦猪肉模拟致密型乳腺,钢筛筛选5组不同大
1.2 成像设备
光栅成像平台由清华大学工程物理系粒子技术与辐射成像实验室搭建(图2)。使用阳极材料为钨的X线球管(MXR-160HP/11,瑞士COMET公司),最大管电压160 kV,焦点尺寸0.4 mm。使用3个基于Talbot-Lau干涉效应的光栅(德国MICROWORKS公司):源光栅(G0)、相位光栅(G1)和分析光栅(G2)(表1)。平板探测器(CMOS1512,英国DEXELA公司)像素74.8 μm×74.8 μm,闪烁体为CsI(厚600 μm)。相位步进(phase stepping,PS)控制平台为压电陶瓷驱动平移台(P-611.1s,美国PI公司),闭环状态下分辨率为2 nm(最小步长),重复定位精度<10 nm。样品转台(RVS80CC,美国NEWPOR公司)最高分辨率为0.000 25°,重复定位精度为0.001°。
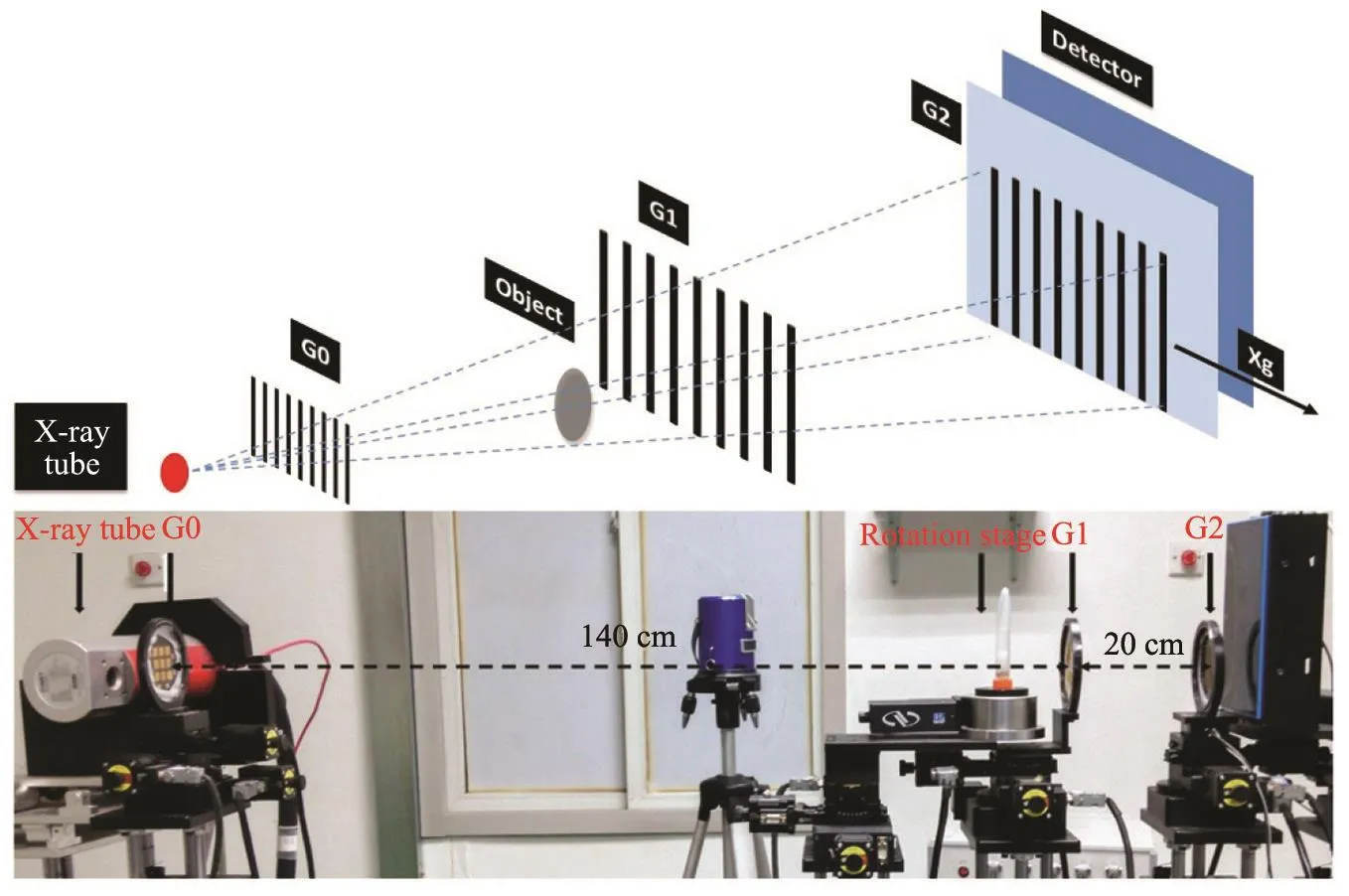
图2 基于常规X线的光栅成像示意图和成像系统平台

表1 基于Talbot-Lau效应的3个光栅参数
1.3 光栅成像原理
G0作为分光器,将经过G0的X线分成一系列周期性重复的具有部分相干性的线光源阵列,满足G1和G2对入射光空间相干性的要求。G1作为相位光栅起相位调制作用,入射X线经过G1后,基于Talbot效应在G1后的Talbot距离处自成像,被置于此位置的G2(分析光栅或吸收光栅)解析后,被探测器记录。当G1和G2沿x轴相位步进时,探测器会记录1条基于步进数(g)的光强正弦波曲线,即强度-位移曲线(intensity displacement curve,IDC)(图2)。通过分析有物体与无物体时两条位移曲线的差异,便能获得携带X线的衰减、相移和小角X线散射(small angle X-ray scattering,SAXS)图像。
1.4 微钙化模型光栅成像
将样品固定于成像平台。管电压35 kV,能量28 keV。基于Talbot-Lau效应,G0与G1之间的距离设定为140 cm,G1至G2的距离为20 cm。探测器有效像素为75 μm,探测器视野为12 cm×12 cm。由于光栅实际尺寸的限制,有效成像视野为4 cm×3 cm。光栅步进次数为8,每次时间为0.35 s,平台每次移动时间为0.4 s,每个步进周期的曝光时间约为7 s。使用Matlab2014b(美国MATHWORKS公司)软件分析和处理采集的信息,通过一维离散快速傅里叶变换(fast Fourier transform,FFT)和曲线拟合方法提取吸收信息、相位信息和暗场信息对应的投影图像。整个成像系统采用集成软件控制(Grating-DAQ),由清华大学工程物理系光栅成像课题组自行设计。
1.5 图像分析
将图像原始数据导入图像处理软件ImageJ(1.51n,http://Imagej.nih.gov/ij)中,手动调整每幅图像至最佳显示窗宽和窗位。
对比度的计算以暗场成像为例(图3):以钙化为中心勾画一个正方形感兴趣区(region of interest,ROI)(50×50),绘制基于位置的像素信号值的plot file图,连接曲线波底部两端形成一个封闭区域,然后使用魔术棒点击这个区域,软件自动计算像素数,将此作为微钙化的对比度。每组测量两次,测量间隔时间4周,取两次测量的平均值(表2)。
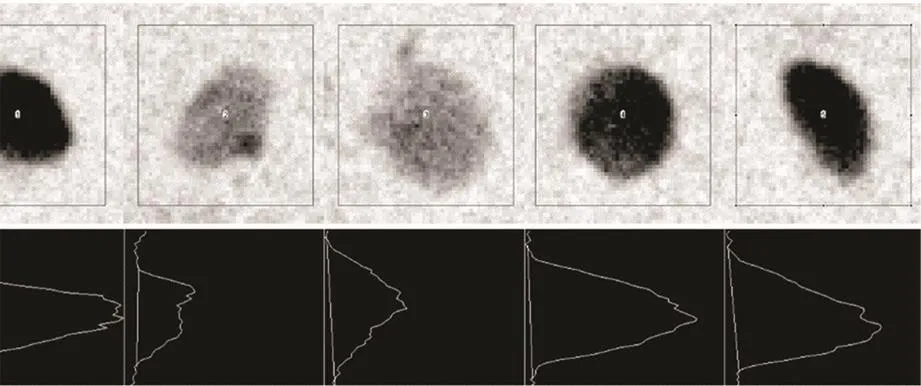
图3 对比度的计算
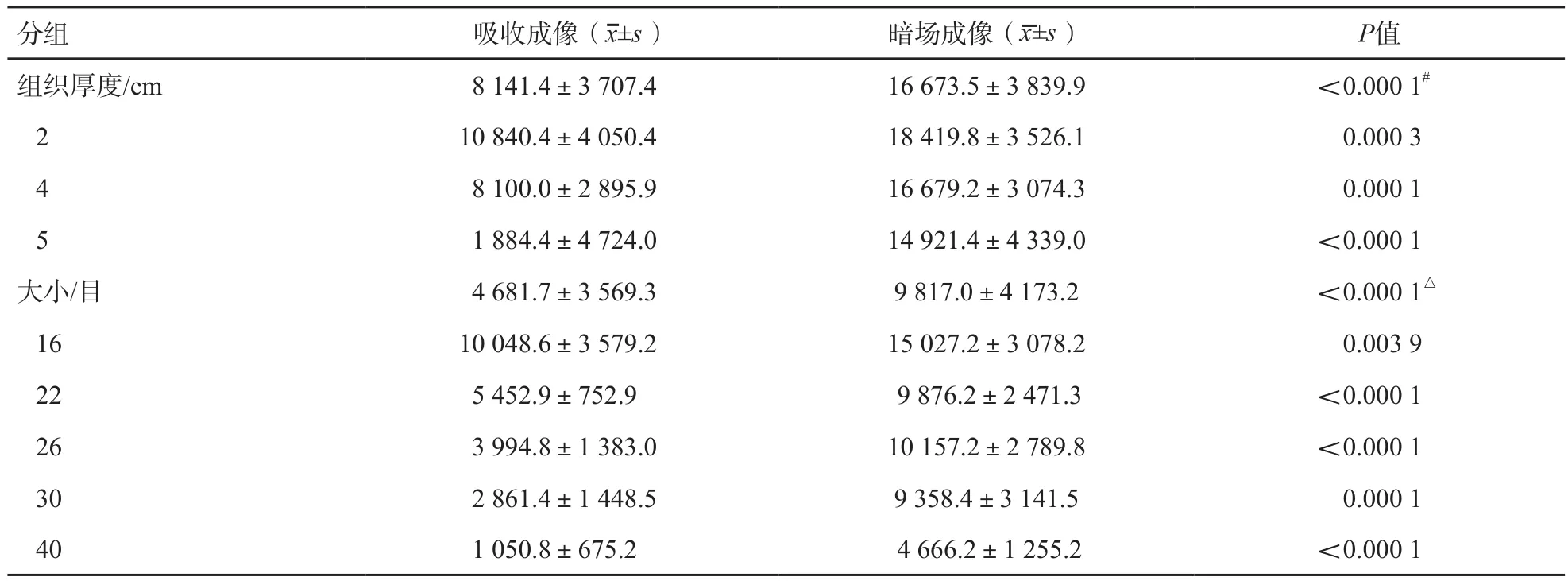
表2 不同组的吸收成像和暗场成像
1.6 统计学处理
统计学分析使用R(版本3.4.3,https://www.R-project.org),采用Mann-Whitney U检验分析钙化颗粒的对比度差异,P<0.05为差异有统计学意义。
2 结 果
2.1 一般成像情况
基于常规X线的光栅成像一次采集可同时获得3种成像模式,分别是吸收成像、相衬成像和暗场成像(图4)。吸收成像类似于传统的基于衰减的X线成像,相衬成像对软组织(猪肉)显示最好,暗场成像对软组织显示不佳。微钙化与软组织(猪肉)背景对比明显,暗场成像显示微钙化的内部信号不均匀。
2.2 组织厚度和微钙化的显示
在不同厚度模型中,暗场成像对比度优于吸收成像,两种成像方式之间差异有统计学意义(P<0.001)。随着猪肉厚度增加,吸收成像对比度明显下降,暗场成像对比度轻度下降。提示吸收成像对钙化的显示受厚度的影响较明显,暗场成像对钙化的显示受厚度的影响较轻微(图5)。在组织最厚组(5 cm),吸收成像的背景(猪肉组织)不均匀,可见条纹状伪影;而暗场成像的背景(猪肉组织)较均匀,均匀信号强度的背景会改善微钙化的显示。此外,暗场成像对微钙化边缘信息的显示比吸收成像更丰富(图6~7),暗场成像显示部分微钙化边缘毛刺状伸出,而对应的吸收成像对此显示不佳。

图4 光栅成像一次采集获得3种成像模式:吸收成像(A)、相衬成像(B)和暗场成像(C)图中白色方框内是局部放大图,标尺为5 mm
2.3 微钙化大小和微钙化的显示
随着微钙化粒径减小,吸收成像对比度下降,暗场成像对比度轻度下降。提示吸收成像对钙化的显示受粒径的影响较明显,暗场成像对钙化的显示受粒径的影响较轻微(图5)。特别是在钙化粒径最小组(40目),吸收成像对部分微钙化几乎不显示,而暗场成像对所有钙化的显示很清晰(图8)。
2.4 不同阈值水平微钙化的显示
本研究将上阈值水平设定为255灰度值,设定4个下阈值水平,分别是200、210、220和230灰度值。下阈值水平为210灰度值时,吸收成像与暗场成像对微钙化的显示没有明显差异。随着下阈值水平升高,吸收成像上钙化面积越来越小,当下阈值水平为230灰度值时,吸收成像上有4个钙化不能显示;而暗场成像对微钙化的显示随下阈值水平提高受的影响较小,当下阈值水平为230灰度值时,仍显示全部钙化(图9)。
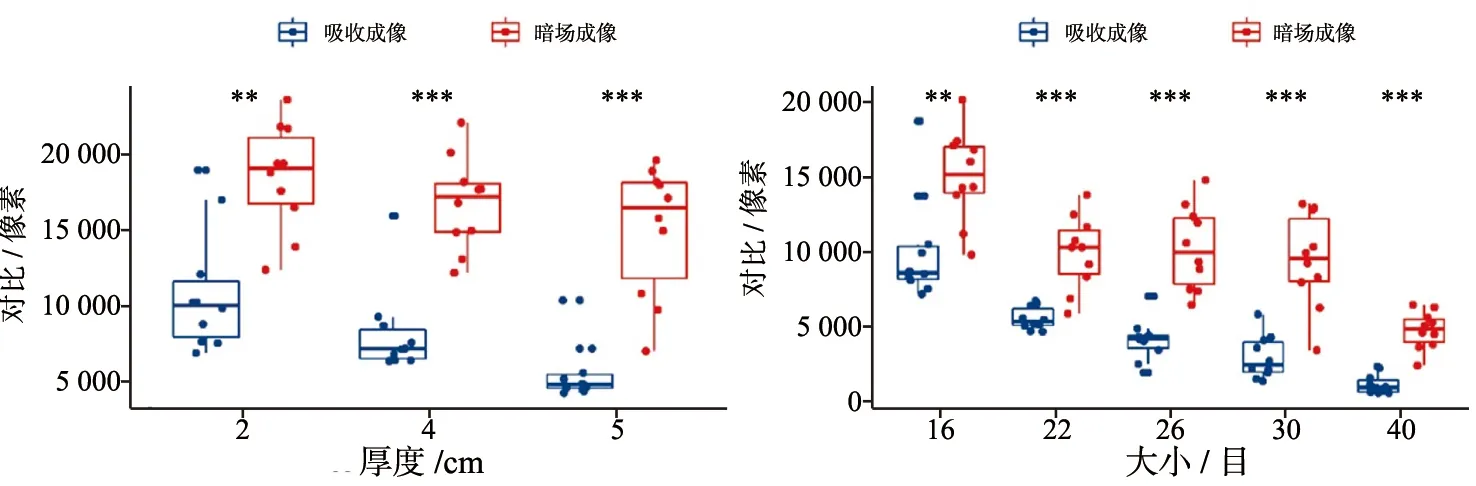
图5 不同猪肉厚度和微钙化大小条件下吸收成像和暗场成像对比度**: P<0.01; ***: P<0.001
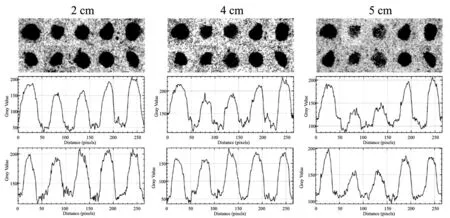
图6 猪肉组织厚度为2、4和5 cm的暗场成像及每个钙化基于位置的灰度剖面图剖面图的横轴是位置(像素表示),纵轴是灰度值
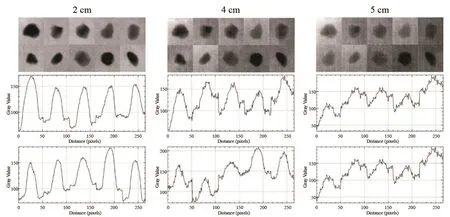
图7 猪肉组织厚度为2、4和5 cm的吸收成像及每个钙化基于位置的灰度剖面图剖面图的横轴是位置(像素表示),纵轴是灰度值

图8 不同大小微钙化的吸收成像和暗场成像

图9 不同阈值水平的微钙化吸收成像和暗场成像(钙化大小16目,组织厚度2 cm)当下阈值水平为230灰度值时,吸收成像仅显示6个钙化,且钙化面积明显缩小;暗场成像显示所有钙化,钙化面积变化不明显。暗场成像时钙化的边缘细节显示更清楚
3 讨 论
本研究显示,基于实验室多色X线源的光栅成像一次数据采集可同时获得3种携带不同物理信息的图像。暗场成像对微钙化具有非常好的显示能力,其对比度随猪肉厚度增加或钙化颗粒变小而受到的影响较小;吸收成像则受到明显影响,随猪肉厚度增加和钙化颗粒变小,其对微钙化的显示能力越来越弱。Scherer等[14]利用紧凑型X线源进行乳腺恶性肿瘤的微钙化暗场成像,结果表明暗场成像可提高微钙化分析的诊断有效性,减少侵入性手术次数。本研究在实验室X线源的条件下,通过分析微钙化光栅成像模型的对比度,也证明暗场成像具有改善微钙化显示的能力。
致密型乳腺在亚裔女性中多见,与欧美国家女性多以脂肪型乳腺为主不同。致密型乳腺更易受纤维腺体组织重叠的影响,乳腺疾病的漏诊率及误诊率高于脂肪型乳腺。吸收成像基于成像物体对X线信号的衰减,在成像物体密度相同的条件下,X线入射路径上生物组织厚度对信号衰减起着决定性的作用,最终影响成像对比度。采用传统的乳腺X线摄影难以发现早期乳腺癌的细小微钙化,特别是致密型乳腺,其较厚的软组织衰减掩盖了微钙化与周围软组织的衰减差异[18]。本研究以几乎均由骨骼肌和纤维组织构成的新鲜瘦猪肉模拟[19]人体致密型乳腺,发现吸收成像的投影图像受猪肉厚度的影响衰减下降明显,导致最致密组(5 cm组)的微钙化显示不佳,而暗场成像受猪肉厚度的影响轻微,微钙化对比度下降没有吸收成像明显,显示清晰,这对致密型乳腺病变的检测特别有意义。
大多数恶性钙化灶的大小为100~300 μm。对于<100 μm的钙化,常规X线摄影无法清晰显示。暗场成像是基于物体的小角散射信号成像[20-21],对几十纳米至几百纳米的结构变化和密度波动特别敏感,与基于衰减信息的吸收成像不同,它能提供独特的对比机制以揭示物体的细微结构特征,从而显示吸收成像难于显示的结构信息。Yang等[22]通过公式推导和仿真实验证明,暗场对比度是通过物体的亚像素微结构的小角X线散射机制形成的。本研究中,最小组(40目,相当于300 μm)的微钙化在暗场成像上清晰可见,而吸收成像对比度下降明显导致显示不清,与Yang等[24]的研究结果一致。本研究提示,乳腺癌可在其触诊阴性阶段,通过光栅成像上的微钙化进行检测。重要的是,这一无创可重复手段具有研究微钙化机制的潜力,从而可以充分理解微钙化这一独特的乳腺癌早期标记的意义。
根据化学构成的不同。乳腺钙化通常分为两型[23]:Ⅰ型和Ⅱ型。Ⅰ型钙化以二水草酸钙为主,分泌产生,多存在于囊性增生性病变中,在恶性病变中非常少见;Ⅱ型钙化以羟基磷灰石为主,是磷酸钙盐的一种,多出现在增生性病变中,恶性病变多见,也可出现在良性病变中。Ⅱ型钙化比Ⅰ型更常见,是Ⅰ型的2~3倍[23]。磷酸钙与乳腺恶性病变密切相关,因此本研究选择磷酸钙来模拟乳腺微钙化。微钙化的形状、大小和内部结构均不规则、不统一,本研究也没有刻意将钙化做成规格统一的钙化颗粒,目的就是为了更加逼真地模拟临床实际中的乳腺微钙化。当然,临床实践中乳腺微钙化不仅形态多样,化学构成也非常复杂。
本研究有以下不足之处。首先,选择磷酸钙作为微钙化模型比较单一,不能全面反映实际情况。乳腺微钙化的成分非常复杂,单一的化学构成并不能真正代表实际情况,未来需选择不同构成的钙化模型来验证本研究结果。其次,选择的微钙化颗粒不够微小,因为大多数恶性钙化在300 μm以下,本研究中最小粒径约300 μm,因此对300 μm以下的钙化颗粒的显示情况未知。但本研究发现,即使是最小粒径,暗场成像仍能清晰显示,基于暗场小角度成像的原理,其能显示超微结构。因此推测,对于300 μm以下的钙化颗粒,暗场成像也应有很好的显示能力,需继续深入研究。再次,采集时间长,辐射剂量较常规X线摄影大。本研究中一次数据采集的时间约7 s,与常规乳腺 X线摄影相比远远超出临床应用范围。此外,长时间曝光意味着辐射剂量增加。本研究中的成像方案与Wang等[17]的研究类似,他们对一个厚度约4.5 cm的乳腺样品成像,腺体组织接受的照射剂量约26.2 mSv,远超临床标准。
本研究表明,基于实验室X线源的光栅成像在一次数据采集中可同时获得微钙化模型的衰减信息和小角度散射信息,这种多模态成像方式可提供更丰富的互补信息。暗场成像提高了微钙化的对比度,改善了微钙化的可视性。吸收成像和暗场成像两种信息互补,有望提高微钙化的检出率,增加放射科医师的诊断信心。相信在不久的将来,基于常规X线源的光栅成像系统将应用于临床,并在未来的乳腺癌诊疗模式中发挥重要作用。
