冷季放牧补饲对甘肃高山细毛后备母羊瘤胃代谢参数及瘤胃微生物数量的影响
2018-07-30靳继鹏郭武君张筱艳张昌吉张勇王春辉张利平
靳继鹏,郭武君,张筱艳,张昌吉,张勇,王春辉,张利平*
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.西藏山南市职业技术学校,西藏 山南 856000)
甘肃高山细毛羊对高寒地域严酷的天然生态环境具有很好的适应性、较高的生长生产性和稳定的遗传性,在青藏高原、祁连山山脉及类似高寒牧区的养羊业中有不可替代的养殖地位和经济价值[1-2]。但因为甘肃高山细毛羊常年以放牧为主,当地海拔、地形、温湿度、降水量等自然环境和人为干扰的影响,使得草场沙化,牧草质量下降,同时冬春季(11月至次年5月)枯草期营养缺乏和寒冷应激,严重影响了高山细毛羊的生长生产性能,导致羊只减重、抵抗力下降、羔羊发育不良等[3-4]。也就是说,冬春两季牧场营养缺乏和寒冷应激极大地制约了绵羊生产水平[5-6]。相关研究表明,补饲对高寒牧区绵羊生产有明显的正向影响[7-9]。杨博等[10]通过分析北方草原草畜平衡,宫旭胤[11]通过调整冷季补饲方案、减少存栏量,来提高牧户的养殖效益。因此,在冬春两季枯草期进行放牧和补饲合理结合,是实现放牧家畜营养均衡最主要的措施[12]。近年来,“放牧+补饲”二者的最佳结合方式以及补饲的营养需要量成为研究的焦点[13]。目前关于甘肃高山细毛羊后备母羊补饲对瘤胃内环境研究较少。本试验参照中国美利奴25 kg后备母羊日增重150、100和50 g营养需要量[14],研究补饲料不同对甘肃高山细毛后备母羊(12月龄)的瘤胃内环境的影响。找出合理的“放牧+补饲”方案,为改变甘肃肃南县高寒牧区由于营养供给不足后备母羊2.5岁才能配种的饲养方式,减轻草场的压力,减短饲养周期,提高牧民们的养殖效益提供数据支持。
1 材料与方法
1.1 研究区概况
甘肃省肃南县属于高寒半干旱气候牧区,气温低且昼夜温差较大,冬季寒冷而漫长,夏秋季凉爽而短。海拔高(约1327~5564 m),年均气温在4 ℃左右,年均降水量66~600 mm,无霜期为127 d,枯草期7个月以上,其生产节律见表1[15-20]。

表1 典型牧户生产节律Table 1 Production rhythm of typical farm
注:补饲以玉米和燕麦青干草结合为主。
Note: The main supplement with corn and oat hay.
1.2 试验设计
试验羊选择甘肃肃南裕固族自治县康乐乡赛鼎村牧户家健康、体型大小一致的甘肃高山细毛后备母羊(12月龄)48只,随机分为4组(试验a组、b组、c组,对照组),各组12只;在自然放牧的基础上,试验a组补饲1号料、试验b组均补饲2号料、试验c组补饲3号料,对照组不补饲,随大群放牧自由采食。试验预试期前对试验后备母羊进行免疫和编号,预试期10 d,试验期80 d,共90 d,在甘肃肃南县赛鼎村牧户家于2015年2月至5月进行。
1.3 饲粮组成及营养水平
在测定甘肃高山细毛羊后备羊牧草采食量的基础上,参照中国美利奴羊25 kg后备母羊营养需要量,根据营养缺少量上配制补饲饲料(扣除放牧采食营养)配方3个,其中补饲料1号料为饲料场加工的颗粒饲料,2、3号补饲中的玉米为整粒玉米、干草铡短饲喂。进行“放牧+补饲”试验。扣除放牧采食营养后,筛选和制定适宜的补饲料配方(表2)和应补饲喂量(表3)。

表2 试验饲粮组成和营养水平Table 2 The experimental diet composition and nutrition level
注:代谢能为计算值,其他数值为实测值。
Note: Metabolizable energy is calculated, and other values are measured.
1.4 瘤胃液采集
试验最后一天早晨,补饲3 h后,人工导管抽样法采集瘤胃液50 mL,每组采集3只,采集后立刻测定pH,经4层纱布过滤,滤液装于经高压灭菌的冻存管内,液氮罐带回,冰箱-70 ℃实验室保存备用。
1.5 测定项目与方法
1.5.1瘤胃液内环境 pH用便携式PHS-2F(雷磁型)数字酸度计直接测定;NH3-N(氨态氮)参照冯宗慈等[21](1993)的方法进行;URN(urea nitrogen,尿素氮)采取脲酶法测定,试剂盒购自南京建成生物工程研究所,计算公式:

表3 补饲喂量Table 3 Complementary feeding amount [kg·(head·d)-1]
注:每天早晨出牧前、下午归牧后的补饲量分别是每天补饲量的50%。
Note: The supplementary feed amount before and after grazing accounts for 50% of the total amount at every day.

总氮:凯氏定氮法测定;蛋白氮:瘤胃液中蛋白氮=瘤胃液总氮-瘤胃液氨态氮-瘤胃液尿素氮;VFA(volatile fatty acids,挥发性脂肪酸):参照李勇等[22]使用安捷伦(Aglient)6890N型气相色谱仪测定。
1.5.2瘤胃微生物数量 瘤胃液DNA的提取:后备母羊瘤胃微生物Total DNA 提取过程按照天根(北京)粪样DNA提取试剂盒(DP328)说明书进行;DNA的检测采用1%的琼脂糖凝胶电泳检测Total DNA,超微量分光光度计检测OD260/280值;引物设计与合成参照张勇[23]、周瑞[24]、Muyzer等[25]和王海荣[26]的研究,结果见表4,由上海生物工程有限公司合成。
Real-time qPCR:本试验采用SYbR GreenⅠ染料法,以β-actin为内参基因,反应体系见表5,在Light Cycler®480型荧光定量PCR仪上进行反应。反应参数为:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸15 s,40个循环,在延伸期收集荧光信号。全部检测样品均设定1个去离子水代替模板的阴性对照。

表4 瘤胃微生物qPCR的引物序列Table 4 Primer sequence of rumen microbial qPCR
1.6 试验主要仪器与试剂
试验主要仪器有瑞士Roche公司Light Cycler 480荧光定量PCR仪,超速冷冻离心机TGL-16M(长沙湘仪离心机仪器有限公司),超微量分光光度计NanoPhotometer®Pearl 360(德国Implen公司),琼脂糖凝胶电泳仪DYY-6C(北京六一仪器厂),凝胶成像仪Bio-Print 1000X-Press(法国Vilber lournat公司)等;荧光定量试剂盒SYBR®Premix Ex TaqTM等均购自TaKaRa(大连)公司,二水乙二胺四乙酸二钠(Na2EDTA·2H2O)、RNA提取试剂Trizol购自TransGen(北京)公司,琼脂糖购自西班牙Biowest Agarose,Gold View核酸染料购自北京赛百盛公司。

表5 20 μL反应体系Table 5 20 μL reaction system (μL)
1.7 数据处理
相对表达量采用2-△△ct法[27]计算,数据用SPSS 21.0软件进行单因素方差分析,采用LSD法多重比较各组瘤胃代谢参数及瘤胃微生物数量,结果均用平均数±标准误(mean±SE)表示,有0.01和0.05两个差异水平。
2 结果与分析
2.1冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃代谢参数的影响
2.1.1pH、NH3-N、URN、蛋白氮、总氮 由表6可知,绵羊瘤胃液pH值试验a和b组极显著低于对照组(P<0.01),试验c组显著低于对照组(P<0.05);绵羊瘤胃NH3-N浓度试验a、b和c组极显著高于对照组(P<0.01),而试验b组又极显著高于试验c和a组(P<0.05)。试验组瘤胃液总氮含量、蛋白氮含量极显著高于对照组(P<0.01),试验a组瘤胃液总氮含量极显著高于试验c组(P<0.05),试验a组的瘤胃蛋白氮的含量极显著高于试验b和c组(P<0.01);瘤胃液URN浓度试验组与对照组各组之间差异均不显著(P>0.05)。
2.1.2冷季补饲对甘肃高山细毛羊(12月龄)VFA的影响 表7显示,绵羊瘤胃总挥发性脂肪酸浓度试验a组和b组均极显著高于对照组(P<0.01),试验b组显著高于c组(P<0.05);乙酸摩尔比试验a组极显著高于对照组(P<0.01),试验b和c组显著高于对照组(P<0.05);丙酸摩尔比试验a组极显著高于对照组(P<0.01),试验a组显著高于试验c组(P<0.05),试验b和c组显著高于对照组(P<0.05);丁酸摩尔比试验a组极显著高于试验c组(P<0.01);绵羊乙/丙试验b组显著低于对照组(P<0.05),试验组之间乙/丙差异不显著(P>0.05)。
2.2 冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃微生物数量的影响
冷季放牧补饲对甘肃高山细毛羊瘤胃微生物相对表达量的测定结果见表8,绵羊瘤胃白色瘤胃球菌相对表达量试验a组极显著高于试验b组、试验c组和对照组(P<0.01),试验c组极显著高于试验b组和对照组(P<0.01),试验b组极显著高于对照组(P<0.01);绵羊瘤胃产琥珀酸丝状杆菌相对表达量试验b组显著高于试验a组和对照组(P<0.05);绵羊瘤胃黄色瘤胃球菌相对表达量试验a和b组均极显著高于试验c组和对照组(P<0.01);绵羊瘤胃原虫相对表达量试验a组极显著高于对照组(P<0.01),试验b和c组显著高于对照组(P<0.05);绵羊瘤胃真菌相对表达量对照组极显著低于试验b和c组(P<0.01),试验a组极显著低于试验b组(P<0.01),试验a组显著低于试验c组(P<0.05)。
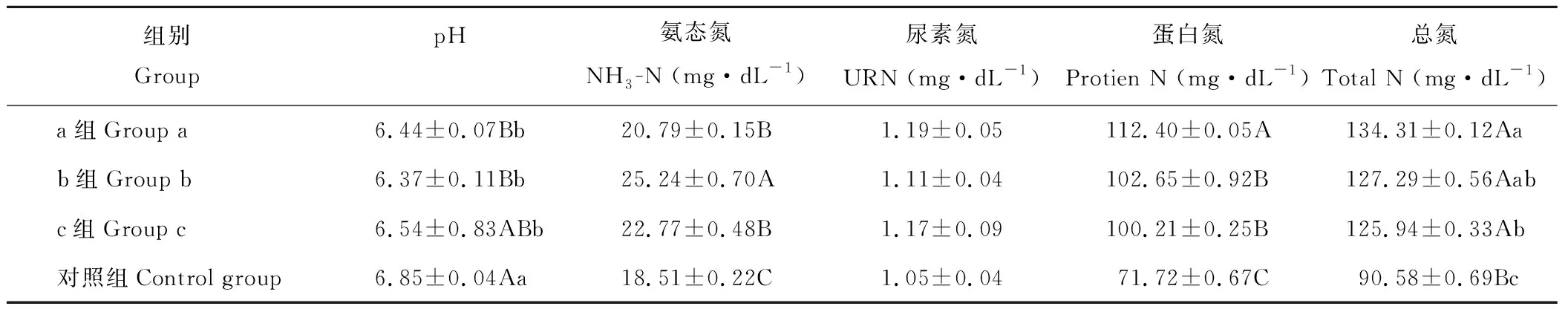
表6 冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃pH、氨态氮、尿素氮、蛋白氮和总氮的影响Table 6 Impact of cold-season grazing and supplementary feeding on rumen pH, NH3-N, urea nitrogen (URN), protien N and total N of Gansu Alpine Fine Wool Sheep (12-month-old)
注:同列不同小写字母代表差异显著(P<0.05),不同大写字母代表差异极显著(P<0.01),无字母或相同字母表示差异不显著(P>0.05)。下同。
Note:Values with different lowercase within the same column are significantly different (P<0.05), values with different capital letter are extremely significantly different (P<0.01), values with no letter or the same letter are no significant difference (P>0.05). The same below.

表7 冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃VFA的影响Table 7 Impact of cold-season grazing and supplementary feeding on rumen VFA of Gansu Alpine Fine Wool Sheep (12-month-old)
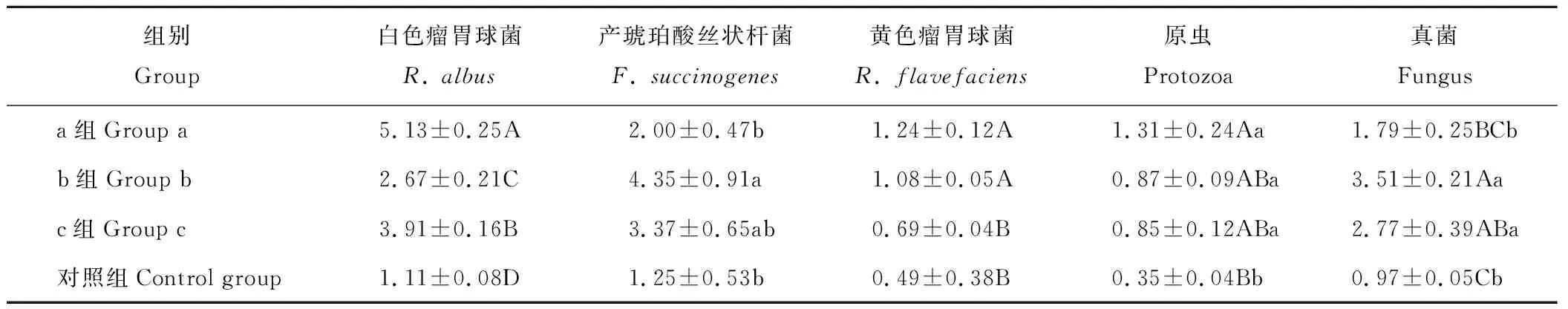
表8 冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃微生物数量的影响Table 8 Impact of cold-season grazing and supplementary feeding on number of rumen microbes of Gansu Alpine Fine Wool Sheep (12-month-old)
3 讨论
3.1 冷季放牧补饲对甘肃高山细毛羊(12月龄)瘤胃代谢参数的影响
反映瘤胃发酵情况的基本指标是pH值,瘤胃pH值的影响因素有很多,如食入饲粮性质、唾液分泌量、瘤胃内生成、吸收和排出VFA的速度等,但其变化的根本原因则是饲粮结构与营养水平[28]。张建勋等[29]报道,饲粮精料比例的提高可导致南江黄羊体外发酵培养液中pH的下降,与刘大程[30]的研究结果,绵羊瘤胃pH随着粗饲料比例的增加而增加的变化相同。本试验中,试验a、b和c组绵羊瘤胃pH值低于对照组5.99%、7.01%和4.53%,原因是对照组绵羊在冬春季节内,只采食低质的牧草,使其瘤胃发酵不良,瘤胃液中TVFA的生成量降低。但试验a组的pH值高于试验b组,与张腾等[31]研究表明瘤胃液pH高精料组显著高于低精料组结果不一致,是1号饲粮中胡麻饼、麸皮和磷酸氢钙等导致。可见,精料较多的补饲粮,可溶性碳水化合物含量高,瘤胃微生物会将其降解,生成大量的VFA,提供瘤胃微生物生长和繁殖所需要的能量,从而提高瘤胃微生物活性,微生物蛋白产量增加,使绵羊体内的能量与氮的营养需要得到满足,后备母羊在冬春枯草期保持较好的膘情,减少自身储备能量的消耗,防止度过漫长枯草期出现掉膘和发育不良。
研究表明,瘤胃中碳水化合物发酵的主要产物是VFA,有乙酸、丙酸、丁酸等,其中乙酸数量是最多的,当饲喂饲粮纤维素含量高时,会降低瘤胃中脂肪酸混合物总产量,但乙酸的产量会提高。当反刍动物食入的饲粮易发酵时,会增加微生物活动,从而VFA浓度增加。VFA的含量及组成比例进一步影响机体代谢和生产性能。刘敏雄[32]研究报道,当粗饲料含量增高时,纤维素分解菌占优势,乙酸含量就上升,而饲粮中淀粉含量高时,分解淀粉的微生物占优势,丙酸含量显著增多。Kang等[33]研究报道,沼泽型水牛饲粮中添加精料可以提高瘤胃的总VFA、乙酸、丙酸和丁酸的浓度。本试验中,试验a、b和c组绵羊瘤胃总VFA浓度比对照组高42.71%、52.05%和20.77%,试验a、b和c组绵羊瘤胃乙酸和丙酸摩尔比分别比对照组高44.31%、34.26%、26.59%和69.61%、49.26%、31.25%,乙/丙随着补饲料中粗料的增加呈现升高态势,这与前人研究一致,可能原因是精饲料降解快于粗饲料,精饲料的降解会导致丙酸摩尔比升高,导致乙酸摩尔比相对降低而使试验组乙/丙比对照组相对降低。可见,放牧绵羊在冬春季节营养不足,不良瘤胃内环境,微生物活性受到抑制,放牧绵羊体内能量与氮的营养状况导致恶化,这是放牧绵羊在冬春季节内掉膘的主要原因。因此,牧区绵羊在冬春季节传统放牧的基础上,要根据后备母羊生理状况和营养需要量进行合理补饲,来达到改善瘤胃内环境和提高牧民经济收入的目的[34]。
衡量瘤胃发酵状况的另一个重要指标是NH3-N含量。在瘤胃中瘤胃微生物生长缓慢,碳水化合物的分解利用也受阻时,是由于家畜食入了蛋白质含量不足或蛋白质难以降解时,瘤胃液NH3-N浓度很低[35]。刘大程[30]研究报道,绵羊瘤胃NH3-N浓度随着粗饲料比例的增加逐渐增加。王雅倩等[36]研究报道,以粗饲料为主的饲粮中,提高蛋白质水平会显著提高湖羊瘤胃NH3-N水平。本试验中,放牧补饲组和自然放牧组的NH3-N浓度均在适宜范围之内,但试验a、b和c组绵羊瘤胃NH3-N浓度高于对照组12.32%、36.36%和23.01%,这可能是由于“放牧+补饲”组补饲粮蛋白质含量较高,蛋白质的降解使NH3-N 浓度升高,在适宜范围内,NH3-N浓度与微生物蛋白质的合成呈正相关,从而微生物蛋白质含量提高。
瘤胃液总氮主要包括唾液蛋白氮、饲料中可溶解蛋白氮、NH3-N、URN和菌体蛋白氮等,饲料蛋白质的含量及降解率直接影响其含量,也与饲粮在瘤胃中滞留时间的长短有紧密关系[37]。本试验中,试验组瘤胃总氮含量极显著高于对照组,原因是补饲粮中有玉米、胡麻饼、苜蓿干草等原料,其中可溶性蛋白质、易消化碳水化合物和非蛋白含氮物含量高,且降解速率缓慢,有利于瘤胃微生物的生长和繁殖,使之对氮的合成强度大,菌体蛋白产量多,对瘤胃总氮贡献较大。对照组绵羊采食牧草,咀嚼和反刍时间较长,因而唾液蛋白氮浓度对瘤胃总氮贡献较大。NH3-N和URN的浓度处于较低水平,对总氮的贡献率较小。由此认为,试验组绵羊瘤胃液总氮的浓度主要由可溶解蛋白和菌体蛋白组成,而对照组试验组绵羊瘤胃液总氮的浓度主要由菌体蛋白组成。决定瘤胃微生物合成强度的关键因素是瘤胃内容物中速效能源及氮的浓度,当饲粮中蛋白质含量不足时,就可能降低氨的浓度,导致微生物得不到充足的氮源而降低合成作用,同时能量与氨释放的同步性也是影响微生物合成强度的重要因素。
瘤胃液URN主要来自饲粮和瘤胃氮素再循环,饲料采食速度,饲料内尿素氮浓度及其溶解速度和唾液分泌量都影响URN浓度。瘤胃中脲酶活性很高,是微生物利用NH3合成蛋白质的4倍,故瘤胃中URN浓度一般很低。本试验中,试验组瘤胃中URN浓度变化为0.64~1.63 mg·dL-1,对照组瘤胃中URN浓度变化为0.43~1.65 mg·dL-1,符合上述规律。试验组绵羊瘤胃尿素氮浓度显著低于对照组绵羊瘤胃液URN浓度,原因是对照组绵羊采食天然牧草,咀嚼、反刍次数多及分泌的唾液量大,进入瘤胃的再循环尿素增多[38]。较低的尿素对氮的利用有利,过高会导致血浆及尿中URN升高而造成氮浪费。从这点考虑,补饲日粮的组合是合理的。
瘤胃蛋白氮饲料可降解蛋白氮和微生物蛋白氮,在一定程度上可反映微生物蛋白合成状况。本试验中,试验组瘤胃蛋白氮浓度极显著高于对照组,可能是补饲日粮中能量、蛋白质水平及饲料组成合理,其速效能源丰富,因而使可降解氮能被充分利用于蛋白质合成,导致瘤胃液中蛋白氮含量上升。瘤胃液蛋白氮的动态变化和瘤胃总氮、pH值呈正相关,进一步证实了较理想的瘤胃液pH环境有利于饲料蛋白质的降解和微生物合成的诊断[39]。
3.2 冷季补饲对甘肃高山细毛羊(12月龄)瘤胃微生物数量的影响
原虫是瘤胃中存在个体较大、数目较多的微生物,参与宿主的消化代谢,其发酵底物主要为颗粒性淀粉和可溶性糖,产物有VFA,CO2等。原虫能够将碳水化合物转变成支链淀粉并藏于其体内,从而避免了其他细菌对淀粉和可溶性糖的快速发酵,保证了瘤胃内环境的稳定,而且内纤毛虫还会在消化过程中产生氢,所以原虫对于瘤胃微生态系统很重要[40]。Grubb等[41]研究表明,当绵羊的日粮由100%粗料转变为一定精粗比时,原虫数目增加,但种属上变化小。本试验中,试验a组瘤胃原虫数目极显著高于对照组,这是因为试验a组高营养水平日粮使瘤胃原虫活性增强、数量增多,这对于高精料补饲日粮下稳定pH值具有重要意义。
反刍动物可以消化其他动物无法消化的纤维含量高的粗饲料,主要归功于反刍动物瘤胃内的纤维降解菌对粗饲料的有效分解[40]。Fernando等[42]研究指出当高粗日粮转换成高精日粮时,瘤胃中的牛链球菌、乳酸杆菌、嗜淀粉瘤胃杆菌、反刍月形单胞菌和埃氏巨型球菌的数目增加,但黄色瘤胃球菌、琥珀酸丝状杆菌和丁酸弧杆菌等一些纤维降解菌的数目减少。Tajima等[43]研究发现,当瘤胃中的纤维素含量增加时,纤维降解菌的数目也相应增加;而饲喂纤维素含量低、淀粉含量高的日粮时,纤维降解菌的数量相对减少乃至缺乏。本试验中,试验a、b和c组绵羊瘤胃白色瘤胃球菌比对照组高362.16%、140.54%、252.52%,试验a、b和c组绵羊瘤胃产琥珀酸丝状杆菌比对照组高60.00%、248.00%、169.60%,试验a、b和c组绵羊瘤胃黄色瘤胃球菌比对照组高153.06%、120.41%、40.82%,表明放牧补饲有利于绵羊瘤胃纤维降解菌的生长繁殖,提高了纤维物质的降解效率,从而促进甘肃高山细毛羊对补饲日粮的消化利用。无论“放牧+补饲”组还是自然放牧组,绵羊瘤胃内白色瘤胃球菌数目都比黄色瘤胃球菌数目高,这与冯仰廉[44]研究指出白色瘤胃球菌会产生对黄色瘤胃球菌有抑制作用的细菌素,从而影响黄色瘤胃球菌数量的结论相同。
4 结论
试验组绵羊瘤胃pH值极显著或显著低于对照组,瘤胃纤维降解菌、原虫数目较高。a组蛋白氮、总氮浓度最高,乙酸、丙酸、丁酸摩尔比均最高,b组氨态氮、总VFA浓度最高,乙/丙最小,对照组乙/丙最大。补饲有利于瘤胃微生物的活性,增加微生物蛋白质产量,瘤胃纤维降解菌的生长繁殖。
综上所述,在冬春枯草期,甘肃高山细毛羊采用“放牧+补饲”的饲养方式,补饲日粮中能量、蛋白质水平及原料组成合理,均能正向影响其后备母羊其瘤胃代谢参数及微生物数量,以1号料补饲效果最优,2号料也能起到理想效果。
