老芒麦种子离区酶活变化及组织学分析
2018-07-30张俊超谢文刚赵旭红张宗瑜赵永强王彦荣
张俊超,谢文刚,赵旭红,张宗瑜,赵永强,王彦荣
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
老芒麦(Elymussibiricus)是禾本科披碱草属的多年生草本植物,是披碱草属的模式种[1]。老芒麦主要分布于北半球的多个地区,包括东欧、北美、中国、瑞典及日本等地[2]。国内老芒麦资源亦较丰富,在新疆、内蒙古、青海、西藏等省区均有分布[3]。由于其较强的耐寒耐旱性,对环境的适应性强、产草量高、草品质好等优点,在我国西北地区,尤其是青藏高原地区常作为家畜的优良牧草[4]。同时老芒麦还有植被恢复、绿化护坡等用途[5]。然而,严重的落粒性常导致老芒麦种子产量的极大损失,由此限制了老芒麦新品种的研发及推广应用。
国内外有关植物种子落粒的研究报道较多,主要集中在一些引种驯化早,栽培历史较长的谷类作物,如水稻(Oryzasativa)、高粱(Sorghumbicolor)、小麦(Triticumaestivum)、大麦(Hordeumvulgare)等[6-9]。其中,Pourkheirandish等[10]认为野生大麦种子落粒是由于其具有较脆的花序轴,这一性状由Btr1/2基因控制;Konishi等[6]研究表明水稻落粒过程会伴有离层的形成,且qSH1基因控制这一性状。此外,在高粱和小麦种子脱落过程也存在这一现象[7-8];Ji等[11]认为多聚半乳糖醛酸酶和β-内切葡聚糖酶会引起水稻离层细胞的胞间层和细胞壁降解;Yoon等[12]研究发现OSH15蛋白可通过抑制粳稻(Oryzasativasubsp.japonica)离区木质素合成而诱导种子落粒。这些研究从形态学、组织学、生理学、基因组学及蛋白组学等层面阐述了引起种子脱落的机制。相对而言,关于禾本科牧草种子落粒的研究较少,已有文献则集中在落粒评价、解剖结构观察、表型性状观测等方面[13-18],对于综合性与深层次分析落粒机理鲜有报道[19-20]。由于老芒麦作为栽培牧草被驯化与栽培历史相对较短[21],国内外对老芒麦落粒的研究主要包括落粒率的评价[13],落粒与农艺性状及产量性状的关系[22],落粒个体间杂交[23]等,对老芒麦种子落粒解剖结构和生理机制研究仍相对较少[20,24]。有学者认为多年生禾本科牧草单粒种子脱落与离区发育有关[25]。因此,在开展落粒评价的同时,对材料离区解剖结构及发育状况的研究将有利于揭示其落粒机理。
本研究通过对青藏高原地区野生老芒麦种子解剖结构和落粒关键酶的研究,分别从组织学及生理学方面揭示老芒麦种子落粒机理,为筛选低落粒材料及培育高产优质老芒麦新品种奠定研究基础。
1 材料与方法
1.1 试验材料
6种供试老芒麦均来源于甘肃省,于2016年3月使用种子进行室内萌发,待其长至3片叶子时,将材料移栽至榆中试验地,采取常规田间管理方式进行管理。前期试验已表明6种材料在落粒方面有所差异[26](表1)。
1.2 方法
1.2.1切片制作 在老芒麦抽穗后3和5周进行取样。取花序中间1/3区域的小花(种子)并剪取花-花梗结构(长度2~4 mm),将材料置于FAA固定液(无水乙醇∶冰乙酸∶甲醛∶水=60∶5∶5∶30,添加少量甘油)中4 ℃保存。将固定24 h后的材料取出,经过不同浓度的酒精溶液进行脱水,再分别经过无水乙醇与二甲苯混合液(无水乙醇∶二甲苯=1∶1)和二甲苯溶液(100%)进行透明,之后转移至石蜡中在烘箱浸蜡,利用硬质纸盒将材料包埋,在石蜡切片机上将蜡块切至4~8 μm厚的蜡片,在烘箱中进行烤片,然后在不同浓度的二甲苯、无水乙醇溶液中进行脱蜡并复水,通过1%番红溶液进行染色,最后用中性树胶进行封片。待树胶风干后于显微镜下成像并拍照。

表1 供试材料相关信息Table 1 Information of six E. sibiricus accessions in this study
WAH:抽穗后周数Weeks after heading.
1.2.2电镜扫描 取样时期为抽穗后3~5周,部位及材料固定同1.2.1,将固定过的材料取出,用镊子轻轻掰断花-花梗连接部位,将材料用胶粘附在金属块上。借助JSM-5600LV扫描电子显微镜(日本电子光学公司)进行观察。
1.2.3纤维素酶和多聚半乳糖醛酸酶的测定 取样时期为抽穗后1~5周,取样部位同1.2.1,须在低温环境下剪取花-花梗结构,并用锡箔纸包好,投入液氮中,再转移至超低温冰箱。提取时将低温保存的样品取出,放至液氮中,在电子天平(精确至0.0001 g)称取约0.05 g的样品,转移至研钵中加液氮研磨呈粉末状,加入500 μL提取缓冲液(预先配制好的柠檬酸-柠檬酸钠缓冲液),其中提取纤维素酶时加入的缓冲液pH值为4.8,提取多聚半乳糖醛酸酶时加入的缓冲液pH值为6.0。用移液器将溶液转移至1.5 mL离心管,4 ℃下12000 r·min-1离心20 min,之后吸取上清液250 μL至新离心管中,4 ℃保存。
试验对纤维素酶和多聚半乳糖醛酸酶均采用Elisa试剂盒(上海酶联生物科技有限公司)进行反应并在多功能酶标仪(Thermo Varioskan Flash 全波长多功能酶标仪)进行测定。
1.2.4断裂拉伸张力测定 在老芒麦抽穗后4~5周,各材料随机选取3~5个穗,借助电子拉力计测定断裂拉伸张力[26]。主要测定步骤为:a)将组装后的电子拉力计置于水平台面,并将模式调整为峰值模式;b)将种子长度的一半处用电子拉力计的夹头固定好;c)用手轻轻拉动穗部,待种子的种柄处发生断裂时,电子拉力计会记录数值。这个数值就表示该种子脱离母体时的断裂拉伸张力[breaking tensile strength,BTS (N)]。每材料测定20个种子,则各材料的BTS值为其平均值。
1.3 数据处理
两种酶的测定数据通过Excel 2013进行整理,借助Origin 8.5进行绘图。
2 结果与分析
2.1 老芒麦种子离区解剖结构分析
以两种落粒差异最显著的材料(ZHN03与XH09)为例(图1),分析它们在抽穗后3周和抽穗后5周时的离区结构(纵截面)变化。首先,在抽穗后3周时老芒麦种子离层结构已形成,而其种子落粒关键期为抽穗后4~5周,表明离层形成时期早于种子脱落。其次,离层由2~3层细胞构成(图1E深红色部分),这些细胞比邻接的细胞体积要小且细胞壁厚度低于邻接的细胞,形状多为椭圆形,细胞伸长方向与周围组织细胞互相垂直,细胞间排列紧凑。在染色过程中,离层细胞极易被番红染为深红色,而周围组织细胞只有细胞壁被染为浅红色,说明离层细胞的木质化程度远高于其周围组织细胞。在抽穗后3周时,两种材料离层结构均完整,而ZHN03离层细胞木质化细胞数量比XH09多(图1A,B);在抽穗后5周时,ZHN03离层木质化细胞数量仍多于XH09(图1C,D),且ZHN03离层结构完整,而XH09离层有明显的断裂,因此木质化细胞数量对维持离层结构完整性有重要作用。

图1 不同时期老芒麦种柄离区的变化(以ZHN03和XH09为例)Fig.1 Change of pedicel abscission zone at different stages of development in E. sibiricus (showed ZHN03 and XH09) 图中展示了老芒麦抽穗后3周(A、B)和抽穗后5周(C、D)时离区的解剖结构,以及放大后的离层(E)。黑色箭头是离层所在。This Figure show the anatomic structure of abscission zone of E. sibiricus at 3 weeks after heading (A, B) and 5 weeks after heading (C, D). And show the magnifying abscission layer (E). Black arrow indicates the location of abscission layer (AL).
2.2 老芒麦种子断裂面扫描结构分析
6种老芒麦种子离区(横截面)的电镜扫描结果如图2所示,由图中可看出供试老芒麦种子断裂面为非平面结构,离区(单个离层)由6~8圈细胞呈放射状分布在外围,单个细胞为椭圆形,细胞间排列紧凑而有规律。断裂面中心有3个维管束(种子通过维管束与植株相连,在此具有物质输送和支撑种子作用),呈凹陷状,不同时期,维管束结构并未发生明显变化(个别材料在抽穗后5周时离区中心位置出现了孔洞,这是材料在进行扫描电镜前抽真空处理所致)。
6种材料在抽穗后3~5周内离区结构变化有所不同。其中低落粒材料在抽穗后3~5周期间,离区结构并未发生明显变化,表现为离区表面粗糙,细胞间隙很明显;高落粒材料在抽穗后3~4周时离区表面粗糙,细胞间隙明显;抽穗后5周时离区表面变得光滑,细胞轮廓模糊,反映出该区域细胞发生降解(降解程度XH09>HZ02>LQ03>LT04)。
2.3 老芒麦种柄离区纤维素酶和多聚半乳糖醛酸酶活性变化
图3为供试材料纤维素酶(cellulase,CE)活性在不同时期的变化情况。由图中可看出6种材料在不同时期,它们的CE活性变化均不同。在抽穗后1~3周,6种材料CE活性变化较为一致,均呈现先下降后升高的趋势,这一时期ZHN03与XH09的CE活性低于其他4种材料。在抽穗后3~5周,6种材料CE活性变化出现差异,其中ZHN03与XH09两种材料CE持续升高,且XH09的CE活性升高幅度远高于ZHN03;其他4种材料CE活性在此时期持续下降,其中MQ01与LT04下降幅度较大。在抽穗后5周时,ZNH03、MQ01与LT04的CE活性较为相近,HZ02与LQ03的CE活性相近,XH09为供试材料中CE活性最高的材料(XH09WAH5=496.38 IU·L-1),而ZHN03为最低(352.98 IU·L-1)。6种材料在落粒关键期CE活性的平均值大小为:XH09>HZ02>LQ03>LT04>MQ01>ZHN03。

图2 老芒麦种子离区电镜扫描Fig.2 Scanning electron microscope of the abscission zone of E. sibiricus VB:维管束Vascular bundle;AZ:离区Abscission zone.
图4为供试材料多聚半乳糖醛酸酶(polygalacturonase,PG)活性在不同时期的变化趋势。由图可看出,供试材料PG在不同时期变化与CE变化有所不同。在抽穗后1~3周,6种供试材料PG活性变化较一致,均呈先下降后升高趋势,且ZHN03与XH09的PG活性低于其余4种材料。在抽穗后3~5周,XH09、LQ03与MQ01的PG活性呈现先升高后降低的趋势,而其余3种材料的PG活性在此时期呈先下降后升高的趋势。在抽穗后5周时,ZHN03与MQ01的PG活性较为接近,LQ03与LT04的PG活性相近,XH09的PG活性最高(XH09WAH5=186.5 pg·mL-1),HZ02次之(HZ02WAH5=165.06 pg·mL-1),而ZHN03为最低(ZHN03WAH5=124.77 pg·mL-1)。6种材料在落粒关键期PG活性的平均值大小为:XH09>HZ02>LQ03>LT04>MQ01>ZHN03。

图3 老芒麦材料不同时期纤维素酶活性变化Fig.3 Change of cellulase activity at different stages of development in E. sibiricus
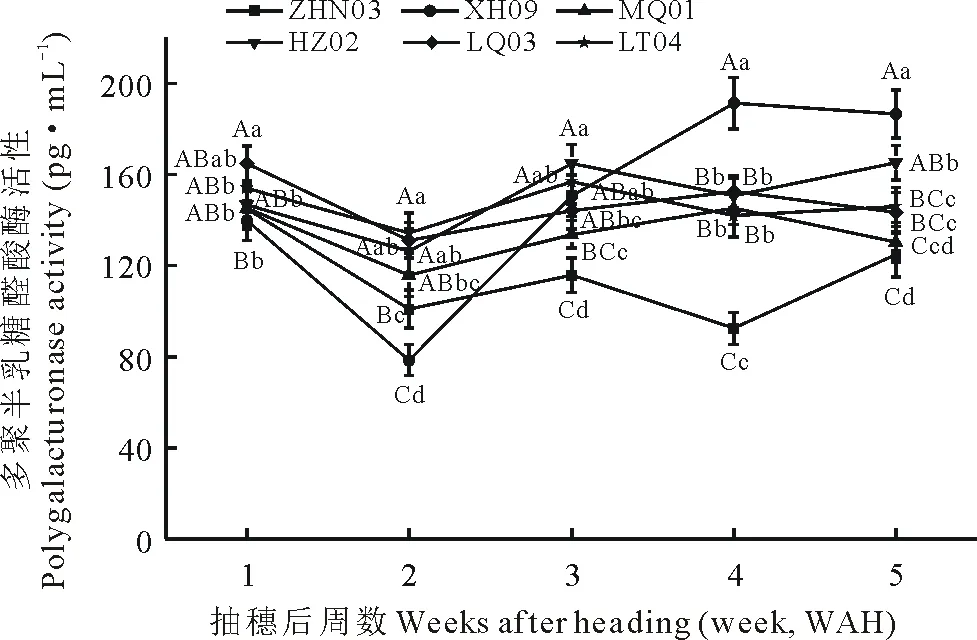
图4 老芒麦材料不同时期多聚半乳糖醛酸酶活性变化Fig. 4 Change of polygalacturonase activity at different stages of development in E. sibiricus
同一时期内不同小写和大写字母表示不同材料间在0.05和0.01水平存在显著性差异。Different small and capital letters during the same period mean significant difference among accessions at 0.05 and 0.01 levels, respectively.
2.4 老芒麦断裂拉伸张力与细胞壁水解酶活性关系
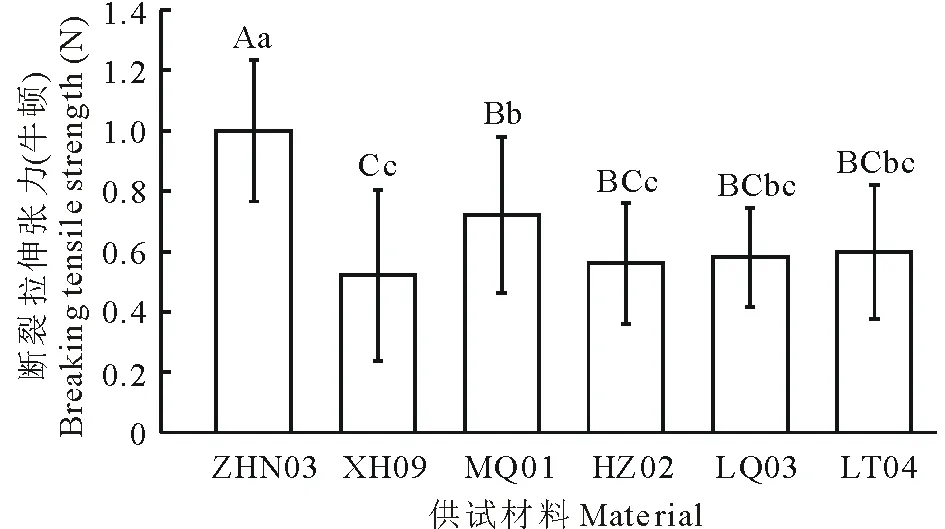
图5 老芒麦6种供试材料断裂拉伸张力值Fig.5 The value of breaking tensile strength of six E. sibiricus accessions in this study 不同小写和大写字母表示不同材料间在0.05和0.01水平存在显著性差异。Different normal and capital letters mean significant difference among accessions at 0.05 and 0.01 levels, respectively.
图5为供试材料在抽穗后4~5周时测定的断裂拉伸张力值(BTS)。由上图可以看出不同材料在种子落粒方面存在差异。其中,低落粒材料ZHN03的BTS值在0.01和0.05水平均显著高于4种高落粒材料;低落粒材料MQ01的BTS值在0.01和0.05水平均显著高于高落粒材料XH09。
表2分析了BTS与不同时期细胞壁水解酶活性的关系,其中BTS与WAH4时期纤维素酶活性及WAH3和WAH4时期多聚半乳糖醛酸酶活性呈极显著负相关(r=-0.952,P<0.01;r=-0.900,P<0.01;r=-0.900,P<0.01),与WAH5时期纤维素酶和多聚半乳糖醛酸酶活性均呈显著负相关(r=-0.746,P<0.05;r=-0.761,P<0.05)。该结果表明,老芒麦种子落粒与WAH4及WAH5时期两种细胞壁水解酶活性密切相关。

表2 老芒麦断裂拉伸张力与细胞壁水解酶活性的关系分析Table 2 The relationship between breaking tensile strength and activities of cell wall hydrolases in E. sibiricus
注:*表示在0.05水平相关性显著,**表示在0.01水平相关性显著。
Note: *shows significant correlation at the level of 0.05,**shows significant correlation at the level of 0.01.
3 讨论
3.1 老芒麦种子落粒与种子离区结构的关系
许多关于禾本科植物种子落粒的研究表明,种子离层的形成及降解过程与落粒具有相关性[8,18,27],如水稻的落粒特性是由某些基因的表达决定,这些基因直接控制着离层的发育[6,28-29]。杂草稻和野生稻虽均有落粒性,但二者的离层形成时期及降解时期均有明显差异[30]。本研究中的切片和扫描电镜结果表明供试老芒麦离区具有以下特点:离层细胞位于维管束周围且其形成时期早于种子脱落,细胞壁加厚程度低;组成离层结构的细胞木质化程度较高;离区有维管束结构存在。这与Xie等[20]和Zhao等[24]对老芒麦离区的观察结果相近。电镜扫描结果发现高落粒材料在抽穗后5周时离区细胞有明显降解,且不同材料间细胞降解程度不同,这与解剖结构观察发现高落粒材料在抽穗后5周时离层结构不完整相符合。关于种子离区结构的形成与降解,在其他植物中多有报道。Burson等[27]比较百喜草(Paspalumnotatum)和毛花雀稗(Paspalumdilatatum)草种子离层时发现它们的离层在孕穗期就已形成,但毛花雀稗草离层形成时期比百喜草稍早一些。Elgersma等[18]报道了多年生黑麦草(Loliumperenne)种子离区在抽穗阶段已形成,但在种子脱落时期未发现明显的细胞降解过程。Inoue等[31]研究表明野生稻种子离层形成于开花期,并在授粉后开始降解。此外,本研究结果表明,供试老芒麦中的高落粒与低落粒材料在离层木质化细胞数量上存在明显差异,离层木质化细胞数量越多,细胞壁的机械强度与致密度越大,在种子成熟期维持离层结构稳定性的能力就越强。Yoon等[29]研究认为种子离区木质素含量的高低与水稻种子脱落有关,通常较低的木质素含量更易引起水稻种子落粒。因此,离层细胞的木质化程度是造成老芒麦不同落粒特性的原因之一。
3.2 老芒麦落粒与种子离区细胞壁水解酶的关系
纤维素酶(CE)和多聚半乳糖醛酸酶(PG)是植物细胞壁的两种主要降解酶。前者主要降解植物细胞壁中的纤维素成分,后者则主要降解细胞壁中的果胶成分[32],许多研究表明这两种酶参与植物离层细胞的降解过程[33-34]。关于老芒麦种子离层细胞的降解过程,Xie等[20]研究表明在老芒麦种子脱落期间纤维素酶和多聚半乳糖醛酸酶活性均显著升高,且高落粒材料两种酶活性远高于低落粒材料。Zhao等[24]研究发现由栽培材料和品种组成的老芒麦群体与野生老芒麦群体在种子脱落期间两种酶的差异水平并不显著。本研究所用材料均为野生老芒麦,酶活测定结果表明,不同时期两种酶在不同材料间的变化趋势有所差异,种子落粒关键期的两种细胞壁水解酶活性高低与断裂面观察结果相符,这一时期细胞壁水解酶活性与种子落粒呈显著正相关。关于纤维素酶和多聚半乳糖醛酸酶在种子(果实)脱落(裂荚)过程中起到的作用有不同的报道。如陈发河等[35]研究认为葡萄(Vitisvinifera)离区纤维素酶和多聚半乳糖醛酸酶活性增加会加剧葡萄的落粒进程。Agrawal等[36]研究表明纤维素酶直接参与并促进大豆(Glycinemax)的裂荚过程,而多聚半乳糖醛酸酶在此过程中具有软化果荚防止其开裂的作用。这些研究结果表明,不同植物中,这两种酶在落粒(裂荚)过程中产生的作用有所差异,在今后的研究工作中也需要对此加以参考和深入分析。
结合组织观察和酶活性测定结果,推测老芒麦种子保持及脱离植株的机理为:WAH2~WAH3时期是种子形成重要时期,植株通过维管束向种子内输送营养物质,种子内部的纤维素酶和多聚半乳糖醛酸酶活性逐渐增加,由于种子离区既存在木质化的细胞,也有维管束的支撑,因而可以保持不落状态;WAH4~WAH5时期是种子脱落高发期,老芒麦高落粒与低落粒材料相比,其种子离区纤维素酶和多聚半乳糖醛酸酶活性较高且离区细胞木质化水平较低,在细胞壁酶的作用下,离层细胞更易降解,加之维管束因种子脱水作用变得干脆易断,因而种子在外力的作用下很容易脱落。
4 结论
通过对青藏高原野生老芒麦离区组织学观察和酶活性测定的研究表明,供试老芒麦种子落粒与其离区的形成及降解过程有关。老芒麦离区在形成过程中的木质化有利于种子成熟前的保持,但落粒关键期细胞壁水解酶活性增强会促使离区结构降解,使得种子最终脱离植株。木质化水平高低及落粒关键期细胞壁水解酶活性强弱是产生落粒差异的主要原因。该研究从组织学和生理学层面揭示了老芒麦种子落粒机理,为今后筛选老芒麦低落粒材料和培育低落粒品种提供借鉴和参考。
