人血浆中介芬胺血药浓度LC-MS/MS测定方法的建立
2018-07-30*
*
1.大理大学,云南 大理 671000;2.云南省药物研究所,云南 昆明 650111;3.云南白药集团创新研发中心,云南 昆明 650111;4.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111
藜芦为百合科藜芦属植物,以根、根茎入药,用于治疗高血压、血吸虫、脑出血、中风痰壅、喉痹不通、癫痫、疟疾、骨折、跌打损伤、疥癣和恶疮等疾病,民间也用于癌症的治疗[1-5]。藜芦的主要活性成分为甾体类生物碱,其中介芬胺含量较高,达生物总碱的21.28%[6-12]。介芬胺具有抗肿瘤、抑制细菌生长的作用,其可以与Hh通路上游激活因子Smo特异性结合而抑制通路信号的传递,进而发挥抑制肿瘤细胞的增值效应;细胞实验也证实了介芬胺对胰腺癌细胞ASPC-1、PANC-1有明显的抑制作用[13-20]。同时,介芬胺也为毒性成分,且毒性较强[1,20],主要表现为致畸、生殖毒性等[20-22]。
介芬胺既是藜芦药材中的活性成分,也是毒性成分。在藜芦临床应用时,应进行药物浓度监测,防止过高的药物浓度导致的毒性反应。目前,国内外文献中尚无关于人血浆中介芬胺血药浓度测定方法的报道。本实验旨在建立人血浆中介芬胺血药浓度的LC-MS/MS测定方法,并对此方法进行方法学验证,为藜芦临床应用时血药浓度测定提供可靠检测方法。
1 仪器与试剂
1.1 仪器 高效液相色谱仪(Agilent 1200SL,美国Agilent公司)、三重四级杆质谱仪(API3200 Q-Trap,美国AB公司)、台式高速冷冻离心机(Allegra 64R,美国Beckman公司)、电子天平(DV215CD,上海 OHAUS公司)。
1.2 试剂 介芬胺(Jer)对照品(含量:98.90%,批号:SBJ150625,南京森贝伽生物科技有限公司)、非那西汀(Phe)对照品(含量:98%,批号:76747319,上海迈瑞尔化学技术有限公司)、甲醇、乙腈为色谱纯,水为超纯水,氨水、乙酸乙酯、醋酸铵为分析纯。
2 方法
2.1 检测条件
2.1.1 色谱条件 色谱柱:ZORBAX Extend C18柱,3.5 μm,4.6 mm×50 mm (美国Agilent公司);流动相:A:10 mmol/L醋酸铵(氨水调PH至8.8),B:乙腈;梯度洗脱方式:0~0.2 minV(A)∶V(B)=90∶10;0.2~2.0 minV(A)∶V(B)=10∶90;2.0~5.0 minV(A)∶V(B)=10∶90;5.1~7.5 minV(A)∶V(B)=90∶10,柱温:20 ℃;流速:400 μL/min;进样量:10 μL。
2.1.2 质谱条件 离子源:电喷雾离子源(ESI),扫描模式:正离子模式,检测方式:多反应监测(MRM),离子源参数:气帘气(CUR):20.00 psi,喷雾电压(IS):5500.00 V,雾化温度(TEM):500.0 ℃,雾化气(GS1):50.0 psi,辅助气(GS2):50.0 psi,碰撞气(CAD):2500 V;介芬胺定量离子对m/z为426.2→114.1,对应二级全扫描的质谱图如图1所示;非那西汀定量离子对m/z为180.2→110.0;介芬胺检测时的解簇电压(DP):75 V,射入电压(EP):10 V,碰撞池入口电压(CEP):15 V,碎裂电压(CE):50 V,碰撞室射出电压(CXP):3 V;非那西汀检测时的DP:40 V,EP:5 V,CEP:180 V,CE:23 V,CXP:12 V。
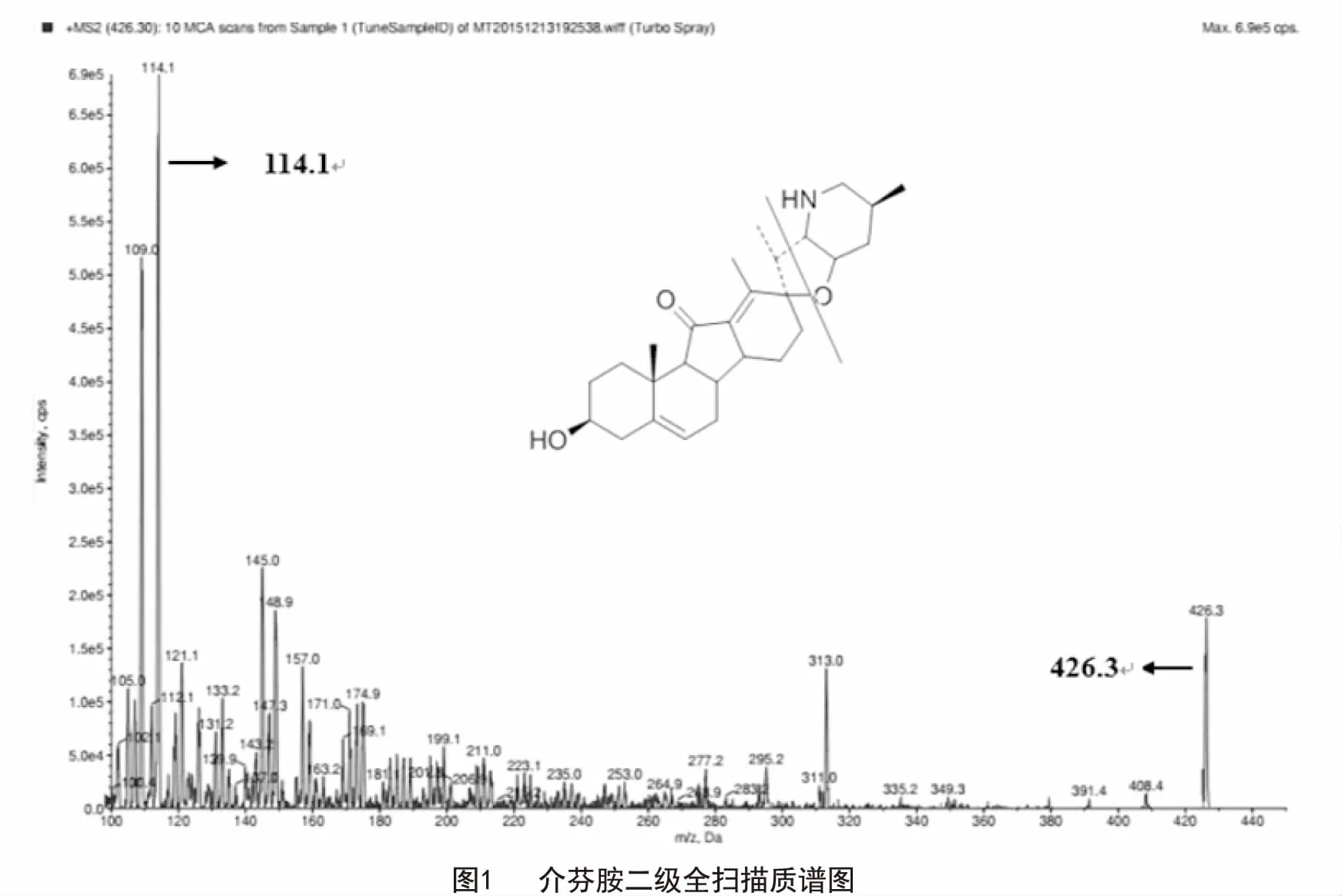
2.2 储备液和工作液的配制 精密称定介芬胺对照品5.85 mg、5.30 mg 2份,用甲醇溶解并稀释成浓度为334 μg/mL、212 μg/mL的储备液。将浓度为334 μg/mL的储备液用甲醇稀释至浓度分别为 867、434、217、108、54.0、27.0、9.00 ng/mL的校正工作液,用于制备标准曲线;同法将浓度为212 μg/mL的储备液稀释至浓度分别为785、196、49.0 ng/mL的质控工作液,用以制备质控样品;质控样品用于精密度、准确度、基质效应、稳定性考察。同法配制浓度为2.59 μg/mL的非那西汀内标工作液。
2.3 血浆样品的处理 取10 μL内标工作液至EP管中,室温氮吹至干,加入100 μL人空白血浆,涡旋混合2 min,加入40 μL 25%氨水,漩涡混合1 min,加入1 mL乙酸乙酯,漩涡混合3 min、6000 r/min离心10 min,取出上清液600 μL,室温氮吹至干,150 μL甲醇复溶,涡旋混合2 min、15000 r/min离心10 min,取上清待测。
3 实验结果
3.1 特异性 以2.1项下的检测条件分别进样空白血浆样品、空白血浆加标样品,测定,获得提取离子流图,见图2。由图可见,血浆中介芬胺、内标非那西汀的保留时间分别为3.73 min、3.29 min,表明血浆中內源性物质不影响介芬胺、内标非那西汀的检测。

3.2 标准曲线及定量下限 取10 μL内标工作液至已编号的2.0 mL EP管中,每管对应加入各浓度校正工作液10 μL,室温氮吹至干,加入100 μL空白人血浆,得血药浓度分别为86.7、43.4、21.7、10.8、5.40、2.70 ng/mL的标准曲线样品,按2.3项方法处理。每浓度平行2份,进样测定。以检测目标物峰面积(Ab)和内标峰面积(Ah)的比值为纵坐标Y,血药浓度为横坐标X,采用加权最小二乘法拟合(权重1/X2),结果见表1,确定定量范围为2.70~86.7 ng/mL,定量下限为2.70 ng/mL。

表1 LC-MS/MS法测定Jer标准曲线参数
注:NA表示该项不适用或未计算。
3.3 残留率 以线性最高浓度点样品-空白血浆样品顺序交叉进样,计算空白血浆样品中残留峰面积与定量下限样品峰面积比值。结果检测目标物残留值不大于7.45%,内标残留值不大于0.19%,表明残留量可忽略不计。
3.4 精密度与准确度 于3 d分别制备3批,每批浓度为2.70、4.90、19.6、78.5 ng/mL的血浆样品,每浓度平行6份,按2.3项下方法处理、测定,计算精密度与准确度,结果见表2。从表中结果可知,精密度与准确度结果符合生物样品分析要求。
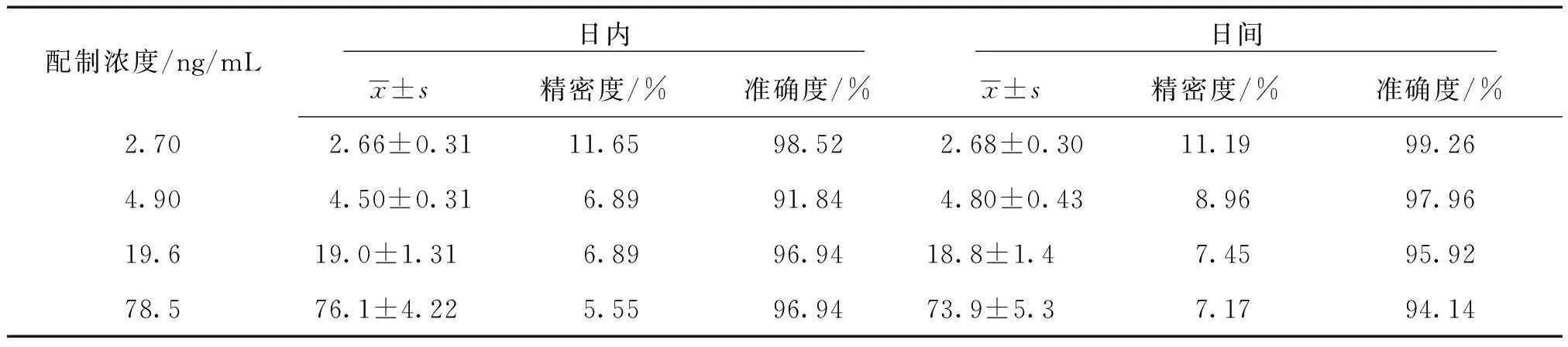
表2 介芬胺在人血浆中的精密度、准确度 (n=6)
3.5 基质效应 取来源于6个不同个体的空白人血浆,参照2.3项下方法提取空白基质;将不同浓度的质控工作液加入内标后用甲醇配制成表3中相应浓度,得不含基质的标准溶液;用该标准溶液复溶空白基质,得到含有基质的样品。测定该标准溶液和含有基质的样品,考察方法基质效应。
基质效应MF%=(含有基质样品峰面积/标准溶液峰面积)×100%;内标归一化的MF%=(目标物的MF/内标的MF)×100%。结果见表3,表明基质对介芬胺及内标非那西汀的影响较小,且对各浓度影响程度一致,满足生物样品分析检测要求。
表3 介芬胺、非那西汀基质效应
3.6 稳定性
3.6.1 标准储备液稳定性考察 处理、测定得到介芬胺、非那西汀储备液于2~8 ℃放置211 d后的峰面积与新鲜制备的标准溶液峰面积,计算两时间点相对偏差RE%值,分别为9.05%、0.05%,表明介芬胺、非那西汀储备液于2~8 ℃至少可以放置211 d。
3.6.2 质控样品稳定性考察 分别考察质控样品于待考察条件下的稳定性,结果见表4。表明介芬胺在血浆中于考察条件下放置均稳定。

表4 质控样品稳定性考察结果 (n=6)
4 讨论
4.1 流动相选择 在液质方法中常常选择在流动相水相中加入适量浓度的挥发性缓冲盐、弱酸及弱碱,形成缓冲体系,从而达到改善待测物的色谱行为、提高质谱灵敏度。本方法建立过程中分别考察了0.1%甲酸水-甲醇/乙腈、超纯水(氨水调pH值至8.8)-甲醇/乙腈、2 mmol/L醋酸铵-甲醇/乙腈等流动相体系,均未出峰;但在2 mmol/L醋酸铵(氨水调pH值至8.8)-乙腈、10 mmol/L的醋酸铵(氨水调PH至8.8)-乙腈流动相体系中均出峰且峰型良好,且目标物在10 mmol/L的醋酸铵(氨水调pH至8.8)-乙腈流动相体系中的响应值为2 mmol/L醋酸铵(氨水调pH值至8.8)-乙腈体系的两倍,故选用10 mmol/L的醋酸铵(氨水调pH至8.8)-乙腈作为流动相。
4.2 色谱柱选择 方法建立过程中考察了Xtimate C18,SunfireTM C18柱, ZORBAX Extend C18柱三根色谱柱。因方法中流动相pH为8.8,与SunfireTM C18的pH最高限相近,长时间使用会严重影响色谱柱使用寿命;Xtimate C18分析时间长,影响检测效率;ZORBAX Extend C18柱pH耐受为2.0~11.5,介芬胺、非那西汀保留时间分别为3.73 min、3.29 min,故选用ZORBAX Extend C18柱。
4.3 前处理方法选择 血浆样品前处理考察了乙腈蛋白沉淀法、乙酸乙酯提取法及固相萃取法,三种方法基质效应、回收率均能满足生物样品检测要求。但乙腈蛋白沉淀法定量下限是乙酸乙酯提取法定量下限的2倍;固相萃取法与乙酸乙酯提取法结果相当,但其成本较高,故选用乙酸乙酯提取法处理血浆样品。
