糖足颗粒剂外用对神经性糖尿病足大鼠模型的影响
2018-07-30毛黎黎高晓斐岳仁宋成都中医药大学临床医学院四川成都6007重庆市中医院重庆40000成都中医药大学附属医院四川成都6007
毛黎黎,高晓斐,岳仁宋(.成都中医药大学临床医学院, 四川 成都 6007; .重庆市中医院,重庆 40000; .成都中医药大学附属医院,四川 成都 6007)
糖尿病高危足是糖尿病患者足部存在周围神经病变或外周血管病变或皮肤病变,但无开放性病灶,伴有严重的足部溃疡风险的糖尿病足早期病变的总称,也就是处于糖尿病足Wagner分级法的0级[1]。处在糖尿病高危足期的患者多无明显的不适,加之目前医学界对该病的认识并不明确,无统一的防治标准[2-3],致使糖尿病足部溃疡的发生率日渐增长,糖尿病高危足的防治形势日趋严峻。笔者针对糖尿病高危足的病理特点,结合多年临床经验,引入“未病先防”的思想,临床上运用中药糖足煎剂浴足治疗糖尿病高危足,总有效率达92.3%,减慢或阻断了糖尿病高危足发展成为足溃疡的进程[4]。本研究意将糖足煎剂改为颗粒剂,药物组成不变,以动物实验评价该中药的药效动力学,以期为糖足颗粒剂的临床大量使用提供理论基础。
1 材料与方法
1.1 动 物
SPF级SD大鼠50只,雄性,体质量180~220 g,购自简阳达硕动物科技有限公司,由四川省实验动物检测中心检测,许可证号SCXK(川)2013-24。所有动物均在SPF级动物实验室里喂养,室内空气流通良好,室温(22±2)℃,相对湿度26%~30%。普通饲料喂养,自由饮水和摄食,适应性饲养7 d后进行正式实验。
1.2 药品、试剂与仪器
糖足颗粒剂药物组成:黄芪、当归、鸡血藤、乳香、没药、忍冬藤、川芎。中药均由成都中医药大学附属医院药剂科提供,并由其制备成颗粒剂。黄芪含黄芪甲苷、毛蕊异黄酮及多糖类等,忍冬藤含绿原酸、马钱苷及黄酮类化合物等,鸡血藤含芒柄花素及多糖类,鉴于这些成分大多能溶于水,故将其采用水煎煮法提取。当归含挥发油类、当归多糖及水溶性成分阿魏酸等,川芎含挥发油类及酚酸类等,两味药材均含有挥发油,且其水溶性成分为主要有效成分,故先将药材中的挥发油以水蒸气蒸馏法提取,再加水煎煮剩余药渣。乳香、没药为树脂类中药,粉碎成细粉后直接入药。STZ,Sigma公司产品,批号WXBB4624V;精蛋白锌重组人胰岛素注射液,商品名为优泌林,礼来苏州制药有限公司产品,批号C093656A;二甲苯(批号WG0069530)、冰醋酸(批号1093651),均为成都艾科达化学试剂有限公司产品;苏木素-伊红液,北京索莱宝科技有限公司产品,批号G1120;变色酸2R,成都格雷西亚化学技术有限公司产品,批号C0681840251。One-Touch-Ⅱ型血糖仪及血糖试纸,美国强生公司产品;MS9557型胰岛素注射笔,美国礼来公司产品;HH.W21.600型电热恒温水箱,余姚市东方电工仪器厂产品;9030(A)101(A)-0(S)电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品;BMJ-Ⅲ型包埋机、BMJ-Ⅲ型病理组织包埋冷冻台、PHY-Ⅲ病理组织漂烘处理仪,均为常州中威电子仪器厂产品;LEICA RM2245切片机,购自德国;ZT-12P2生物组织自动脱水机,孝感亚光医用电子技术有限公司产品。
1.3 动物分组
将60只雄性SD大鼠随机分为正常对照组,模型对照组,蒸馏水组,糖足颗粒剂高、中、低剂量组6组,每组各10只。
1.4 模型的建立
1.4.1 STZ糖尿病模型的建立
禁食不禁水12 h,手术组一次性腹腔内快速注射STZ 2 μL/g。分别在注射STZ后第3 d、第5 d、第7 d检测空腹血糖,空腹血糖≥13.9 mmol/L者为造模成功(餐后血糖>16.7 mmol/L[5])。此后每两天采用断尾取血法检测各组大鼠的随机血糖,给予血糖>25 mmol/L的大鼠胰岛素注射,每天腹腔注射中效胰岛素约4个单位[6]。每周称量体质量1次。造模期间死亡大鼠6只,分别为模型对照组2只,糖足颗粒剂高剂量组1只,糖足颗粒剂中剂量组1只,糖足颗粒剂低剂量组2只。手术组剩余44只造模成功大鼠。死亡大鼠解剖未见脏器异常,估计死亡原因为STZ造模而致的低血糖。
1.4.2 神经性糖尿病足模型的建立
按照参考文献[7]方法:将STZ糖尿病模型大鼠适应性饲养1周;以质量分数为100 g/L的水合氯醛0.3 μL/g 腹腔注射麻醉,取俯卧位,固定大鼠四肢;使用电推剪在左侧大腿去毛;以左侧大腿股骨的体表投影位置为骨性标志,在股骨外侧浅层和股骨平行做纵形切开,切口长约1.5 cm;钝性分离筋膜、股骨直肌和二头肌肌间隙,暴露坐骨神经,尽量不损伤肌肉组织;沿坐骨结节向下约1 cm处用无齿钳子钳夹坐骨神经干,持续10 s,咬合2齿为度,间歇10 s,重复3次,钳夹过程中不能将神经干夹断,损伤宽度约为3 mm;钳夹完成后,神经干由圆柱状变为扁平状,并且呈现半透明;损伤部位远端用手术缝合线标记,将神经放回原肌层,缝合皮肤;大鼠右侧大腿坐骨神经仅需打开肌层暴露后缝合。造模过程中死亡2只大鼠,其中蒸馏水组1只,糖足颗粒剂高剂量组1只。术后造模大鼠左侧后爪展爪反射消失[8]。
1.5 给药方法
根据体表面积换算法,糖足颗粒剂高、中、低剂量组的给药量依次为4.08 ,2.04,1.02 μg/g 体质量,用温蒸馏水12.5×10-3L(37~40 ℃)溶解后备用。将糖足颗粒剂均匀涂布于大鼠左侧大腿裸露皮肤上,用纱布包裹并用无刺激医用胶布固定,接触1 h后洗净。蒸馏水组同法给予等量等温蒸馏水。正常对照组、模型对照组不予任何处理。每天给药1 h,持续30 d。
1.6 检测指标
1.6.1 大体观察
术后每天观察大鼠伤口愈合情况,是否有感染、化脓、溃烂,足部是否出现红肿、溃烂,小腿肌肉萎缩程度和跛足行走状态。处死大鼠后解剖观察经钳夹处理的坐骨神经形态变化。
1.6.2 坐骨神经功能指数(SFI)
以硬纸板制作两端均不封口的暗箱,尺寸60 cm×15 cm×10 cm。实验开始前在暗箱里放置与箱底面积相等的白纸,将大鼠双后足浸没在纯黑墨水里,保证大鼠行走时能在纸面上留下清晰的黑色脚印。实验开始,将1只用墨水处理过双后足的大鼠从纸箱一端放入,驱使大鼠行走到另一端,然后撤出白纸,测量白纸上相对清晰的黑色脚印。分别于术后第2天、第2周和第4周进行SFI的测量和计算。根据沈江宁[9]改良的公式:SFI=-38.3(EPL-NPL)/NPL+109.5(ETS-NTS)/NTS+13.3(EIT-NIT)/NIT-8.8。其中PL指足印长度,即足跟到足趾的最长距离;TS指足趾宽度,第一足趾到第五足趾的距离;IT是指中间足趾宽度,第二足趾到第四足趾的距离;E和N分别代表实验侧和正常侧。正常SFI为0,神经功能完全丧失为-100[10]。
1.6.3 坐骨神经组织学观察
术后第4周,测量完大鼠足迹并计算SFI后,腹腔注射100 g/L 水合氯醛(0.3 μg/g)以麻醉大鼠,待其全身松软后,在术侧坐骨神经远端吻合口2 mm处切取再生神经约10 mm,FAA液固定48 h,切片脱蜡,变色酸2R染色 约10 min,2 g/L冰醋酸冲洗 2~3次,5 g/L亮绿冰醋酸染色10 min,自来水冲洗2 min,脱水封固。光镜下观察坐骨神经纵切面轴突再生和髓鞘形成情况。采用Mias 3.0图形分析系统(由四川大学图像图形研究所提供),随机取5个视野,对轴突面积、髓鞘面积进行半定量分析。
1.6.4 双侧腓肠肌湿重
取坐骨神经后,从肌肉起止点分离、剪取双侧腓肠肌,小心清除多余组织,称量、记录手术侧与正常侧腓肠肌质量,并将同只大鼠的两侧肌肉湿重相对比,计算恢复率。腓肠肌湿重恢复率=左侧腓肠肌湿重/右侧腓肠肌湿重×100%。腓肠肌湿重恢复率可以间接反映神经再生的情况。
1.6.5 腓肠肌组织学观察
迅速测量双侧腓肠肌湿重后,将术侧腓肠肌用FAA液固定48 h,逐级以1 000 g/L、900 g/L、800 g/L、700 g/L酒精脱水,二甲苯透明、浸蜡,石蜡包埋,常规切片4 μm,苏木素-伊红液染色3 min。采用Mias 3.0图形分析系统光镜下观察肌细胞生长情况。在每张切片上随机选取50个横纹肌细胞,采用半自动法测量每个肌细胞的最大横径,计算其均值作为每张切片的肌细胞直径,进行分析。
1.7 统计学方法

2 结 果
2.1 各组大鼠大体观察
手术组大鼠皮肤切口愈合良好,均属Ⅰ期愈合;术后1周左右,各组大鼠术侧足趾大多呈现苍白、无力,少数有红肿、溃疡现象出现。手术组大鼠跛行严重,术侧小腿三头肌体积均有不同程度缩小,糖足颗粒剂各剂量组萎缩程度较模型对照组和蒸馏水组轻。术后第4周,手术组神经钳夹刺激处近侧较正常对照组明显变细,手术组各组间神经近侧粗细相差不大。
2.2 各组大鼠SFI对比
5个手术组大鼠手术苏醒后步态即表现为跛行,呈现显著的坐骨神经功能损伤表现;术后第2天、第2周和第4周坐骨神经功能无明显恢复迹象,SFI为-70~-100。步态实验结果显示:术后第2天各手术组大鼠术侧脚印细长,脚趾与脚趾之间的空隙不明显,对比正常侧,PL明显增长,TS明显缩窄;术后第4周末,糖足颗粒剂各剂量组大鼠术侧脚趾仍无法分开,脚印模糊,测量困难。SFI测定显示:与正常对照组对比,同一时间点模型对照组、蒸馏水组和糖足颗粒剂各剂量组的SFI均上升,差别有统计学意义(P<0.05)。同一时间点糖足颗粒剂各剂量组的SFI与模型对照组对比,差别均无统计学意义(P>0.05)。同一时间糖足颗粒各剂量组间SFI对比,差别均无统计学意义(P>0.05)。见表1。


组 别动物数术后第2天第2周第4周 正常对照组10-(3.61±2.34)-(5.21±2.24)-(3.45±2.76) 模型对照组8-(86.17±6.25)∗∗-(85.94±11.64)∗∗-(83.28±5.28)∗∗ 蒸馏水组9-(87.26±7.35)∗∗#-(85.46±7.88)∗∗#-(83.58±5.56)∗∗# 糖足颗粒高剂量组8-(87.78±2.18)∗∗#△-(84.34±6.09)∗∗#△-(84.68±8.62)∗∗#△ 糖足颗粒中剂量组9-(87.48±5.12)∗∗#△*-(84.55±2.78)∗∗#△*-(84.18±5.22)∗∗#△* 糖足颗粒低剂量组8-(87.48±5.85)∗∗#△*▲-(84.26±13.28)∗∗#△*▲-(83.31±9.32)∗∗#△*▲
注:与正常对照组对比,**P<0.05;与模型对照组对比,#P>0.05;与蒸馏水组对比,△P>0.05;与糖足颗粒高剂量组对比,*P>0.05;与糖足颗粒中剂量组对比,▲P>0.05
2.3 各组大鼠坐骨神经组织学对比
光学显微镜下:正常对照组神经纤维髓鞘形态完整,排列有序、致密,厚薄比较均匀;模型对照组坐骨神经损伤远端轴突面积增多、形态不规则、排列混乱,髓鞘几乎消失;蒸馏水组坐骨神经损伤形态与模型对照组相似;糖足颗粒剂高剂量组新生纤维较多,有髓神经纤维比例增多, 排列紧密;糖足颗粒剂低剂量组出现新生纤维,有髓神经纤维比例增多,排列较整齐;糖足颗粒剂中剂量组坐骨神经组织学形态介于糖足颗粒剂高、低剂量组之间。与正常对照组对比,各手术组髓鞘面积总和减小,差别有统计学意义(P<0.05 );轴突面积总和大小不一,差别无统计学意义(P>0.05)。与模型对照组对比,蒸馏水组和糖足颗粒各剂量组的髓鞘面积总和减小,差别有统计学意义(P<0.05 ),轴突面积总和差别无统计学意义(P>0.05)。与蒸馏水组对比,糖足颗粒各剂量组的髓鞘面积总和、轴突面积总和差别无统计学意义(P>0.05)。糖足颗粒各剂量组间的髓鞘面积总和、轴突面积总和对比,差别无统计学意义(P>0.05)。见表2。


组 别动物数髓鞘面积总和轴突面积总和 正常对照组10191.42±34.55128.61±9.21 模型对照组8109.22±53.76∗∗134.57±117.56∗ 蒸馏水组953.84±14.31∗∗##133.13±22.75∗# 糖足颗粒高剂量组854.15±12.64∗∗##△131.45±37.53∗#△ 糖足颗粒中剂量组955.46±16.26∗∗##△*132.55±46.29∗#△* 糖足颗粒低剂量组854.18±23.26∗∗##△*▲132.72±21.89∗#△*▲
注:与正常对照组对比,*P>0.05,**P<0.05;与模型对照组对比,#P>0.05,##P<0.05;与蒸馏水组对比,△P>0.05;与糖足颗粒高剂量组对比,*P>0.05;与糖足颗粒中剂量组对比,▲P>0.05
2.4 各组大鼠腓肠肌湿重恢复率对比
肉眼大体观:正常对照组大鼠双侧腓肠肌肌肉最饱满,富有光泽与弹性。各手术组中糖足颗粒剂高剂量组大鼠术侧腓肠肌肌肉最饱满,最有光泽,触之有弹性;糖足颗粒剂中、低剂量组次之;蒸馏水组再次之;模型对照组最差。糖足颗粒剂3个剂量组的腓肠肌湿重恢复率分别与蒸馏水组、模型对照组对比,差别均有统计学意义(P<0.05)。糖足颗粒剂中、低剂量组的腓肠肌湿重恢复率与高剂量组对比,差别有统计学意义(P<0.05);低剂量与中剂量组对比,差别无统计学意义(P>0.05)。见表3。
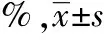

组 别动物数腓肠肌湿重恢复率 正常对照组1096.80±3.11 模型对照组830.85±4.63∗ 蒸馏水组939.56±5.33∗# 糖足颗粒高剂量组861.90±4.55∗#△ 糖足颗粒中剂量组953.73±8.12∗#△* 糖足颗粒低剂量组846.90±6.89∗#△*▲
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05;与蒸馏水组对比,△P<0.05;与糖足颗粒高剂量组对比,*P<0.05;与糖足颗粒中剂量组对比,▲P>0.05
2.5 各组大鼠腓肠肌组织学对比
光学显微镜下观察:正常对照组肌纤维饱满,排列规则。模型对照组的肌纤维直径较正常对照组显著缩短,肌纤维不饱满,显著皱缩,排列无规则,大多数细胞核游离于肌细胞之外,细胞间隙显著增加,肌纤维细胞整体呈现显著萎缩变性状态。糖足颗粒剂各剂量组肌纤维形态较规则,细胞间隙缩短。糖足颗粒剂高剂量组可见大部分肌细胞饱满,细胞核仍紧贴于肌纤维的周边,细胞间隙变小,肌纤维细胞整体呈现轻度萎缩变性状态。糖足颗粒剂低剂量组与模型对照组对比,肌纤维直径稍增大,形态较饱满,肌细胞核丢失不严重,细胞间隙减小,肌纤维萎缩变性状态减轻。糖足颗粒剂中剂量组肌细胞改变介于糖足颗粒剂高、低剂量组之间。与正常对照组对比,5个手术组大鼠的腓肠肌肌细胞直径减小,差别有统计学意义(P<0.05)。与模型对照组对比,糖足颗粒剂各剂量组腓肠肌肌细胞直径增大,差别均有统计学意义(P<0.05)。与蒸馏水组对比,糖足颗粒剂各剂量组肌细胞直径增大,差别有统计学意义(P<0.05)。与糖足颗粒剂高剂量组对比,差别无统计学意义(P>0.05);与糖足颗粒中剂量组对比,糖足颗粒低剂量组肌细胞直径无显著增加,差别无统计学意义(P>0.05)。见表4。
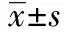

组 别动物数直径/μm 正常对照组1069.10±1.09 模型对照组838.01±16.04∗ 蒸馏水组930.05±3.59∗ 糖足颗粒高剂量组856.34±12.65∗# 糖足颗粒中剂量组950.46±6.26∗#△* 糖足颗粒低剂量组849.19±8.39∗#△*▲
注:与正常对照组对比,*P<0.05;与模型对照组对比,#P<0.05;与蒸馏水组对比,#P<0.05;与糖足颗粒高剂量组对比,*P>0.05;与糖足颗粒中剂量组对比,▲P>0.05
3 讨 论
糖足颗粒剂是专门用于治疗糖尿病高危足的中药复方,由黄芪、当归、鸡血藤、乳香、没药、忍冬藤、川芎7味中药组成,具有温经通络、活血化瘀的作用。
在本实验中,进行坐骨神经夹伤后,糖尿病大鼠表现出:术侧足趾苍白、无力,少数出现红肿、溃疡的现象,且术侧小腿三头肌体积均有不同程度缩小;步态表现为跛行,坐骨神经功能术后第2天SFI均在-70~-100。腓肠肌组织学观察示:肌纤维细胞整体呈现显著萎缩变性状态。坐骨神经组织学观察示:神经细胞脱髓鞘,轴突面积增多、形状不规则、排列混乱。糖足颗粒剂治疗组在进行了1个月的糖足颗粒剂温敷后,术侧小腿三头肌虽肉眼观察恢复不明显,但腓肠肌湿重恢复率有所升高,糖足颗粒剂各剂量组的恢复率高于蒸馏水对照组,差别有统计学意义(P<0.05);光镜观察肌纤维呈现轻度萎缩变性状态,糖足颗粒剂治疗组与蒸馏水对照组对比,肌细胞直径有所增加,差别有统计学意义(P<0.05)。但是,在坐骨神经功能和坐骨神经组织学观察上,糖足颗粒剂各剂量组的恢复与对照组无明显差别。也就是说,经过1个月的糖足颗粒剂治疗,治疗组大鼠的皮肤和腓肠肌有明显恢复,而遭到破坏的神经则恢复不明显。由于实验条件限制,没有进行大鼠足部血管形态观察。根据实验现象和数据,实验者猜测原因在于:糖足颗粒剂复方通过改善大鼠足部血管功能,使肌肉和神经内因高糖环境导致的血管形态改变[11-12]有所恢复,微血管功能障碍减少,增加肌肉、神经血流和含氧水平,营养肌细胞和神经纤维细胞,在一定程度上改善了肌细胞和神经纤维细胞的功能。
4 参考文献
[1]KOUMOUTSEA D, MEGAS I, ASLANOGLOU D, et al.Specturum of foot problems in patients with diabetes mellitus(DM) type Ⅱbased on our experience[J].European Journal of Internal Medicine,2011,22:S8-S8.
[2]EDMONDS M,WILSON M,FOSTER A.Diabetic foot ulcers [J].Nurs Stand,1999,14(12):39-45.
[3]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013版)[J].中国糖尿病杂志,2014,22(8):2-42.
[4]韩锐.糖足煎剂防治糖尿病高危足的远期疗效评价及机理探讨[D].成都:成都中医药大学,2013.
[5]兰兰,惠延年,曾光伟.血管生成素-1对糖尿病大鼠视网膜微血管病变、基质金属蛋白酶和血管内皮生长因子的抑制作用[J].眼科新进展,2012,32(10):926-930.
[6]周婷,孙侃.STZ诱导糖尿病大鼠模型制备及经验[J].农垦医学,2002,24(5):323-324.
[7]HIROSE K, IWAKURA N,ORITA S, et al.Evaluation of behavior and neuropeptide markers of pain in simple, sciatic nerve-pinch painmodel in rats[J].Eur Spine J,2010,19 (10): 1746-1752.
[8]ZHANG Y,ANDERSON PN,CAMPBELL G,et al.Tenascin-C expression by neurons and glial cells in the rat spinal cord: changes during postnatal development annd after dorsal root or sciatic nerve injury[J].J Neurocytol,1995,24(8):585-601.
[9]沈宁江,朱家恺.坐骨神经功能指数在神经功能评价中的应用[J].中华显微外科杂志,1993,16(4):284-287.
[10]BAIN JR, MACKINNON SE, HUNTER DA.Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat[J].Plast Reconstr Surg,1989,83(1):129-138.
[11]TOMLINSON DR,GARDINER NJ.Glucose neurotoxicity[J].Nat Rev Neurosci,2008,9(1):36-45.
[12]MIZUKAMI H,OGASAWARA S,YAMAGISHI S,et al.Methylcobalamin effects on diabetic neuropathy and nerve protein kinase C in rats[J].Eur J Clin Invest,2011,41(4):442-450.
通信作者:岳仁宋,教授,主任医师,成都中医药大学附属医院,四川省成都市金牛区十二桥路39号,610072,1580229694@qq.com
*基金项目:四川省干保科研课题(H2017033);成都中医药大学附属医院基金(2016-D-YY-01)
