可能切除性胰腺体尾部癌的外科手术治疗研究
2018-07-27李鸿侠尚海涛张西波鲍建亨郝成飞刘军舰李忠廉
李鸿侠,尚海涛,张西波,鲍建亨,郝成飞,刘军舰,李忠廉△
胰腺癌是一种恶性程度极高,预后极差的消化系统肿瘤。近年来,我国此类疾病的发病率增长迅速,死亡率已上升至第4位,且呈现出比较明显的低龄化趋势[1]。90%的胰腺癌是来源于胰腺导管细胞的恶性肿瘤[2]。在结构上60%~80%的胰腺癌发生于胰腺头部,其余平均分布在胰腺体部及尾部。胰腺体尾部癌因位置深在,早期常缺乏特异性症状[3],仅表现为上腹痛、上腹部饱胀不适、食欲不振等。加之肿瘤呈浸润性生长,侵犯周围脏器及大血管,确诊时多已属晚期,大部分患者失去手术切除的机会。但在目前的治疗措施中,只有手术治疗才能使胰腺体尾部癌患者获得较长的生存期,根治性切除患者的平均生存时间显著长于姑息性切除和无法切除的患者[4]。然而胰腺体尾部癌患者的手术切除率仅为10%~30%,5年生存率在10%以下[5]。
美国国家综合癌症网络(national comprehensive cancer network,NCCN)指南将胰腺癌分为可切除、可能切除、不可切除3类。胰腺癌可切除性的判断主要依赖于腹腔主要动脉及静脉的受累状况,可能切除性胰腺癌虽然存在周围血管的侵犯和包绕,但却同时存在通过手术实现R0切除的可能性。为提高手术的R0切除率,对于可能切除性胰腺癌应先行新辅助治疗还是直接手术切除,目前尚缺乏多中心的大宗临床对照观察。对于此类患者,笔者积极探索提高R0切除率的有效手术技术方法,对可能切除性胰腺体尾部癌患者实施了逆行根治性切除手术,并辅以术后规律的吉西他滨化疗,效果显著。现报告如下。
1 资料与方法
1.1 一般资料 2011年1月—2015年2月天津市南开医院肝胆胰第二外科共为11例伴有临近血管侵犯的可能切除性胰腺体尾部癌患者实施了根治性切除手术治疗,女4例,男7例,平均年龄(61.9±8.5)岁,肿瘤长径平均(5.68±0.68)cm。肿瘤的分期根据2017年NCCN发布的胰腺癌临床实践指南中的TNM分期标准,其中1例为临床Ⅳ期,剩余10例均为临床Ⅲ期。
1.2 术前影像学评估 所有患者手术前均行全腹增强CT、CT血管重建及腹部彩超检查,评估肿瘤对周围重要血管,如腹腔干(CA)、肝总动脉(CHA)、肠系膜上动脉(SMA)、肠系膜上静脉(SMV)、门静脉(PV)、肝固有动脉(PHA)、胃十二指肠动脉(GDA)、脾动脉(SA)、脾静脉(SV)及相邻脏器、远隔脏器的侵犯情况,确定肿瘤的可切除性。11例中2例癌肿包裹CA及其分叉处(图1),并致受累血管管腔闭塞,但CA根部完好(图2),1例癌肿在包裹CA及其分叉处的同时合并有GDA受累闭塞。剩余8例中5例侵及CA,3例侵及SMA,上述8例癌肿均只侵及所述血管的血管鞘,累及血管周径<1/2,但受累血管未见狭窄或闭塞情况。全部病例癌肿均侵犯了相邻的SA及SV,致其不同程度狭窄或闭塞。4例患者伴有相邻脏器浸润,1例伴有肝脏单发转移。
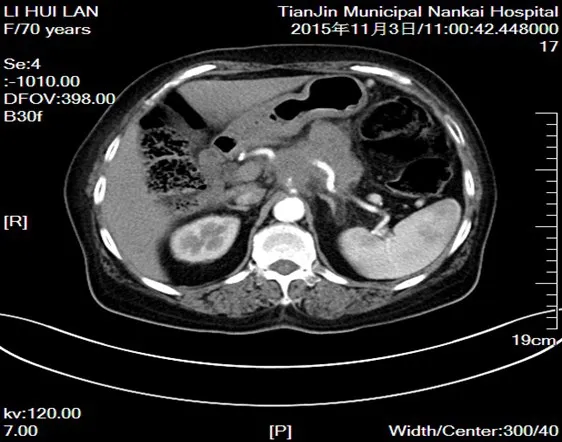
Fig.1 The enhanced CT scanning showing the tumor invasion of celiac axis CA and bifurcation图1 强化CT示肿瘤侵犯腹腔动脉CA及分叉处

Fig.2 Preoperative vascular imaging of the pancreatic head of the gastroduodenal artery and superior mesenteric artery图2 术前血管成像显示胃十二指肠动脉与肠系膜上动脉的胰头部交通支
1.3 手术方法 术者均采取左上腹部肋缘下切口,依据术中探查情况适当向两侧延长切口。传统胰腺体尾部癌切除手术均是首先游离脾脏和胰尾部,自左向右切除癌肿,但手术的切除率较低。对于伴有血管侵犯的胰腺体尾部癌患者于门静脉右侧先横断胰腺,并行断面快速冰冻病理学检查以保证此切缘阴性,于脾静脉汇入门静脉处结扎切断脾静脉,自右向左连同脾脏将癌肿切除,临床上称其为逆行切除。在分离至CA起始部时11例接受手术患者中3例因癌肿完全包绕CA及其分叉处自根部将CA及CHA结扎切断,其中1例在切除了CA及CHA的同时切除了受累的GDA,故其胃部丧失了主要动脉血供,为避免术后胃部缺血坏死同时行全胃切除,1例因GDA与SMA交通支稀疏,亦行了全胃切除并行门静脉部分切除重建(图3),3例均切除胆囊。剩余8例中5例侵及CA,3例侵及SMA,上述8例术中见癌肿均只侵及了所述血管的血管鞘,受累血管未见狭窄或闭塞情况,故术中将血管鞘打开,将癌肿连同受累的血管鞘一并切除。全部病例均切除了胃左动脉(LGA),清扫CA和主动脉周围淋巴结、并切除腹膜后神经丛。将切除标本一并移除。全部病例肿瘤侵及SA、SV,存在不同程度闭塞,均连同受累脾血管常规切除脾脏。1例患者伴有左肝Ⅳb段单发转移,予同时行左肝Ⅳb段切除。2例患者肿瘤侵犯胃后壁,术中1例行胃后壁局部切除,1例因肿瘤范围大,侵透胃后壁并侵及胃近贲门处行全胃切除。1例患者肿瘤同时侵犯胃后壁及结肠脾区,行胃后壁局部切除、结肠脾区切除对端吻合。1例患者肿瘤同时侵犯胃后壁、十二指肠及横结肠,切除病灶同时连同受累部位一并切除并修补。处理胰腺残端时,如主胰管通畅远端无狭窄或梗阻,均以4-0 Prolene线连续缝合胰管断端,如远端存在梗阻或引流不畅予行断端胰管空肠Rous-en-Y吻合。全部病例中除肝转移病例施行了胰管空肠结肠后吻合术外,其余病例均直接缝合胰管断端。
2 结果
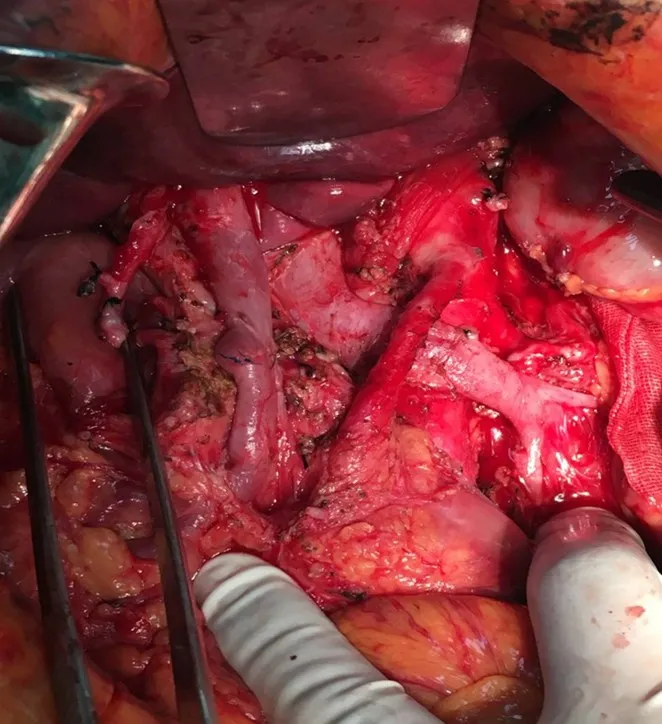
Fig.3 Celiac artery resection,partial resection of the portal vein,total gastrectomy图3 行腹腔动脉切除、门静脉部分切除重建、全胃切除
11例中只有1例患者术后因出现腹腔感染及手术切口感染而延长了住院时间。在切除肿瘤病灶并行腹膜后神经丛清扫后,患者的腹痛症状均消失。全部患者术后未发生明显胰瘘,3例切除CA及CHA的患者术中并未行肝动脉的重建,术后肝功能出现丙氨酸转氨酶(ALT)一过性升高,术后第6天逐渐降至正常水平,未发生肝功能衰竭、术后肝脓肿、腹水等并发症。11例患者术后病理回报均为导管腺癌。1例为R1切除(后腹膜切缘镜下可见癌细胞),10例为R0切除。
术后除2例外地患者未行规律静脉化疗外,另9例患者术后均接受规律的吉西他滨单药静脉化疗,期间每次化疗前均常规检测血常规,每3个疗程后复查血清肿瘤标志物及腹部CT以评估患者治疗状况。11例中位生存期为28(14,36)个月,1例患者术后已生存44个月,复查腹部CT未见明确复发及转移。
伴肝转移患者自出现临床症状到接受手术治疗间隔了近8个月,术中肿瘤包裹CA及其分叉处,施行联合腹腔动脉干切除的胰体尾癌切除术,未行肝动脉重建。肝脏转移灶位于Ⅳb段,予行Ⅳb段切除,并行胰腺断端空肠Roux-en-Y结肠后吻合,此患者手术后肝、胃的血供主要是通过胃十二指肠动脉来源于肠系膜上动脉,未出现明显肝损害及胃部缺血情况。术后病理回报为中高分化腺癌,脾门淋巴结(0/3),14组淋巴结(1/4),16组淋巴结(4/6),7组淋巴结(1/1),患者术后腹痛症状消失,因家处外地术后未行规律化疗,术后生存14个月,死于肝转移。
2例行腹腔动脉干及全胃切除患者均达到R0切除,1例术后规律地接受吉西他滨静脉化疗18个月,术后腹痛症状完全消失,术后共生存27个月,死亡原因为患者出现精神抑郁情况,拒绝进食或静脉输液营养支持进而消耗致全身衰竭。患者死亡时并未有肝转移或消化道梗阻情况,原手术区未见明显复发。1例接受规律化疗22个月,术后生存38个月,死于肝转移。
3 讨论
在恶性消化道肿瘤中胰腺癌预后极差。确诊的胰腺癌患者其1年生存率小于20%,5年生存率小于5%[6]。目前手术仍是治疗胰腺癌的有效方法,接受根治性切除手术的患者5年生存率可以达到15%~20%。由美国癌症协会、瑞士癌症研究基金会赞助的2000—2014年全球癌症生存趋势检测计划第三阶段数据显示,在全部癌症中,胰腺癌依旧是生存率最低的肿瘤,严重威胁人类健康。美国数据显示其5年生存率仅为6%[6]。复旦大学中山医院报道的69例胰体尾根治术后1~3年生存率分别为68.8%、56.1%和34.2%,中位生存期23.6个月[7]。浙江医科大学第一附属医院报道的一组胰体尾癌根治术患者的术后1年、3年及5年生存率分别为33.33%、16.67%和 0[8]。
胰腺体尾部癌手术切除范围一般应包括胰腺体尾部及脾脏,胰腺切缘1 mm内应该镜下未见癌组织,同时清除脾血管、腹主动脉、腹腔干动脉、肝十二指肠韧带及肝总动脉周围的脂肪及淋巴组织[9]。影响胰腺体尾部癌手术切除率的主要因素是肿瘤在腹腔内的转移及周围重要血管受累的情况,胰腺体尾部癌通常侵犯的血管有腹腔干、肝总动脉,同时胰腺体尾部癌可能会与门静脉汇合部、胃(和)或横结肠、十二指肠粘连紧密。有研究显示术前影像学诊断示肿瘤浸润血管壁者,约60%的血管标本其实并未受侵犯,而是肿瘤压迫推挤或周围胰腺组织慢性炎症所致[10]。为了保证手术切缘的阴性,对于伴有血管侵犯的可能切除性胰体尾癌可考虑施行扩大的根治性手术,包括全胰腺切除、门静脉或肠系膜上静脉的切除及重建、受累的肝总动脉及腹腔干血管的切除、联合周边受累脏器的切除。扩大的根治性手术可以提高胰腺体尾部癌患者的肿瘤切除率[11]。Panda等[12]的研究显示接受扩大胰体尾癌根治术的病例术后5年及10年生存率分别可达22%和18%,而行标准性切除的病例分别为9%和8%。本研究在充分术前影像学评估的基础上,采用手术中遵循血管优先的入路策略,一反传统的自脾、胰尾部开始的顺式切除方式,而是先行处理胰腺颈部,首先解决门静脉、肠系膜上静脉汇合部,通过术中冰冻病理学检查确保近侧切缘阴性的基础上切断胰腺,自右向左反向切除癌肿,这一手术技术在临床中可尽可能提高胰腺体尾部癌的R0切除率。为使患者能够获得较长的生存时间,术中尽可能做到根治性切除。一般认为对于可能切除性胰腺颈体部癌能否根治性切除的关键在于肿瘤侵犯CA的程度,确定肿瘤是否可以自受累的CA上完整切除,进而分离CHA和PHA。可能切除性胰腺体尾部癌能否实现R0切除的关键在于PV、SMA和SMV的受累程度,如果癌肿仅侵犯上述血管的血管鞘,可以将血管鞘打开将癌肿连同受累血管鞘一并切除。如脾静脉与门静脉汇合部被肿瘤完全包裹无法分离,可切除部分门静脉并行血管重建,但肠系膜上动脉如被肿瘤侵犯包裹并致血管腔狭窄则癌肿不能被根治性切除。本研究认为腹腔干血管及其分支受累不应作为切除的禁忌证,因其血管受累闭塞后于手术前多已有侧支循环建立或存在来源于肠系膜上动脉的副肝动脉,以及存在肠系膜上动脉-胃十二指肠动脉经胰腺头部的交通支,肝、胃已耐受缺血的情况,故手术时可直接切除受累的腹腔干血管及其分支而不必行肝动脉的重建。但当合并胃十二指肠动脉受累或胰头部血管交通支稀疏不能满足逆向胃部供血时应联合全胃切除。
以往认为当胰体尾肿瘤侵犯CA及其分叉处时,因CA及CHA为肝、胃的主要供血动脉而不能被切除,进而不能根治肿瘤。但现在联合腹腔动脉干切除的胰体尾癌切除术(Appleby手术)被应用于临床,提高了胰体尾癌的手术切除率。这一术式的主要问题为切除腹腔动脉干后肝、胃的血供问题。肝脏动脉血供中断可能引起肝脏供血不足,出现肝功能异常、甚至肝衰竭等相关并发症,同时因胆囊动脉发自肝固有动脉,易出现胆囊炎或胆囊缺血坏死。但临床上部分患者存在变异的肝总动脉或肝动脉分支起源于肠系膜上动脉或腹主动脉,这时即使手术切除腹腔动脉干,也可以保证肝脏的全部或部分动脉血供;此外胃十二指肠动脉发出的胰十二指肠上动脉与肠系膜上动脉发出的胰十二指肠下动脉在胰头区形成十二指肠动脉弓,在肝总动脉与胃十二指肠动脉分叉处及胃十二指肠动脉本身未受肿瘤侵犯的情况下,来自肠系膜上动脉的血流可以通过胰十二指肠上、下动脉的吻合经胃十二指肠动脉到达肝固有动脉,进而保证了肝脏和胃的动脉血供。本研究中的3例切除腹腔动脉干及肝总动脉患者,1例因胃十二指肠动脉受累,1例因术前血管成像显示胰头部交通支稀疏,进而切除了全胃,3例均切除了胆囊,以避免术后发生相关缺血性并发症。但因副肝动脉的存在以及侧支循环已建立的缘故,3例患者均未行肝动脉重建,术后3例患者并未发生肝损害加重的情况,证明切断上述血管后不行肝动脉重建在此类患者中是可行的。
全部患者在术前均存在明显的腹部疼痛症状,但术后患者的腹痛症状全部缓解,这与手术中常规切除了腹腔神经节及腹膜后神经丛有关。腹痛症状的消失极大地改善了患者的后期生存质量,避免了长期服用镇痛药物的痛苦。11例手术患者术后均无明显胰瘘发生,对于近端胰管通畅不存在狭窄或梗阻时以不可吸收的prolene线直接缝合胰管断端是安全可靠的。
所有患者中1例R1切除患者相较R0切除患者也获得了相对更长的生存时间,截止到随访时已生存44个月且仍健在,分析其中原因除个体因素及癌肿生物学因素外,术后坚持吉西他滨的规律化疗也可能发挥了重要的作用。但对于伴有远处脏器转移的可能切除性胰体尾癌患者尽可能施行扩大的根治性手术切除是否可以延长患者的生存时间仍需更多的临床对照研究来证实。本组1例R0切除患者术后未坚持化疗,术后10个月时死于肝转移及局部复发,可能与癌肿的早期神经及淋巴转移有关。本研究认为,对于可能切除性胰体尾癌患者尽可能地施行肠系膜血管优先入路的扩大逆向根治性切除手术并辅助术后化疗可以一定程度上延长患者的生存期,提升患者的生活质量,免于癌痛的困扰。
胰腺体尾部癌由于解剖位置的特殊性及其临床特点,癌肿的根治性手术切除仍是提高患者的生存率并改善生活质量的基本选择。但仅通过手术来改善患者预后及生存期还是不够的,胰腺体尾部癌的早期诊断及围手术期管理并联合手术后的辅助化疗也是延长患者生存时间的必要手段。
