易利用态有机物质对水稻土甲烷排放的激发作用①
2018-07-27邱虎森苏以荣刘杰云葛体达胡亚军陈香碧吴金水张振华
邱虎森,苏以荣,刘杰云,葛体达,2,胡亚军,2,陈香碧,2,吴金水,2,张振华
易利用态有机物质对水稻土甲烷排放的激发作用①
邱虎森1,2,3,苏以荣1,2*,刘杰云1,葛体达1,2,胡亚军1,2,陈香碧1,2,吴金水1,2,张振华4
(1 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,长沙 410125;2 中国科学院长沙农业环境观测研究站,长沙 410125;3 中国科学院大学,北京 100049;4 湖南农业大学南方粮油作物协同创新中心,长沙 410125)
为探讨外源有机物质对淹水稻田土壤CH4排放的激发作用,对比不同外源有机物质对土壤CH4排放的贡献差别,本研究选取3种标记的易利用态有机物(葡萄糖、乙酸和草酸)分别加入水稻土,进行了为期1个月的培养。结果表明:培养30 d后不同处理CH4的累计排放量差异显著(<0.05),其中,乙酸>葡萄糖>草酸>对照;双因素方差分析结果显示,外源有机物质的添加加速了土壤易利用态有机质的矿化(即产生正激发效应);不同处理条件下激发作用产生的CH4分别占各处理CH4总累计排放量的73.3%(葡萄糖处理)、71.5%(乙酸处理)和40.9%(草酸处理),且CH4排放量与CH4激发效应之间极显著正相关关系说明土壤CH4排放主要要来自于土壤原有机质的分解,外源有机物质可能主要对土壤微生物活性及代谢途径有影响。
甲烷;有机质;稳定性同位素;激发效应
甲烷(CH4)是被认为在极端厌氧环境下(氧化还原电位(Eh)值在-150 mV 左右),由土壤中的有机碳分解产生的氢气和二氧化碳及乙酸经产甲烷菌生物作用形成的。CH4的人为排放源很多,如畜牧养殖、工业废气、生活垃圾填埋场、稻田等,其中稻田被认为是CH4重要的排放源,也是过去100多年里大气CH4浓度增加的重要原因之一[1-2]。
为改善土壤肥力,提高水稻产量,大量研究在关注外源有机物对土壤生产力的影响的同时,探讨了外源有机物对土壤CH4排放的影响[3-8],研究结果不尽相同。但一般认为外源有机物的施用一方面为土壤产甲综菌提供了丰富的产甲烷基质,另一方面,淹水条件下外源有机物的分解加速了稻田Eh的下降,为产甲烷菌的快速繁殖提供了适宜的环境条件,从而促进稻田CH4的排放;同时,CH4的排放量与土壤有机质含量、外源有机物的种类、施入量等存在密切关系。有研究认为,对产CH4真正起作用的是土壤易矿化有机碳和水溶性有机碳而不是总有机碳[9]。Bachoon和Jone[10]发现纤维素、葡萄糖和乙酸加入到排放CH4较低的泥炭土和泥灰岩土中能提高CH4排放量,其中纤维素的增幅最大,其次是葡萄糖和乙酸,而产生CH4所需的响应时间则与增幅次序刚好相反。Bridgham和Richardson[11]研究发现,在高度分解并腐殖化的有机质含量高达95% 的泥炭土中产CH4量很低,加入葡萄糖后CH4的产量有所提高,而大量的乙酸却抑制了CH4的形成(由于产甲烷菌对高浓度的乙酸十分敏感,一般田间条件下不可能达到如此高的浓度)。总之,大多研究认为CH4的产生量与土壤中能够被甲烷菌利用的有机质有关。易利用态有机物质(如:葡萄糖低分子量有机酸等)作为土壤有机物质的重要组成部分,主要来源于动植物残体的分解、微生物的代谢、植物根系的分泌和施入土壤中的有机物的转化,可以为土壤微生物提供直接可利用碳源,进而加速土壤有机质的降解,以为产甲烷菌提供更多的有机碳源[12-14],从而形成对土壤CH4排放的激发作用[15-16]。
目前,大部分稻田CH4排放方面的研究主要侧重于施肥、耕作、水分管理以及环境影响因子等对CH4排放特征的影响[17-20],而外源有机质对土壤CH4排放激发作用有待于进一步的定量研究[5,13,21]。本研究利用13C示踪技术,在水稻土淹水条件下通过添加13C标记的易利用态有机物质,定量研究外源有机物质对淹水稻田土壤CH4排放的激发作用,旨在弄清外源有机碳对土壤CH4排放的贡献比例和导致差异的可能性原因,为进一步探索排放机理和寻求减少温室气体排放措施提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试土壤 供试土壤样品采集于湖南省常德市桃源县盘塘镇王家档村,中亚热带北缘的红壤丘陵区稻田(29°15′22.0″ N,111°31′38.1″ E)。样地所处区域属亚热带湿润季风气候,年均气温为16.8 ℃,年均降雨量为1 230 mm,土壤为第四纪红土母质发育的红壤性水稻土,种植模式为单季稻。采用多点采样法采集表层0 ~ 15 cm休闲季土样。样品去除动植物残体及碎石后过2 mm筛充分混合,按照四分法取少量混合样品进行土壤基本指标的测定,结果见表1,其余样品储存于4℃冰箱用于后期培养试验。

表1 供试水稻土基本理化性质
1.1.213C标记易利用态有机物质 将一定量的普通12C葡萄糖、乙酸及草酸溶液分别与对应丰度为99%、所有C原子全部标记的13C-葡萄糖、13C-乙酸和13C-草酸溶液混合(Cambridge Isotope Laboratories,Inc),配制成13C丰度分别为5.10%、4.46% 和6.01% 的葡萄糖、乙酸和草酸溶液。
1.2 方法
1.2.1 试验处理 为模拟农田自然条件,本试验采用开放式培养方式,研究外源有机物质添加对土壤CH4排放的激发作用。将相当于200.0 g烘干土样的鲜土置放于直径5 cm高20 cm且底部密封的PVC管中淹水3 cm,预培养2周,以恢复和稳定土壤中微生物活性和群落组成。整个培养期间土壤始终保持淹水3 cm,PVC管上部放置透明雨棚防止雨水落入。设置4个处理:①对照;②葡萄糖;③乙酸;④草酸,每个处理3个重复。在培养第0天,所有处理先加入相当于5 mg纯N的(NH4)2SO4溶液作为土壤微生生长所需氮源,葡萄糖、乙酸及草酸的加入量为C 100 mg/kg土(以烘干基计)。
1.2.2 试验实施 在外源有机质添加后第0.5、1、2、5、10、15、20及30天,采用静态箱法采集气体。用30 ml气密型注射器采集30 ml气样,并保存在12 ml真空瓶中,每个处理3个重复,利用气相色谱仪(Agilent GC6890,美国)测定CH4含量。CH4检测器为FID,载气为氮气,流速 30 ml/min;氢气为燃气,流速为30 ml/min;空气为助燃气,流速 400 ml/min;测定温度为250 ℃,柱温为55 ℃。CH4的保留时间为1.75 min,标准气体由国家标准物质中心提供。
1.3 数据处理
CH4排放速率计算公式为:
=××/(V×(273+)/273)/(×)(1)
式中:为CH4的排放速率(CH4排放速率单位为μg/(kg·d),以烘干基计);为气相色谱仪测得的浓度值(mg/kg);为CH4的分子质量(g/mol);为培养瓶中气体体积(L);V为标准状态下气体的摩尔体积(22.4 L/mol);为环境温度(℃);为干土重(g);为采样时间间隔(d)。13C-CH4采用稳定性同位素质谱仪(Thermo Scientific MAT 253,USA)测定。
CH4-13C 计算公式:
CH4-13C =(添加有机物处理13C百分比–对照13C百分比)×添加有机物处理CH4-C/100 (2)
CH4激发效应计算公式为:
PE = T-CH4– C-CH4– L-CH4(3)
式中:T-CH4指添加外源有机物处理的CH4总释放量(μg/kg);C-CH4指对照处理的CH4释放量(μg/kg)L- CH4指来源于外源有机物质CH4释放量(μg/kg)。
本研究数据统计分析在Excel 2003和SPSS 12.0软件中进行,其中单因素方差分析用于不同处理间CH4排放速率、累积排放量及激发效应之间的差异分析;双因素方差分析用于解释不同处理及培养时间对CH4排放速率、13C-CH4排放量及激发效应的影响;相关性分析用于激发效应与CH4排放量间的相关性分析,所有作图在Origin 8.5中完成。
2 结果与分析
2.1 不同处理的CH4排放速率及累积排放量
在整个培养期内,不同处理之间CH4排放速率发生了改变(图1A),葡萄糖和乙酸处理的CH4排放速率峰值均出现在培养开始后第2天,并在培养10 d后逐渐趋于平稳;而草酸处理的CH4排放速率在培养开始后的前2 d低于对照,在培养第5天达到峰值并趋于平稳。如图1B所示,培养30 d后易利用态有机物质处理的CH4的累计排放量显著高于对照(>0.05),处理间也存在显著差异(>0.05),由大到小为:乙酸处理>葡萄糖处理>草酸处理。

图1 水稻土不同易利用有机物质处理CH4排放速率及累积排放量的差异
2.2 不同处理的CH4排放激发效应
如图2A所示,与对照相比,外源可利用态有机物质的添加促进了稻田土壤CH4的排放,不同时间段,激发效应强弱表现出不同的变化趋势,仅在培养最初的1 ~ 2 d,乙酸和草酸处理抑制了土壤CH4的排放,但随着培养时间的延长,这种影响由负激发作用转变为正激发作用。培养30 d后,草酸处理对土壤激发作用产生的CH4累积量显著低于其余2种处理(图2B,>0.05),由大到小为:葡萄糖处理>乙酸处理>草酸处理,分别占各处理CH4总累计排放量的73.3%、71.5% 和40.9%;来自于外源碳的CH4排放量分别占各处理CH4总累计排放量的3.3%、11.0% 和0.44%(表2)。

图2 外源可利用态有机物质对水稻土CH4排放的激发作用

表2 培养30 d后不同来源的CH4排放量比例 (%)
注:表中同列不同小写字母表示处理间差异在<0.05水平显著。
2.3 不同因素对CH4排放的影响
双因素方差分析结果表明,培养30 d后,易利用态有机物质的种类、培养时间以及二者的交互作用对CH4排放速率、13C-CH4排放量、激发效应CH4排放量均有极显著影响(表3,<0.01)。相关性分析结果表明不同处理CH4排放量与CH4激发效应产生量之间均存在极显著正相关(图3,<0.01)。
3 讨论
3.1 不同外源有机质处理土壤CH4排放差异
易利用态有机物质是易被土壤微生物分解利用、影响土壤微生物活性和温室气体排放的有机质重要组成部分[22-23]。本研究中,之所以在培养前期CH4的排放量相对较大,主要是由于培养前期各处理外源有机质含量相对较高,促进了土壤微生物的生长和代谢过程,使土壤中产甲烷菌的活性增强,从而刺激了大量CH4的排放。与对照相比,外源易利用态有机物质的添加促进了土壤CH4的排放。有研究认为不同种类有机成分的产甲烷能力明显不同,对有限几种有机物料测定的大小顺序为:葡萄糖>乙酸>根系分泌物>稻草[24]。本研究中不同处理的土壤产甲烷能力强弱为:乙酸>葡萄糖>草酸,该结果可能是由于不同微生物对外源有机质的选择性利用与合成代谢产物会影响土壤微生物群落结构的组成及其活性[13],尤其是改变了对CO2/H2和乙酸盐有特殊喜好的甲烷菌种类(如:专性矿质营养产甲烷菌、甲基营养产甲烷菌等)[1],从而造成不同外源有机质处理下土壤的产CH4能力强弱不同。研究发现,来自于外源碳的CH4排放量分别占各处理CH4总累计排放量的3.3%、11.0% 和0.44%,其原因可能是被甲烷菌利用的底物一般为简单的1C或2C有机化合物,乙酸作为有机物厌氧分解的主要中间产物,可被甲烷菌直接利用,因此,来自于乙酸的CH4累积排放量及前期排放速率均显著高于其他处理。双因素方差分析的结果显示,除易利用态有机物质的种类,培养时间以及二者的交互作用对CH4排放速率也有显著影响,说明土壤中有机物质的转化速度较快,导致在培养过程中不同处理及相同处理不同时间CH4的排放速率存在差异。总之,外源机物质结构和功能基团的不同可能会影响土壤微生物的代谢途径及代谢产物的差异,从而引起产CH4途径的不同,最终导致不同处理间CH4排放存在差异。

表3 培养30 d后不同因素对CH4排放的影响
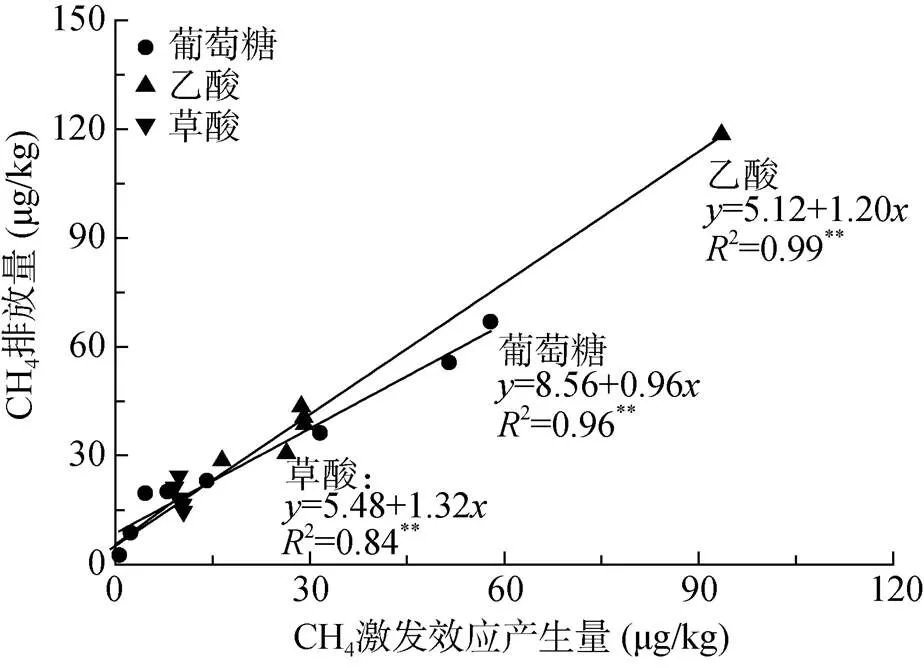
图3 CH4排放量与CH4激发效应产生量之间的关系
3.2 不同外源有机质对土壤CH4排放的激发效应
研究发现仅在培养最初的1 ~ 2 d,乙酸和草酸处理抑制了土壤CH4的排放,这种负激发作用可能与土壤中的电子受体含量有关,由于低分子量有机酸所携带-COOH的强络合作用,所以其一旦进入土壤将很快被土壤吸附,而该吸附行为会影响土壤表面电荷性质和动电性质,进而抑制了土壤CH4的产生[25-26]。培养30 d后不同处理间激发作用产生的CH4累积量为:葡萄糖=乙酸>草酸,且CH4排放量与CH4激发效应产生量之间存在极显著正相关关系,表明外源有机质之所以能促进土壤CH4排放,其主要原因在于对土壤原有有机质的激发作用,外源有机物质可能主要作用于对土壤微生物的影响。土壤易利用态有机质含量的高低影响土壤微生物活性,进而影响温室气体的排放[27]。在易利用态有机质转化过程中,葡萄糖或羧酸类物质会首先储存在所谓的中转碳库[28],然后根据微生物的需要被转化为微生物自身物质或用于维持活性而进行的呼吸作用[29]。而微生物对-CH3和-COOH的利用途径存在差异[30],相比较而言,-CH3更容易被用来合成微生物的原生质,而不同碳原子上-COOH转化亦有差异,在1号位碳原子上的-COOH更易被矿化,2号及3号位碳原子上的-COOH可用于合成微生物自身物质,也可以参与三羧酸循环[31],这种微生物对不同有机质代谢途径的差异可能会引起土壤微生物活性及其对土壤原有有机物质的降解速率和能被产甲烷菌利用的降解产物的差异。因此,易利用态有机物质结构和官能团的不同可能会导致土壤微生物活性及种群结构的改变,最终影响对土壤原有有机质的分解转化速率及甲烷菌对易利用态有机质的利用效率和激发作用的强弱。
4 结论
与对照相比,外源易利用态有机物质的添加促进了土壤CH4的排放。不同培养时间对CH4排放速率、来自于外源有机质的CH4排放量以及激发效应CH4排放量的显著影响说明外源有机质的添加促进了土壤原有有机质的转化速率。外源易利用态有机质能促进土壤CH4排放的主要原因,在于对土壤原有有机质的激发作用,而外源有机物质可能主要作用于对土壤微生物活性及种群结构的影响。因此,合理控制稻田土壤外源有机质输入比例,削弱微生物对土壤原有有机质的降解速度,是控制淹水稻田CH4排放的重要前提。
[1] 丁维新, 蔡祖聪. 土壤有机质和外源有机物对甲烷产生的影响[J]. 生态学报, 2002, 2(10): 1672-1679
[2] 韩广轩, 朱波, 江长胜, 等. 川中丘陵区稻田甲烷排放及其影响因素[J]. 农村生态环境, 2005, 21(1):1-6
[3] 付薇薇, 尹力初, 张蕾, 等. 有机物料碳和土壤有机碳对水稻土甲烷排放的影响[J]. 中国土壤与肥料, 2016(2): 14-20
[4] Cicerone R J, Delwiche C C, Tyler S C, et al.Methane emission from California rice paddies with varied treatments[J]. Global Biogeochemical Cycles, 1992, 6: 233-248
[5] Yuan Q, Pump J, Conrad R. Straw application in paddy soil enhances methane production also from other carbon sources[J]. Biogeosciences, 2014, 11, 237-246
[6] Bao Q L, Huang Y Z, Wang F H, et al. Effect of nitrogen fertilizer and/or rice straw amendment on methanogenic archaeal communities and methane production from a rice paddy soil[J]. Applied Microbiology and Biotechnology, 2016, 100(13): 5989-5998
[7] Kantachote D, Nunkaew T, Kantha T, et al.Biofertilizers from Rhodopseudomonas palustris strains to enhance rice yields and reduce methane emissions[J]. Applied Soil Ecology, 2016, 100: 154-161
[8] 李露, 周自强, 潘晓健, 等.不同时期施用生物炭对稻田N2O和CH4排放的影响[J]. 土壤学报, 2015, 52(4): 839-848
[9] 霍莲杰, 纪雄辉, 吴家梅, 等. 不同外源有机碳对稻田甲烷排放和易氧化有机碳的影响[J]. 农业现代化研究, 2013(4): 496-501
[10] Bachoon D, Jones R D. Potential rates of methanogenesis in sawgrass marshes with peat and marl soils in the everglades[J]. Soil Biology and Biochemistry, 1992, 24(1): 21-27
[11] Bridgham S D, Richardson C J. Mechanisms controlling soil respiration (CO2and CH4) in Southern peatlands[J]. Soil Biology and Biochemistry, 1992, 24(11): 1089-1099
[12] Fumoto T, Kobayashi K, Li C, et al. Revising a process-based biogeochemistry model (DNDC) to simulate methane emission from rice paddy fields under various residue management and fertilizer regimes[J]. Global Change Biology, 2008, 14: 382-402
[13] Ye R Z, Doane T A, Morris J, et al. The effect of rice straw on the priming of soil organic matter and methane production in peat soils[J]. Soil Biology and Biochemistry, 2015, 81: 98-107
[14] 赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展[J]. 土壤, 2016, 48(2): 235-240
[15] Kuzyakov Y. Priming effects: interactions between living and dead organic matter[J]. Soil Biology and Biochemistry, 2010, 42: 1363-1371
[16] Zhu B, Cheng W. Rhizosphere priming effect increases the temperature sensitivity of soil organic matter decomposition[J]. Global Change Biology, 2011, 17: 2172-218
[17] 马静, 徐华, 蔡祖聪. 施肥对稻田甲烷排放的影响[J]. 土壤, 2010, 42(2): 153-163
[18] 王钧美, 张莉, 徐桃元, 等. 不同灌溉稻田产甲烷菌与甲烷产生率的变化规律[J]. 灌溉排水学报, 2014, 33(Z1): 360-363
[19] Wang C, Lai D Y F, Sardans J, et al. Factors Related with CH4and N2O Emissions from a Paddy Field: Clues for Management implications[J]. PLoS ONE, 2017, 12(1): e0169254
[20] 胡越航, 韦梦, 徐建刚, 等. 不同温度下尿素对水稻土甲烷产生及相关古菌群落的影响[J]. 土壤, 2015, 47(6): 1115-1124
[21] Conrad R, Klose M, Yuan Q, et al. Chidthaisong A. Stable carbon isotope fractionation, carbon flux partitioning and priming effects in anoxic soils during methanogenic degradation of straw and soil organic matter[J]. Soil Biology and Biochemistry, 2012, 49: 193-199
[22] Thangarajan R, Bolan N S, Tian G L, et al. Role of organic amendment application on greenhouse gas emission from soil[J]. Science of the Total Environment, 2013, 465: 72-96
[23] 雷海迪, 尹云锋, 刘岩, 等. 杉木凋落物及其生物炭对土壤微生物群落结构的影响[J]. 土壤学报, 2016, 53(3): 790-799
[24] Lu Y, Wassmann R, Neue H U, et al. Methanogenic responses to exogenous substrates in anaerobic rice soils[J]. Soil Biology and Biochemistry, 2000, 32: 1683-1690
[25] 丁永祯, 李志安, 邹碧. 土壤低分子量有机酸及其生态功能[J]. 土壤, 2005, 37(3): 243-250
[26] 刘永红, 马舒威, 岳霞丽, 等. 土壤环境中的小分子有机酸及其环境效应[J]. 华中农业大学学报, 2014, 33(2): 133-138
[27] Wang H, Boutton T W, Xu W H, et al. Quality of fresh organic matter affects priming of soil organic matter and substrate utilization patterns of microbes[J]. Scientific Report, 2015, 5: 10102
[28] Hill P, Farrar J, Jones D L. Decoupling of microbial glucose uptake and mineralization in soil[J]. Soil Biology and Biochemistry, 2008, 40: 616-624
[29] Fischer H, Kuzyakov Y. Sorption, microbial uptake and decomposition of acetate in soil: Transformations revealed by position-specific14C labeling[J]. Soil Biology and Biochemistry, 2010, 42: 186-192
[30] Gunina A, Dippold M A, Glaser B, et al. Fate of low molecular weight organic substances in an arable soil: From microbial uptake to utilisation and stabilization[J]. Soil Biology and Biochemistry, 2014, 77: 304-313
[31] Apostel C, Dippold M, Biryukov M, et al. Biochemistry of hexose and pentose transformations in soil analyzed by position-specific labeling and13C-PLFA[J]. Soil Biology and Biochemistry, 2015, 80: 199-208
Priming Effects of Labile Organic Substances on Methane Emission in Flooded Paddy Soil
QIU Husen1,2,3, SU Yirong1,2*, LIU Jieyun1, GE Tida1,2, HU Yajun1,2, CHEN Xiangbi1,2, WU Jinshui1,2,ZHANG Zhenhua4
(1 Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China; 2 Changsha Research Station for Agricultural & Environmental Monitoring, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China; 3 University of Chinese Academy of Sciences, Beijing 100049, China; 4 Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Hunan Agricultural University, Changsha 410128, China)
In order to clarify the priming effect and contribution of exogenous organic matter on CH4emissions, an incubation experiment was carried out with three13C-labeled organic substances (glucose, acetic acid, and oxalic acid) in a paddy soil for one month. The results showed that cumulative CH4emissions were significantly different among different treatments, in an order of acetic acid > glucose > oxalic acid > control (<0.05). Two-way ANOVA indicated that the decomposition of soil native organic matter was accelerated with the addition of exogenous organic matter (positive priming effect). The percentages of priming effect (PE) CH4from soil were about 73.3% (glucose), 71.5% (acetic acid) and 40.9% (oxalic acid) of total CH4, respectively. Different PEs and the significantly positive correlations between CH4production and PE demonstrated that exogenous organic matter can promote soil CH4emission, mainly because of their PE on original soil organic matter. The major role of exogenous organic matter on soil native organic matter decomposition may be due to their effects on soil microbial activity metabolism.
Methane; Organic matter; Stable isotope; Priming effect
国家自然科学基金项目 (41430860;41471199)和中国科学院战略性先导科技专项项目(XDB15020401)资助。
(yrsu@isa.ac.cn)
邱虎森(1987—),男,河南项城人,博士研究生,主要从事土壤碳循环过程的研究。E-mail: qiuhusen2008@163.com
10.13758/j.cnki.tr.2018.03.014
S154.1
A
