粗茶多糖的膜-纤维素柱色谱分离过程的抗氧化活性研究
2018-07-26杨军国宋振硕王丽丽林清霞
杨军国,宋振硕,陈 键,王丽丽,林清霞,陈 林
(福建省农业科学院茶叶研究所,福建 福安 355015)
茶多糖(Tea Polysaccharides,TPs)系茶叶中具有生物学活性的复合多糖的简称。茶多糖具有多种保健功效,诸如抗氧化、降血糖、降血脂、抗血栓、抗癌、抗辐射、增强机体免疫力等[1-3],其抗氧化和降血糖尤为突出。动物实验体系明确证实,茶多糖机体水平上具有较强的抗氧化活性[4-6]。然而,在以活性氧簇、1,1-二苯基-2-三硝基苯肼(DPPH)等评价指标的体外抗氧化试验,结果不一。粗茶多糖清除自由基活性强于纯茶多糖,纯茶多糖片段清除自由基活性低,乃至不具有清除自由基的活性[7-8];同等粗茶叶多糖水平,在不同提取方法、原料、自由基种类等因素作用下茶叶多糖清除自由基活性表达也不尽相同[9-10]。由此来看,茶多糖提取纯化的过程中生物学活性已经发生了改变,其提取制备过程中的抗氧化活性表达评价尤为必要。
近年来,茶多糖在传统制备方法如酸碱法、热水浸提法、醇沉法的基础上,引入超声波/微波/酶法辅助浸提[11-12]、超临界流体萃取[13]、膜分离技术[14]、吸附树脂技术[15]、柱色谱法[16-17]等新型提取纯化技术,实现了高效、节能和环保。前期本课题组研究表明,采用先65%醇洗+后水提的提取制备方式,可制得≥15%含量的粗茶多糖[18-20]。以该粗茶多糖为原料,经膜分离结合DEAE-纤维素52柱色谱纯化分级茶多糖,对其抗氧化活性表达予以考察评价,以期为茶多糖的纯化过程中生物学活性变化提供参考依据。
1 材料与方法
1.1 材料与设备
清香乌龙茶系福建省农业科学院茶叶研究所自制;粗茶多糖由大闽食品(漳州)有限公司加工制备(多功能提取罐、95%食用乙醇、碟式分离、反渗透膜浓缩、喷雾干燥塔);福林酚:北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH,纯度>97.0%):东京化成工业株式会社;DEAE-纤维素52:北京索莱宝科技有限公司;羟基自由基试剂盒、超氧阴离子试剂盒、总抗氧化能力试剂盒:南京建成生物工程研究所;铁氰化钾:阿拉丁(试剂)上海有限公司;无水乙醇、蒽酮、浓硫酸、葡萄糖等均为分析纯试剂:国药集团上海试剂有限公司;其余均为色谱纯或分析纯试剂。
D99-3型分离层析仪:上海青浦沪西仪器厂;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;BONA-GM-19反渗透分离实验机(10000D和20000D孔径膜):济南博纳生物技术有限公司;Infinite M多功能微孔板检测仪(酶标仪):瑞士Tecan Group Ltd.;ACD-0502-U实验室超纯水系统:重庆颐洋企业发展有限公司;DK-8D型电热恒温水浴槽:上海一恒科学仪器有限公司;DHC-9246A电热恒温鼓风干燥箱:上海精宏实验设备有限公司。
1.2 试验方法
1.2.1 粗茶多糖的制备及其膜-纤维素柱色谱分离 以自制清香乌龙茶为原料,每批次10 kg参考杨军国[20]的方法并结合传统速溶茶浸提工艺,采用先65%醇洗+后水提的制备方式,经醇洗、水提、碟式分离、反渗透膜浓缩、喷雾干燥,制得水提粗茶多糖。称取8.50 g该粗茶多糖,溶于1000 mL超纯水中,反渗透实验分离机于10000D孔径膜、0.1 MPa压力下截留分离,截留液再经20000 D孔径膜分离,收集该透过液1000 mL作为分子量为10000~20000的茶多糖溶液。10000~20000 D的茶多糖溶液上DEAE-纤维素52柱色谱(内径1.0 cm×高度40 cm,1 BV约等于12 mL),水洗后,依次用浓度为0.10、0.35和0.60 mol·L-1的NaCl溶液梯度洗脱,分部收集,每部分收集100 mL。以10000~20000 D的1000 mL茶多糖溶液作为对照CK,100 mL各浓度NaCl洗脱多糖液由低到高依次定义为TPs-1、TPs-2和TPs-3,分别检测其单位体积的理化组分及其抗氧化活性表达。
1.2.2 DPPH自由基清除率测定 参考韦献雅[21]的方法,取不同浓度样品液1.0 mL于试管中,添加无水乙醇至3.0 mL,然后再加入0.1 mmol·L-1的DPPH溶液3.0 mL,总体积为6.0 mL,混匀静置反应30 min,于517 nm波长处比色测定吸光值。其中,对照为相应浓度的1.0 mL的NaCl溶液+2.0 mL无水乙醇与3.0 mL的DPPH溶液静置反应后的吸光度数值。单位体积(mL)DPPH自由基清除率计算公式为:

式中:A对照为未加样品的DPPH自由基吸光度;A样品为加入样品反应后的DPPH自由基吸光度。
1.2.3 还原力检测 取茶多糖样品溶液1.0 mL于试管中,依次加入1.0 mL 超纯水、2.0 mL的0.2 mol·L-1磷酸盐缓冲液(0.2 mol·L-1,pH=6.6)和2.0 mL的1%铁氰化钾溶液,50℃水浴保温反应20 min,快速冷却,加入10%的三氯乙酸溶液2.0 mL终止反应,然后加入0.1 mL的0.1%氯化铁溶液显色,混匀静置反应10 min,于700 nm处检测吸光度值,以相应浓度的NaCl溶液作阴性对照。
1.2.4 羟基抑制能力、抗超氧阴离子和总抗氧化能力测定 采用自由基试剂盒检测,按照自由基测试盒说明书操作。
1.2.5 茶多糖含量的测定 采用蒽酮-硫酸法,以无水葡萄糖作为标准对照。吸取蒽酮试剂8.0 mL于25 mL容量瓶中,分别滴入茶多糖溶液1.0 mL,摇匀后沸水加热3 min,快速冷却,600 nm处比色测定,以相应浓度的NaCl溶液作为阴性对照,依据葡萄糖线性标准回归方程计算溶液中的茶多糖含量。
1.2.6 茶多酚含量的检测 参照国标GB/T 8313-2008中的福林酚法检测不同茶多糖溶液中的茶多酚含量。
1.3 数据分析
采用Origin 7.5和SPSS 19.0软件进行数据分析。试验结果描述为“平均值±标准偏差”,同列数据后不同小写字母表示差异显著(p<0.05),大写字母表示差异极显著(p<0.01)。
2 结果与分析
2.1 不同茶多糖溶液的自由基清除活性变化
2.1.1 DPPH自由基清除率 DPPH自由基稳定,溶于乙醇溶液呈深紫红色,其褪色程度可反映样品对DPPH的清除率,因而广泛应用于各种植物提取物的抗氧化活性评价。本文以自制粗茶多糖为原料,经膜分离和DEAE-纤维素52纯化制得各级茶多糖CK(10000~20000D区间茶多糖)、TPs-1、TPs-2和TPs-3,研究考察了其单位体积内(mL)的DPPH清除活性变化,结果见图1。如图所示,膜分离制得粗茶多糖CK经DEAE-纤维素52分离纯化后,DPPH清除活性极显著降低,不同浓度洗脱制得的分级茶多糖DPPH清除活性亦有所不同,以TPs-2的DPPH清除活性最强,低浓度NaCl溶液洗脱制得的TPs-1活性最弱,分级多糖之间呈显著性差异。综上所述,茶多糖经纤维素柱色谱分级后,DPPH清除活性进一步减弱。
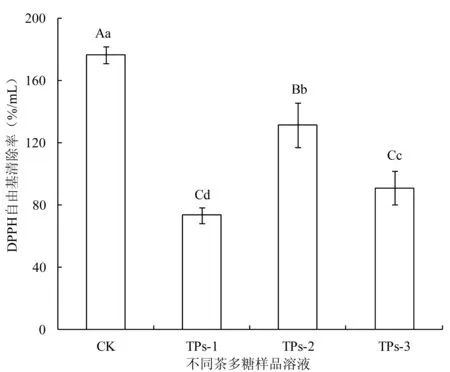
图1 不同茶多糖样品的DPPH自由基清除活性变化Fig.1 DPPH scavenging activities of tea polysaccharide fractions
2.1.2 抑制羟基自由基能力 茶多糖样品的抑制羟自由基能力按照试剂盒说明书操作,其每毫升溶液在37℃下反应1 min使反应体系中H2O2浓度降低1 mmol·L-1为一个抑制羟自由基能力单位。如图2所示,不同茶多糖样品溶液的抑制羟自由基能力变化趋势与DPPH清除活性变化基本相同,膜分离茶多糖(CK)经纤维素柱色谱分级后,抑制羟自由基能力极显著减弱。纤维素柱色谱分级多糖之间比较来看,低浓度NaCl溶液(0.10 mol·L-1和0.35 mol·L-1)洗脱的茶多糖抑制羟自由基能力变化未见差异显著性,TPs-2略高,而高浓度NaCl溶液(0.60 mol·L-1)洗脱得到的茶多糖抑制羟自由基能力极显著降低。

图2 不同茶多糖样品的抑制羟基自由基能力Fig.2 Capacity of tea polysaccharide fractions in inhibiting hydroxyl free radicals
2.1.3 抗超氧阴离子活力变化 不同茶多糖样品溶液的抗超氧阴离子活力变化按照试剂盒说明书操作,在反应体系中,每升溶液在37℃下反应40 min所抑制的超氧阴离子自由基相当于1 mg维生素C所抑制的超氧阴离子自由基的变化值为一个活力单位。结果表明,与膜分离制得的粗茶多糖CK相比,纤维素柱色谱分级后茶多糖抗超氧阴离子活力极显著降低,且由低到高浓度洗脱得到的分级茶多糖抗超氧阴离子活力变化逐渐减弱,分级茶多糖之间呈显著性差异(图3)。由此可见,粗茶多糖由膜分离到纤维素柱层析之间,抗超氧阴离子活力变化与清除DPPH和羟基自由基表达了同样的趋势,呈极显著性减弱。
2.2 不同茶多糖溶液的总抗氧化活性表达
2.2.1 总抗氧化能力变化 采用试剂盒法考察不同茶多糖样品的总抗氧化能力变化,37℃时,每分钟每毫升茶多糖样品溶液使反应体系的吸光度(OD)值每增加0.01时,为一个总抗氧化能力单位。结果表明,粗茶多糖经10000~20000D膜分离和DEAE-纤维素52柱色谱分离纯化后,总抗氧化能力极显著减弱(图4)。纤维素柱色谱分离制得的茶多糖样品TPs-1、TPs-2和TPs-3中,TPs-2总抗氧化能力最强,TPs-1次之,TPs-3最弱,呈显著性降低,与清除自由基活性表达趋势基本一致。
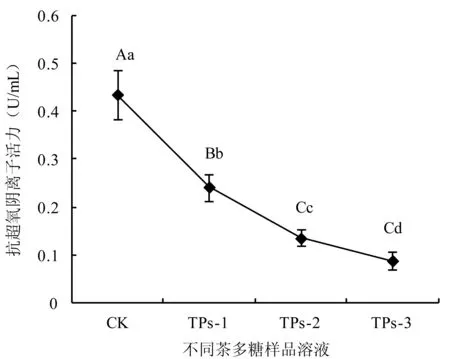
图3 不同茶多糖样品的抗超氧阴离子活力变化Fig.3 Capacity of tea polysaccharide fractions in inhibiting superoxide anion free radicals
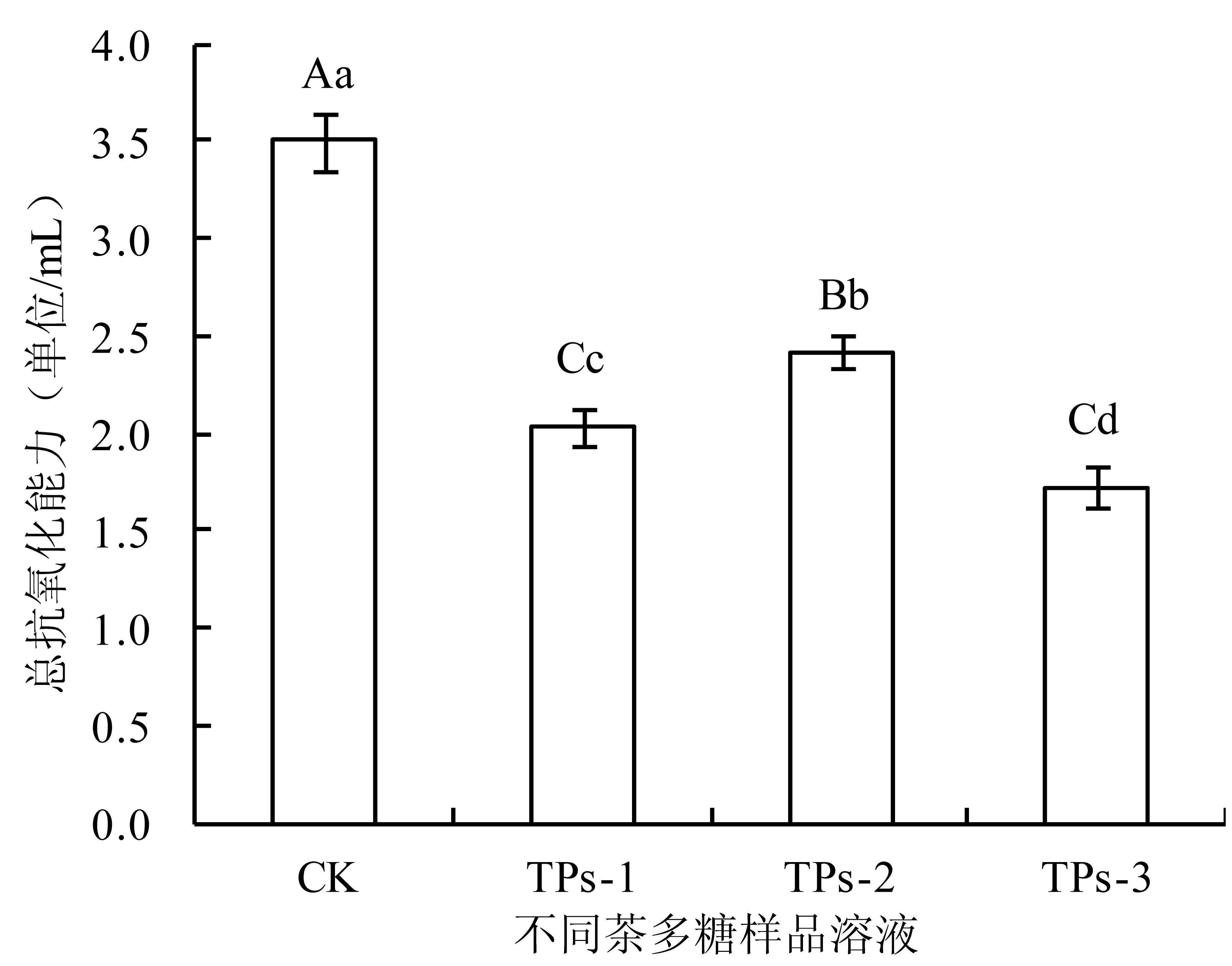
图4 不同茶多糖样品的总抗氧化能力表达Fig.4 Total antioxidative activities of tea polysaccharide fractions
2.2.2 还原力变化 抗氧化剂的还原力变化与其抗氧化活性之间呈正相关性,采用普鲁士蓝法抗氧化剂样品于700 nm处见最大吸收峰,吸光度数值的大小变化可反映其还原力的强弱。图5为分子量10000~20000 D茶多糖(CK)及其相应的DEAE-纤维素52柱色谱分级茶多糖TPs-1、TPs-2和TPs-3的还原力吸光度数值变化,结果可知,纤维素柱色谱分级茶多糖的吸光度值极显著性降低,表明还原力极显著减弱,比较来看,TPs-2还原力最强,TPs-1和TPs-3较弱。与总抗氧化能力(试剂盒法)表达趋势略有差异,TPs-1和TPs-3之间并未见显著性差异。

图5 不同茶多糖样品的还原力变化Fig.5 Reducing powder of tea polysaccharide fractions
2.3 不同茶多糖溶液的组成成分含量
茶多糖样品的抗氧化活性表达可归因于茶多酚、茶多糖等抗氧化活性成分,本文研究分析了不同茶多糖样品中茶多酚和茶多糖的含量变化,结果见图6。结果表明,从DEAE-纤维素52吸附分离效果来看,以0.35 mol·L-1的NaCl溶液洗脱得到的TPs-2中茶多糖浓度最高,TPs-1次之,TPs-3最低,而TPs-1、TPs-2和TPs-3中茶多酚含量基本未见差异显著性变化。膜分离多糖CK尚含有较深的色素,可通过DEAE-纤维素实现脱色。比较发现,膜分离多糖CK及其相应纤维素分离多糖TPs-1、TPs-2和TPs-3的茶多糖/茶多酚(浓度值之比)比值分别为4.91、12.34、14.97和8.15,表明茶多糖通过纤维素柱色谱后进一步富集。分级茶多糖样品的抗氧化活性表达与茶多糖和茶多酚密切相关。相关性分析结果表明(表1),总抗氧化能力与茶多糖和茶多酚呈显著性正相关,茶多糖的相关性略高于茶多酚。就清除自由基能力来说,茶多糖和茶多酚与其清除活性变化呈正相关,其中茶多糖与抑制羟基能力呈显著性正相关。总体来看,随着茶多糖的进一步分级纯化,茶多糖含量变高,抗氧化活性变弱,且自由基种类不同清除活性亦有所不同。
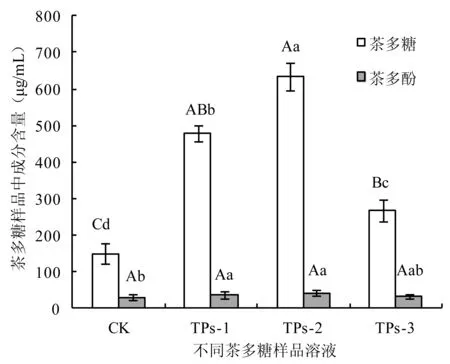
图6 不同茶多糖样品的成分含量Fig.6 Chemical compositions of tea polysaccharide fractions

表1 茶多糖样品成分与抗氧化活性表达的相关性分析
注:*表示差异显著(p<0.05)。
3 讨论与结论
氧化应激与多种疾病的发生发展密切相关,茶多糖的抗氧化活性研究具有重要的生物学意义。茶多糖的体外清除自由基试验,具有不同的作用效果。有研究表明粗茶多糖对羟基和超氧阴离子自由基具有明显的清除作用,高纯度茶多糖则对该类自由基清除能力非常低,几乎没有抗氧化能力[7-8]。本文结果表明,粗茶多糖经膜-纤维素柱色谱分级后抗氧化能力极显著减弱,清除自由基效果变差,这与学者[7-8]给出的结论基本一致。前期本课题组研究表明,醇沉分级粗茶多糖的抗氧化活性表达源于含有的抗氧化组分,呈显著性正相关的抗氧化组分为茶多酚,尤其是儿茶素类单体EC和EGCG,茶多糖的抗氧化作用效果弱于茶多酚[22-23]。随着粗茶多糖的分级纯化,茶多酚含量的降低,茶多糖的抗氧化活性表达与茶多糖含量变化呈显著性正相关(表1),茶多糖本身转变为抗氧化活性表达的主要影响因素。
自由基种类是茶多糖抗氧化活性表达的一个重要影响因素。苗爱清等[24]也研究比较了超声波辅助法与传统常规法绿茶提取多糖的抗氧化活性变化,结果表明超声波辅助法提取的绿茶多糖DPPH自由基清除能力略有提高,ABTS自由基清除活性差异不大,而亚铁离子络合能力降低,分析认为超声波辅助法提取改变了茶叶多糖的结构与生物学活性。张丽美等[25]研究发现,超声波辅助法提取的茶籽多糖对羟基及DPPH自由基具有较高的清除活性,却几乎没有还原能力。李星科[26]等研究表明,与热水浸提法相比,超声波辅助提取的信阳红茶多糖对DPPH自由基和羟基自由基的清除活性明显降低,而对超氧阴离子自由基清除率差异不大。由此来看,不同加工方法和自由基种类作用下茶多糖的自由基活性表达也不尽相同。本文研究结果也表明,纤维素柱色谱分级茶多糖TPs-2、TPs-1和TPs-3对DPPH自由基、羟基和超氧阴离子的清除表达趋势也并不相同,DPPH清除率TPs-2>TPs-3>TPs-1,抑制羟基能力TPs-2>TPs-1>TPs-3,抗超氧阴离子活力TPs-1>TPs-2>TPs-3,不同的自由基种类茶多糖展现了不同的作用效果。相关性分析进一步表明,茶多糖与抑制羟基能力呈显著性正相关,而与DPPH清除率及抗超氧阴离子活力并未有差异相关性。茶多糖糖链庞大,构象十分繁杂,其高级结构对生物学活性的影响最大,不同加工方法可以改变茶多糖的生物学活性,其结构亦必然发生了变化。因此,茶多糖的制备-结构-活性的一体系研究应作为今后工作开展的进一步方向。
综上所述,粗茶多糖经膜分离-纤维素柱色谱法分级后茶多糖进一步富集,抗氧化活性显著性减弱,随着茶多酚含量的降低,茶多糖含量成为影响其抗氧化活性表达的主要因素;另外一方面,自由基种类也是影响茶多糖抗氧化活性表达的重要影响因素,不同自由基种类作用效果不尽相同,自由基种类对茶多糖抗氧化活性表达的介导行为也应成为今后工作的重点。
