低温对不同基因型‘白鸡冠’F1代叶绿素荧光的影响
2018-07-26林郑和钟秋生游小妹陈志辉陈常颂单睿阳阮其春
林郑和,钟秋生,游小妹,陈志辉,陈常颂,单睿阳,阮其春
(福建省农业科学院茶叶研究所,福建 福安 355015)
茶树原产于热带及亚热带地区[1-2],喜温畏寒,对低温比较敏感。近几年全球气温变化不稳定,而且茶叶消费区域不断扩大,茶园种植面积不断增多[3],种植纬度北移。低温冻害在我国茶树栽培中易发常见,在南方地区(如广东、福建、浙江等地)特别是倒春寒对茶叶的生产及其经济效益影响巨大。由于茶树为多年生木本植物,选育一个良种周期较长,主要是新种质创制、早期的鉴定与开发利用速度缓慢,以致新品种培育工作滞后。以往茶树抗寒性的鉴定通常通过生化指标的测定[3-4],但步骤比较繁琐。植物叶绿素荧光动力学技术是近年来新兴的检测植物光合作用生理状况的技术,具有快速、简便、准确的特点,在植物抗冷性、抗冻性方面也显示出良好的应用前景,已经在花旗松[5]、玉米[6-7]、长豇豆[8]、水稻[9-10]等作物上得到应用。
典型的快速叶绿素荧光诱导动力学曲线呈现O、J、I、P相[11]。有研究表明,叶绿素荧光诱导动力学曲线是反映光合电子传递灵敏指标及子传递的还原[12-13]。研究表明,OJ相反映了PSII受体侧的还原[11,13];JI相反映了PQ库的还原[11,14];IP相反映了PSI受体侧还原的部分,被认为是PSII受体侧还原最后的限制速度的一步,其幅度可做为PSI含量的粗略指标[15]。植物逆境下(低温胁迫)叶片光合速率下降,并引起光能过剩,甚至导致光抑制的发生及光合机构被破坏[15-16]。低温敏感型番茄叶片在低温下显著影响PSⅡ反应中心和电子传递,显著降低了PSⅡ的活性,而对耐低温野生番茄PSⅡ活性影响较小[17]。广玉兰[18]、小麦[19]等植物在低温下也得出了类似的结果。低温下冷敏感品种的西瓜[22]、水稻[23]反应中心、天线系统、光合机构受到伤害较耐冷品种严重,然而也有人研究发现[22],低温下各不结球白菜品系光化学效率的差异与电子传递的有效性是各品系抗冷性能差异的主要原因之一。Perks等[5]用叶绿素荧光技术检测花旗松的冻害情况时,Fv/Fm变化与针叶的伤害和存活率呈线性关系。也有人认为,叶绿素荧光动力学参数Fv/Fm与电解质渗透率呈负相关,这也可作为鉴定植物抗寒性强弱的另一个指标[11,15]。
‘白鸡冠’为武夷山四大名丛之一,其F1代芽叶奇特,叶色淡绿,叶质较脆,绿中带白,茶叶颜色与众不同,但抗寒性较差。有鉴于此,本文利用叶绿素荧光诱导动力学参数对白鸡冠的F1代新品系进行抗寒性筛选鉴定,为茶树抗寒育种的早期鉴定提供依据。
1 材料与方法
1.1 试验材料
试验于2015~2016年在福建农林大学资环学院实验室完成。试验选用5个白鸡冠杂交创新种质F1代0306F、0306I、0309B、0306C、0306D及黄棪(抗寒、抗旱都较强),每品种(系)选取生长高度、长势一致,无病虫害的扦插苗(10月龄)。
1.2 低温胁迫方法
将植株叶片用去离子水冲洗、擦净后,用聚乙烯保鲜膜包裹。将每个品种(系)分为2组,放入智能人工气候箱(宁波海曙赛福实验仪器厂)中,一组放置在正常温度(28℃)下生长,另一组进行低温(0℃)胁迫处理,两组光照强度和光照时间都相同,分别为300 μmol·m-2·s-1和12 h·d-1。
1.3 叶绿素荧光参数的测定
用英国生产的连续激发式叶绿素荧光仪(Hansatech Handy PEA Hansatech Instruments Limited,Norfolk,UK)。OJIP曲线是由3400 μmol·m-2·s-1的红光诱导的,红光由3个发光二极管提供(峰值650 nm),光线集中在叶表均匀地照射在暴露的叶面(4 mm直径)上。在开始的300 μs,每10 μs读取数据一次。随着荧光动力学信号变慢,数据读取的时间间隔变长。所有测定都在室温下进行,植株暗适应3 h后进行测定。每处理6个重复(每个枝条1个叶片为1个重复),取平均值。

表1 叶绿素荧光(OJIP)参数及公式
(续表1)

荧光参数表示Sm=ECo/RC=Area/(Fm-Fo)电子受体全部还原所需要的能量φPo=TRo/ABS=1-Fo/Fm=Fv/Fm最大量子产量(最大光化学效率)φEo=ETo/ABS=Fv/Fm×(1-VJ)电子传递的量子产额ψEo=ETo/TRo=1-VJ将电子传递到电子传递链中超过QA其它电子受体的概率φDo=DIo/ABS=1-φPo=Fo/Fm用于热耗散的量子比率δRo=REo/ETo=(1-VI)/(1-VJ)电子从还原系统传递到PSI电子受体侧的效率φRo=REo/ABS=φPo×ψEo×δRoABS/RCPS I末端受体还原的量子产额TRo/RC单位反应中心吸收的光能Fraction of OEC用于还原QA的能量Maximum amplitude of IP phas放氧复合体IP相增加的最大幅度ETo/RC=(Mo/VJ)×ψEo=(Mo/VJ)×(1-VJ)反应中心用于电子传递的能量DIo/RC=ABS/RC-TRo/RC单位反应中心耗散的能量ETo/CSo=ABS/CSo×φEo单位面积电子传递的量子产额TRo/CSo=ABS/CSo×φPo单位面积捕获的光能DIo/CSo=ABS/CSo-TRo/CSo单位面积的热耗散REo/CSo=(REo/ETo)×(ETo/CSo)单位面积PSI电子受体侧的电子还原产额RC/CSo=φPo×(ABS/CSo)×(VJ/Mo)单位面积反应中心数量PIabs=(RC/ABS)×[φPo/(1-φPo)]×[ψo/(1-ψo)]PSI电子受体侧末端传递的电子数PItot,abs=(RC/ABS)×[φPo/(1-φPo)]×[ψEo/(1-ψEo)]×[δRo/(1-δRo)]总的性能指数
1.4 数据处理分析
采用excel 2003和DPS V6.55版软件分析试验数据,利用LSD多重比较法进行差异显著性分析。
2 结果与分析
2.1 低温胁迫下新品系OJIP曲线的变化
所有OJIP曲线均呈现典型的多相升起,包含O-J-I-P点。低温胁迫处理下所有品系的叶片OJIP曲线O点都显著上升,在P点显著下降(图1A,B),并且低温对白鸡冠F1代新品系O-J-I-P曲线影响差异较大,其中品系0306D的O点最大(图1B),0306I的O点最低;而品系0306F的P点最低,黄棪最高,其它的介于其中。
2.2 低温胁迫下新品系相对可变荧光曲线的变化
图2A、B、C显示了任一时间相对可变荧光变量的OJIP曲线及6个低温处理的新品系(种)与正常处理的OJIP曲线之差(ΔVt)。从差异动力学曲线(图2C)可见:新品系的0306F、0306D的ΔVt曲线变化尤为明显,变化差异幅度高于其它品种(系)大。其中来自新品系0306I的ΔVt曲线变化幅度最小(图2C)。

图1 低温胁迫下新品系OJIP曲线的变化Fig.1 Effect of low temperature on average transient chlorophyll a fluorescence(OJIP) of hybrid lines

图2 低温胁迫下新品系相对可变荧光曲线的变化Fig.2 Expressions of relative variable fluorescence of Fo (A) and Fm(B): Vt=(Ft-Fo)/(Fm-Fo) and ΔVt(C) on 6replicated low-temp treatment samples and ambient temperature reference
2.3 低温胁迫下新品系Fo和F300μs之间相对可变荧光曲线的变化
图3显示了Fo和F300μs之间相对可变荧光变量(WK)的动力学曲线及6个低温处理的新品系(品种)与对照处理(常温处理)的动力学曲线之差(ΔWK),从差异动力学曲线可见,新品系0306F与0306D的ΔWK的动力学曲线变化明显高于其它的品系(种)和黄棪。其中黄棪与0309B变化最为不明显(图3C)。

图3 低温胁迫下新品系Fo和F300μs之间相对可变荧光曲线Fig.3 Expressions of relative variable fluorescence of Fo(A) and F300 μs(B): WK=(Ft-Fo)/(F300μs-Fo) and ΔWK(C) on 6replicated low-temp treatment samples and ambient temperature reference
2.4 低温胁迫下白鸡冠F1代新品系ΔFv与Rfd曲线的变化
图4显示的是可变荧光的衰减能力ΔFv(Fm-Ft)与可变荧光下降比率Rfd(ΔFv/Ft)的曲线图。从图4可看出,低温下新品系0306F的ΔFv曲线值最低,0306D次之,而黄棪的ΔFv曲线值最大(图4A);而Rfd的曲线也是0306F的最低,0306D次之,而黄棪的Rfd曲线值最大(图4B)。

图4 低温胁迫下新品系ΔFv与Rfd曲线的变化Fig.4 Effect of low temperature on average transient Fv and Rfd:ΔFv=(Fm-Ft) (A) and Rfd=ΔFv/Ft(B)
2.5 低温胁迫下新品系稳态荧光参数的变化
图5显示的是Fo为初始荧光,Fm为最大荧光产量,VI与VJ为I与J点的相对可变荧光。从图5可看出,低温胁迫下6个品系(种)的Fo、VI都显著增加(图5 A、D),而Fm、VJ显著下降(图5B、C)。从图5A看出,低温胁迫下Fo以0306D最大,0306I最低(图5A);Fm以0306C、0306F最低,黄棪最高(图5B)。从图6 D看出,低温下VI以0306D、0306F最大。
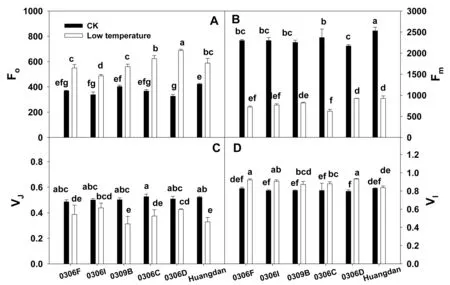
图5 低温胁迫下新品系稳态荧光参数变化Fig.5 Effect of low temperature on steady state fluorescence parameter of F1 hybrids注:每一点为6次重复的平均值±标准误,同一点标准误上(下)字母不同者差异显著(P<0.05)。下同。
2.6 低温胁迫下新品系叶片单位横截面的活性参数变化
从图6可看出,低温下各品系除单位面积吸收光能ABS/CSo显著增加外,其余比活性参数为:单位面积PSI电子受体侧的电子还原产额(REo/CSo)、单位面积反应中心数量(RC/CSo)、单位面积电子传递的量子产额(ETo/CSo)、单位面积捕获的光能(TRo/CSo)、PSI电子受体侧末端传递的电子数(PItot,ABS)都显著下降。其中低温下来自新品系0306D的ABS/CSo最大(图6 A),0306F、0306D的REo/CSo、PItot,ABS最小(图6B、F),0306F的单位面积捕获的光能(TRo/CSo)、单位面积电子传递的量子产额(ETo/CSo)最小(图6D、E)。

图6 低温胁迫下新品系叶片单位横截面的活性参数变化Fig.6 Effect of low temperature on phenomenological fluxes or activities expressed per excited cross section
2.7 低温胁迫下新品系叶片单位单位PSⅡ反应中心的活性变化
从图7可看出,低温下各品系除单位反应中心吸收的光能(ABS/RC)外,其余参数反应中心用于电子传递的能量(ETo/RC)、用于还原QA的能量(TRo/RC)、IP相最大幅度(IP phase)都下降。其中低温下0306D、0306F的ABS/RC(图7A)显著高于其它品系,0306F的TRo/RC、ETo/RC(图7B、C)值最低,0306D、0306F的IP phase(IP相最大幅度)(图7D)也最低。
2.8 低温胁迫下新品系叶片单位面积热耗散参数变化
从图8可看出,低温下各品系热耗散参数:单位面积的热耗散(DIo/CSo)、单位反应中心耗散的能量(DIo/RC)、用于热耗散的量子产额比率(DIo/ABS)都显著增加。其中低温下0306D、0306F的DIo/CSo、DIo/ABS、DIo/RC(图8A、B、C)都显著大于其它品系,0306I的DIo/CSo、DIo/ABS、DIo/RC(图8A、B、C)都显著低于其它品系。ETo/TRo为电子传递链中超过QA的其它电子受体的概率,图8D显示低温下来自黄棪与0309B的ETo/TRo最大。
2.9 低温胁迫下新品系叶片量子产额或者分配比例的变化
从图 9可看出,低温下各品系的电子传递的量子产额(ETo/ABS)、PS I末端受体还原的量子产额(REo/ABS)、标准化后OJIP曲线和F=Fm 间的面积或者总的电子载体(Sm)、最大光化学效率(Fv/Fm)、电子从还原系统传递到PS I电子受体侧的效率(REo/ETo)的值都显著下降,其中低温下来自0306F、0306D的ETo/ABS、REo/ABS、Sm、Fv/Fm的值最低(图9A、B、C、D、F)。低温下放氧复合体(OEC)参数以0306F、0306D为最大(图9D)。
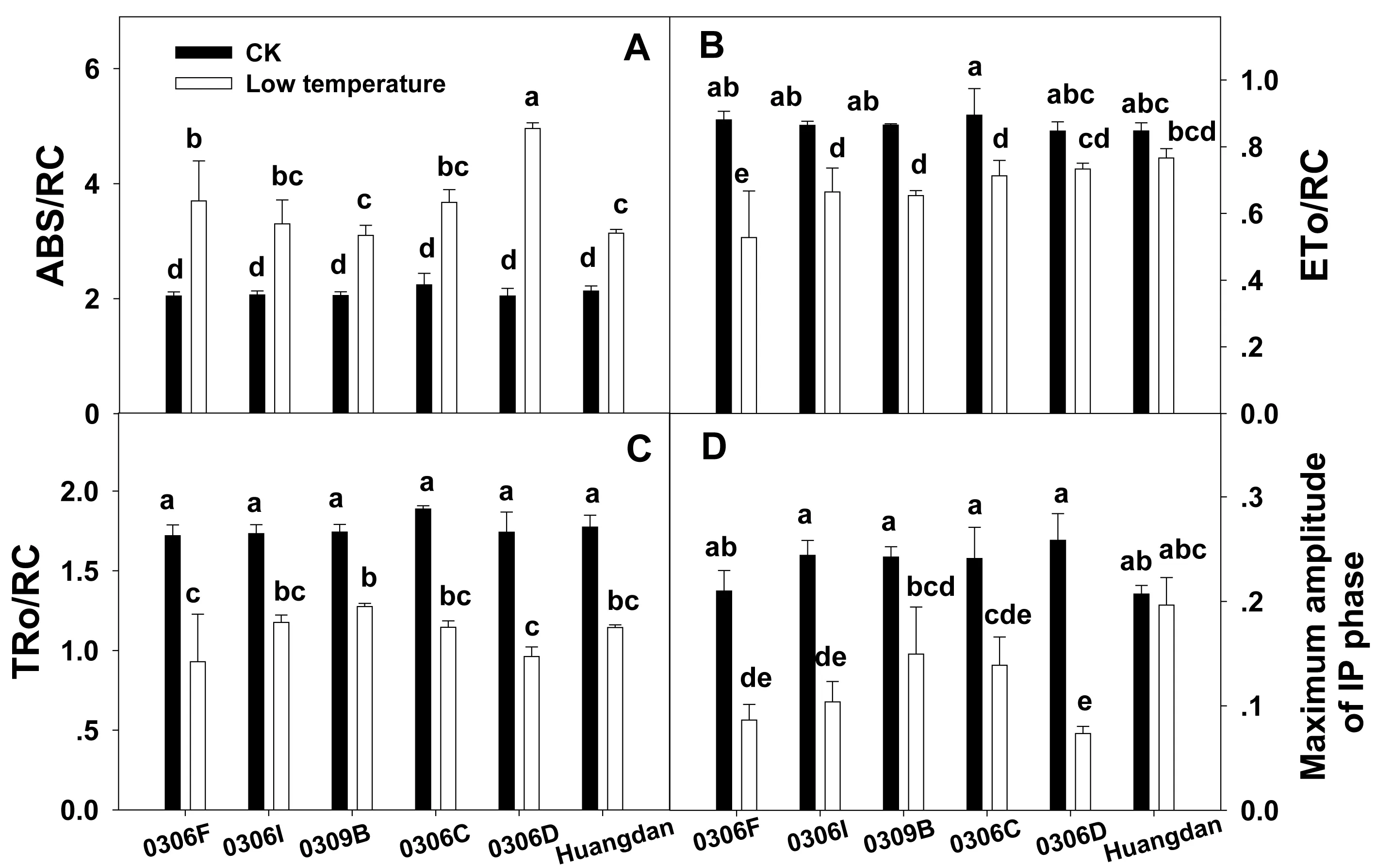
图7 低温胁迫下新品系叶片单位PSⅡ反应中心的活性变化Fig.7 Effect of low temperature on specific fluxes or activities expressed per reaction center (RC)

图8 低温胁迫下新品系叶片单位面积热耗散参数变化Fig.8 Effect of low temperature on energy dissipation
3 讨论
目前鉴定植物耐寒性的方法较多,其中应用较多、较为准确的是生理生化数据分析。但是该方法样品筛选耗时长,所以评价低温对植物的影响仍是较为繁琐的。叶绿素荧光诱导动力学是利用植物逆境下所发出的具有丰富光合作用信息荧光信号,来判定其其叶片PS II受损伤程度,不具有破坏性,因此成为植物逆境(抗寒性)筛选与鉴定的有效方法之一[23-24]。已经在花旗松[5]、玉米[6-7]、长豇豆[8]、水稻[9]、小麦[19]、西瓜[20]等作物上得到应用。
植物在正常生长的环境下,叶片所发射的荧光大部分来自PS II中的叶绿素a,叶绿素吸收的光能主要有进行光合作用、荧光形式发射耗散以及转变成热能散失等作用[25-26],而这三者之间存在此消彼长的竞争关系。本研究结果表明,低温下新品系0306D的Fo增加最大(图5A),可能是0306D叶片的PS II反应中心出现更为严重失活或不易逆转的破坏,也可能是叶片类囊体膜受到更为严重的损伤。这与茶树越低浓度钾处理[27]、越低浓度的磷处理[26]时Fo增加越大的结果相一致。本研究还表明,低温下ΔFv、Rfd以来自0306F、0306D较其它品系低(图4A、B),说明可能是0306F、0306D的光合器官受伤害程度较其它品系大。Fv/Fm是PSII反应中心的最大光能转换效率,是植物抗寒性的主要敏感指标,其值越低可能是光抑制及PSⅡ损害越大。本研究还发现,低温下Fv/Fm来自0306D、0306F较其它品系低,说明可能是0306D、0306F的PS II损害较大。Fv/Fm值降低的程度与该品种的抗冷性之间呈现较好的相关性[29],已经用于玉米[6]、花旗松[5]、长豇豆[8]等许多种植物的抗寒性鉴定中。

图9 低温胁迫下新品系叶片量子产额或者分配比例的变化Fig.9 Effect of low temperature on yields or flux ratios and derived parameters
典型的快速叶绿素荧光诱导动力学曲线呈现O、J、I、P相[10],叶绿素荧光诱导动力学曲线的J点、I点和IP相分别与QA、质体醌及PS I电子受体侧末端接受体的还原状态有关[12]。本试验发现低温下来自0306D曲线的O点增加最大(图1 B),来自0306F的P点最低(图1B),来自0306D、0306F的IP相最大幅度下降最大(图7 D),意味着PS II的受体侧变得更还原,而PSⅠ的受体侧变得更氧化。本试验还发现低温下来自0306F、0306D的相对可变荧光变量(ΔVK、ΔWK)变化幅度较其它品系大(图2 C,图3 C),拐点较为明显。这在缺氮豇豆[10]、缺磷茶树[28]、缺钾茶树[27]上也有相类似的报道。
Sm、φEo、ψo等参数主要反应了PSⅡ受体侧的变化,大豆低温胁迫下导致φEo、ψo下降[30]。本试验发现低温下0306F、0306D的Sm较其它品系高(图9C),而φEo(图9A)、ψo(图8D)明显低于其它品系。说明0306F、0306D品系最大光化学效率(φPo)下降较大(图9D),同时,PSⅡ受体侧的电子传递体(Sm)减少最多(图9C),从而导致捕获的光能把电子传递到电子传递链中超过QA-的电子受体概率(φEo),对QA-的累积更多。低温比较敏感品种,电子受体的概率(φEo)的下降更多,使得更多的光能用来还原QA。
本试验还表明,低温下0306F、0306D反应中心比活性参数REo/CSo(图6B)下降较其它品系大、单位反应中心吸收的光能ABS/RC(图7A)增加的较其它品系大,单位面积热耗散DIo/CSo、DIo/RC、DIo/ABS(图8A、B、C)显著增加,较其它品系大。说明茶树各品系低温胁迫后都启动了相应的防御机制,其中品系0306F、0306D叶片中更多的过剩激发能得以及时耗散,用来还原QA的激发能(TRo/RC),从而更好的消耗掉叶片中过剩的激发能。此外,植物吸收过剩的光能也可能引起1O2和还原性活性氧的产生,对植物细胞结构和光合器产生伤害[31-32]。实际上已有研究表明,发生在PSII供体侧和受体侧的光抑制伤害可增加活性氧的产生[33]。性能指数PItot,ABS反映植物光合机构的状态[34],本研究表明,低温下0306F、0306D的PItot,ABS下降最大(图6F),说明光合机构受到严重的影响。
总之,研究表明,白鸡冠F1代新品系0306F、0306D对低温更为敏感。低温使得0306F、0306D的PSII损伤较其它品系严重,导致整个电子传递链严重受阻,还通过增强能耗散以保护光合器和细胞结构产生伤害。
