乳腺癌骨髓转移的临床特征和预后分析△
2018-07-26车轶群王迪沈迪罗扬
车轶群,王迪,沈迪,罗扬
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院1检验科,2内科,北京100021
中国乳腺癌的发病率呈逐年上升趋势,2015年中国恶性肿瘤的统计数据显示,乳腺癌居中国女性恶性肿瘤发病率的第1位,病死率居第6位[1]。乳腺癌可以转移到身体的任何部位,最常见的转移部位包括骨、肺、区域淋巴结、肝、脑等,而骨髓转移的相关报道有限[2]。实际上,临床上骨髓转移并不少见,尤其是在肺癌、乳腺癌和前列腺癌等骨转移发生率较高的人群中,但是由于骨髓转移的早期不会有明显的症状和体征改变,容易被临床医师忽视,而当骨髓转移发展到抑制造血干细胞功能的时候,患者通常伴有进行性贫血、血小板(platelet,PLT)减少和凝血功能异常,严重影响患者的治疗和预后[3],因此,骨髓转移的早期发现和治疗是非常重要的。本研究回顾性分析23例乳腺癌骨髓转移患者的临床资料,总结其临床表现、相关治疗和预后影响因素,探讨骨髓转移患者的临床特征和治疗策略。
1 资料与方法
1.1 一般资料
回顾性分析2006—2016年于中国医学科学院肿瘤医院检查骨髓涂片并诊断为骨髓转移癌的124例患者的临床资料,其中99例(79.8%)检出原发肿瘤,25例(20.2%)原发病灶不明。原发肿瘤依次为小细胞肺癌26例、乳腺癌23例、非小细胞肺癌21例、胃癌9例和其他主要实体肿瘤20例。23例乳腺癌骨髓转移患者均有乳腺原发病灶的病理组织学检查结果,骨髓转移均经骨髓穿刺细胞学检查证实,分别由两名骨髓细胞形态学医师进行阅片。23例乳腺癌骨髓转移患者的年龄为27~70岁,中位年龄为55岁;初诊至骨转移的时间为0~9.01年,中位时间为2.67年;骨转移至骨髓转移的时间为0~5.50年,中位时间为0.21年;其他临床特征详见表1。
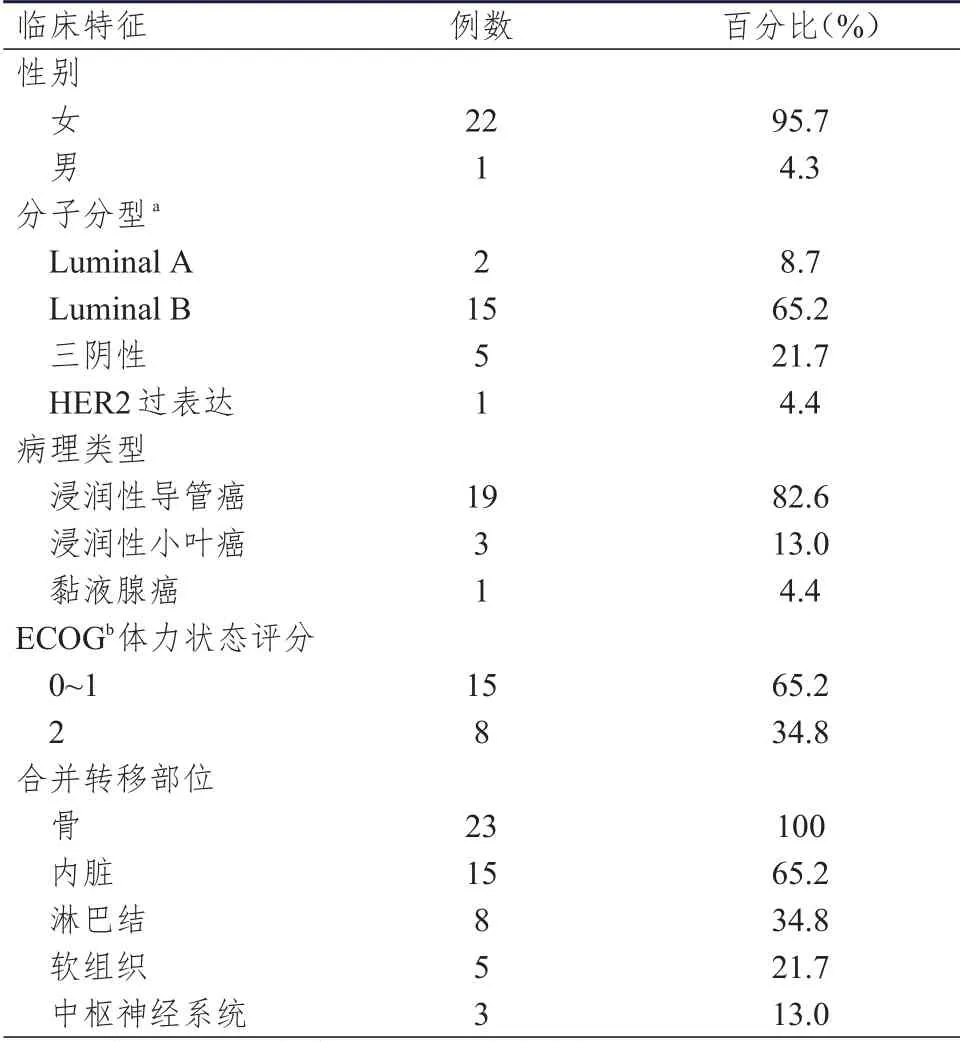
表1 23例乳腺癌骨髓转移患者的临床特征
1.2 治疗方法
23例乳腺癌患者骨髓转移确诊后,5例患者接受对症治疗,1例患者接受内分泌治疗,14例患者接受化疗序贯内分泌治疗,3例患者接受化疗。17例接受化疗的患者中,5例单药化疗(4例紫杉醇,1例白蛋白结合型紫杉醇),12例联合化疗(4例紫杉醇+卡铂,3例蒽环类+紫杉醇,3例多西他赛+卡培他滨,1例吉西他滨+顺铂,1例长春瑞滨+顺铂)。15例接受内分泌治疗的患者中,10例采用芳香化酶抑制药,2例采用三苯氧胺,1例采用氟维司群,1例采用依西美坦+依维莫司,1例采用甲羟孕酮。
1.3 评价指标
分析患者的临床特征,包括相关症状、血常规、肝肾功能、碱性磷酸酶(alkaline phosphatase,ALP)和乳酸脱氢酶(lactate dehydrogenase,LDH),以及患者的治疗和生存情况等。根据血红蛋白(hemoglobin,Hb)降低的程度将贫血分为轻度贫血(Hb为91~110 g/L)、中度贫血(Hb为61~90 g/L)和重度贫血(Hb为30~60 g/L)。将PLT下降分为Ⅰ度[PLT为(76~l00)×109/L]、Ⅱ度[PLT为(51~75)×109/L]、Ⅲ度[PLT为(26~50)×109/L]和Ⅳ度(PLT<26×109/L)。将白细胞(white blood cell,WBC)下降分为Ⅰ度[WBC为(3.1~4.0)×109/L]、Ⅱ度[WBC为(2.1~3.0)×109/L]、Ⅲ度[WBC为(1.1~2.0)×109/L]和Ⅳ度(WBC<1.1×109/L)。三系降低特指红细胞系、白细胞系、血小板系均降低的一种病理情况,一系降低特指其中任意一种降低,二系降低特指其中任意两种降低。
1.4 统计学方法
采用SPSS 22.0统计软件分析数据,计数资料以率(%)表示,采用χ2检验;多因素分析采用Cox风险回归模型;生存分析采用Kaplan-Meier法绘制曲线,比较采用Log-rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨髓细胞学检查的指征
23例乳腺癌骨髓转移患者中,12例(52.2%)在内分泌维持治疗期出现血常规中一系或三系降低;7例(30.4%)因骨转移,常规行骨穿刺检查;2例(8.7%)化疗后PLT持续降低;2例(8.7%)病程中出现不规则发热,正规抗炎治疗无效。
2.2 分子分型与合并转移情况
23例乳腺癌骨髓转移患者中,Luminal A型2例(8.7%),Luminal B型15例(65.2%),三阴性5例(21.7%),HER2过表达型1例(4.4%)。23例乳腺癌患者诊断骨髓转移时均伴有其他部位转移:骨23例,区域或远端淋巴结转移8例,肝和肺各7例,脑、胸膜和皮下各2例,对侧乳腺、卵巢和脑膜各1例。其中,7例患者只并发骨转移,另有7例患者的转移部位数目≥3个。
2.3 血液学指标
23例乳腺癌骨髓转移患者中,只有5例(21.7%)患者血常规正常,其余18例血常规异常患者中15例(65.2%)患者合并不同程度的贫血,包括轻度贫血5例、中度贫血4例、重度贫血6例。15例贫血患者中13例(86.7%)为正细胞正色素性贫血(平均Hb含量及平均红细胞体积均处于正常范围)。23例乳腺癌骨髓转移患者中,10例(43.5%)患者合并不同程度的PLT下降,包括Ⅰ度3例、Ⅱ度5例、Ⅲ~Ⅳ度2例;6例(26.1%)患者合并不同程度的WBC降低,包括Ⅰ度3例、Ⅱ度3例。最常见的血常规改变为二系降低,有9例(39.1%);其次为一系降低,有7例(30.4%);三系降低只有2例(8.7%)。
生化检查显示:23例乳腺癌骨髓转移患者中,21例(91.3%)患者的LDH不同程度升高,中位数、四分位数间距分别为659、696 IU/L(正常范围为141~4928 IU/L);14例(60.9%)患者的ALP不同程度升高,中位数、四分位数间距分别为207、223 IU/L(正常范围为54~589 IU/L)。
2.4 治疗与生存的关系
23例乳腺癌患者确诊骨髓转移后的生存期(overall survival,OS)为 0.07~5.50年,中位 OS为0.92年。接受化疗的患者中位OS为1.78年,明显长于未化疗患者的0.08年(χ2=23.427,P<0.01),详见图1。单药化疗患者的中位OS为1.78年,长于联合化疗患者的1.38年;接受内分泌治疗的患者中位OS为1.78年,长于未接受内分泌治疗的0.39年,但差异均无统计学意义(χ2=2.083、1.724,P=0.149、0.189)。

图1 乳腺癌骨髓转移患者的生存曲线
2.5 预后影响因素分析
对患者的临床特征、实验室检查和治疗情况进行单因素分析,结果显示:骨转移至骨髓转移的时间≥2年、PLT<75×109/L、ALP≥2倍正常值、未接受化疗的患者中位OS短于骨转移至骨髓转移的时间<2年、PLT≥75×109/L、ALP<2倍正常值、接受化疗的患者,差异均有统计学意义(P<0.05),详见表2。对单因素分析中P<0.05的因素进行多因素回归分析,结果显示:只有未接受化疗是乳腺癌骨髓转移预后的独立影响因素(P<0.05),详见表3。
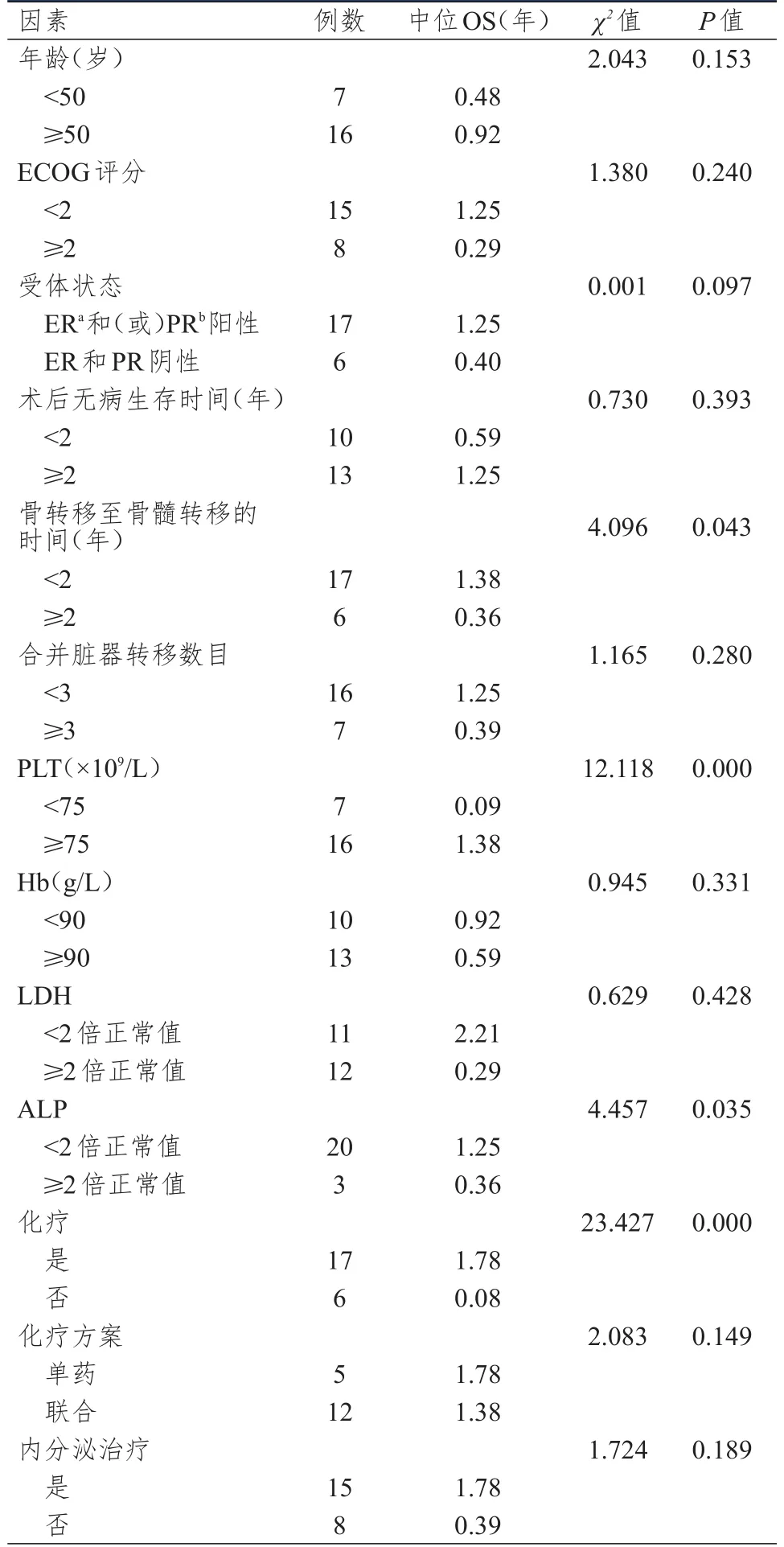
表2 23例乳腺癌骨髓转移患者预后的单因素分析
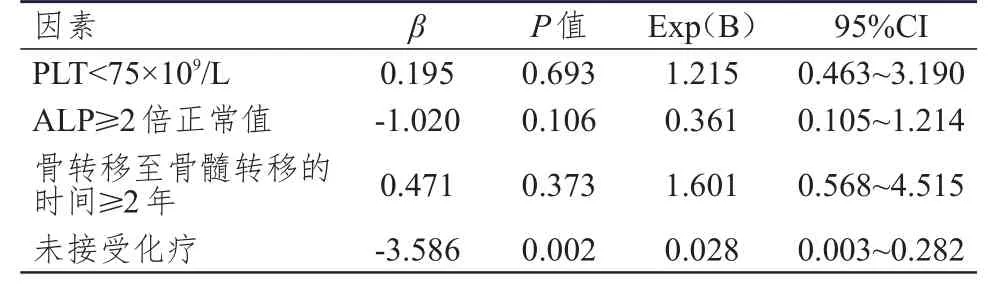
表3 乳腺癌骨髓转移患者预后影响因素的Cox回归分析
3 讨论
3.1 乳腺癌骨髓转移与骨转移的关系
乳腺癌骨髓转移与骨转移关系密切,二者经常合并发生,可能与二者在解剖、血液供应方面关系密切有关[5],但二者并不等同,区别在于:①二者的临床表现不同,骨转移常引起疼痛以及病理性骨折、脊髓压迫、高钙血症等一系列骨相关事件[6]。而骨髓转移初期通常没有特殊的症状和体征,其确诊需要进行微创的骨髓穿刺,均在一定程度上造成了骨髓转移诊断的延后和低估。本研究中,23例骨髓转移患者均伴有骨转移,10例骨髓转移与骨转移同时诊断,其他均在骨转移后诊断,与骨转移间隔最长的患者达5年以上,多数患者因血常规异常才接受骨髓穿刺检查,诊断的时机较晚。②二者的预后不同,乳腺癌骨转移患者的中位OS多为4~5年[7],而骨髓转移患者的中位OS为1年[5],这可能是因为骨髓转移影响骨髓的造血功能,患者对化疗的耐受性下降,需要特别指出的是,发生骨髓转移的患者如果不能接受化疗,预后更差,中位OS仅为1个月;也可能因为骨髓转移造成肿瘤细胞在血液中循环流动,更易进一步播散转移[5]。本研究的结果与上述报道[5]相仿,未接受化疗是预后唯一的独立影响因素,而未接受化疗最重要的原因是进行性PLT下降。
3.2 乳腺癌分子亚型与骨髓转移的关系
乳腺癌的分子亚型提出后,迅速成为研究热点,研究者发现乳腺癌不同亚型的临床表现、病理结果、基因表达及预后均有很大的差异[4]。有研究显示,Luminal型患者易出现骨转移,Luminal A型患者中超过70%的转移灶是骨转移,Luminal B型患者中也有50%的转移部位是骨,而HER2过表达型和三阴性乳腺癌的骨转移率均约为30%[8]。遗憾的是各分子亚型的骨髓转移率尚无报道。本研究中,骨髓转移患者的分子分型以Luminal B型最常见,占65.2%;其次为三阴性,占21.7%;Luminal A型和HER2过表达型均少见。
3.3 骨髓转移的诊断时机
本研究患者多在血常规出现一系或三系降低时才进行骨髓穿刺得以诊断,发现骨髓转移的时机偏晚,以至于6例患者不能接受化疗,这6例患者的中位OS仅为1个月,因此骨髓转移的早期诊断使患者有机会接受化疗,是改善预后的重要手段。根据本研究的结果,建议在乳腺癌的诊治过程中,如果血常规中任何一系无明确原因降低或患者出现不明原因的弛张热,怀疑骨髓转移,需及早进行骨髓穿刺检查,除上述典型表现外,骨转移伴有LDH升高的患者也应该进行骨髓穿刺检查。本研究中,91.3%患者的LDH升高,LDH是细胞糖酵解过程中的一种重要的氧化还原酶,恶性肿瘤组织的糖酵解高于正常组织,尤其是恶性程度高、分期晚的患者,LDH升高更明显,预后更差[9]。ALP广泛分布于人体肝脏、骨等器官,最终经肝脏向胆外排出的一种酶。ALP异常多见于肝脏病变和骨骼疾病,肿瘤侵犯骨骼发生骨破坏时,ALP升高,但根据ALP变化诊断乳腺癌骨转移的灵敏度和特异度均较低[10]。本研究的23例乳腺癌患者均合并骨转移,14例(60.9%)患者的ALP升高,与上述研究结果相似。此外,由于肿瘤细胞浸润骨髓,破坏骨髓屏障,所以患者的外周血涂片出现幼稚细胞,如果患者不配合骨穿刺或因为PLT显著下降,不适宜进行骨穿刺时,可以先行外周血涂片,有助于临床判断。随着影像技术的发展,正电子发射型计算机断层扫描显像(positron emission tomography-computed tomography,PET-CT)在诊断恶性肿瘤骨骼受侵犯方面具有显著的优势,PET-CT显像通过检测局部葡萄糖代谢活性的变化可以在骨结构发生变化之前发现转移病灶,PET-CT可以同时检测骨皮质和髓质的早期改变,诊断骨髓转移的敏感度高达90%[11]。
3.4 乳腺癌骨髓转移患者的治疗
乳腺癌患者出现骨髓转移后,均建议化疗,即使是腔隙型患者,因为骨髓转移患者预后差,甚至可能危及生命,内分泌治疗无效可能导致患者失去化疗的时机。大多数乳腺癌骨髓转移患者经历了较长的病程,合并多处转移,同时存在骨髓功能障碍,已经出现血常规异常的患者对联合化疗的耐受性差,可以试用小剂量紫杉醇单药,每周给药1次。有研究报道,乳腺癌骨髓转移患者接受联合化疗和单药化疗的疗效相当,但单药组患者的OS显著延长[5]。本研究中,接受化疗的患者中位OS明显长于未接受化疗的患者,差异有统计学意义(P<0.01);单药化疗患者的中位OS长于联合化疗患者,但差异无统计学意义(P>0.05);因此乳腺癌骨髓转移患者应该积极地给予化疗,而伴有贫血和(或)PLT下降的乳腺癌骨髓转移患者,建议在对症支持治疗的同时,尽可能给予单药化疗。
