油酸Ka值的测定-酸滴定油酸钠法
2018-07-25牛鹏飞王天壮
牛鹏飞, 王天壮
(1.山西省应用化学研究所,山西 太原 030027;2.中国日用化学工业研究院,山西 太原 030001)
油酸的HLB值为1[1],其水溶性较差HLB值<4的物质在水中不溶[2],易溶于油性溶剂;而油酸钠的HLB值为18[1],其在水中的溶解性很好。作为表面活性剂的油酸钠固有的增溶分散特性在一定程度上能保证油酸在纯水中溶解度,所以,从油酸钠的水溶液来求油酸的Ka值存在可行性[3]。本文用盐酸标准溶液滴定油酸钠的水溶液,并用pH电极作指示电极,利用电位法滴定,实现了在水溶液中测定油酸的电离常数。而常见的工具书上均没有油酸Ka的数值,故测定油酸的电离常数具有一定的理论与应用价值。
1 实验部分
1.1 实验仪器
GCMS-QP2010 Ultra,日本岛津所;雷磁PHS-3C型pH计,E-201-C pH复合电极(雷磁),上海精密科学仪器有限公司;HH数显恒温水浴锅,江苏金城国胜实验仪器厂。
1.2 实验试剂
0.2%油酸钠溶液:准确称取纯化的油酸钠(分析纯,天津市光复精细化工研究所)1.000 g于烧杯中,用超纯水(去氧气)溶解后,转移并定容到500 mL容量瓶中,避光存放。油酸钠溶液用前水浴(40 ℃)加热半小时至溶液清亮后,冷至室温待用。
盐酸(GB/T 622),c(HCl)=0.01 mol/L标准溶液;盐酸(GB/T 622),c(HCl)=2.5 mol/L溶液。
超纯水,加热煮沸冷却(去除水中溶解氧与二氧化碳)。
三氯甲烷,分析纯,天津市申泰化学试剂有限公司。
1.3 实验原理
在酸碱滴定反应中可以从质子条件推导出溶液pH值与溶液中酸电离常数的关系[3],在盐酸滴定油酸钠溶液的反应体系中选取的质子参考水准为:C17H33COO-,H2O,HCl。
酸碱中和反应体系中的质子条件为式(1)。
c(HCl)+[OH-]总=[H+]H2O+
[C17H33COOH]+[H+]HCl
(1)
碱性条件下,式(1)可简化为式(2)。
[OH-]总=[C17H33COOH]-c(HCl)
(2)
由水溶液的KW=[H+]×[OH-]=10-14式(2)可转化为式(3)。
10-14/[H+]=[C17H33COOH]-c(HCl)
(3)
油酸的电离平衡式见式(4)。
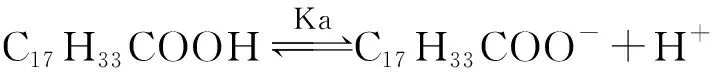
(4)
将式(4)代入式(3)得到式(5)。
10-14/[H+]=[H+][C17H33COO-]/Ka-c(HCl)
(5)
将式(5)简化得式(6)。
Ka(10-14+[H+]c(HCl)=[H+]2[C17H33COO-]
(6)
因为,在反应体系中[H+]c(HCl)≥10-14,所以式(6)可简化为第59页式(7)。
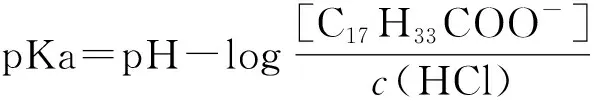
(7)
由式(6)可知,当[C17H33COO-]=c(HCl)时,溶液的pH=pKa成立。
在酸性条件下,油酸钠溶液的盐酸滴定反应体系中的质子条件简化式为式(8)。
c(HCl)=[H+]总+[C17H33COOH]
(8)
将式(4)代入得式(9)。
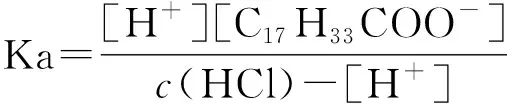
(9)
因为体系是由碱性条件通过盐酸标准溶液滴定进入酸性条件的,该条件下c(HCl)≥[H+],所以,式(9)可简化为式(10)。
Ka=[H+][C17H33COO-]/c(HCl)
(10)
将式(10)取负对数得式(11)。
(11)
综合上述结论可知,在酸性条件下体系的pH与pKa关系与体系在碱性条件下的结果都一样,均为式(7)的形式。而[C17H33COO-]=c(HCl)时,有[C17H33COO-]=c(油酸钠)/2,pH=pKa,理论上成立。
方法的正确性,可用求得的Ka值与已知浓度油酸钠溶液理论上计算得出的pH值与实际溶液pH值的比值来验证。
1.4 实验方法
1.4.1 油酸钠的纯化
称取4 g油酸钠(AR)到150 mL锥形瓶中,加入75 mL无水乙醇(AR),置于70 ℃水浴中加热搅拌30 min;取出,冷却至室温,静置48 h,过滤,将滤液在水浴(90 ℃)上加热蒸发,然后,在90 ℃烘箱下加热烘干至恒重,得到纯化后的油酸钠。
1.4.2 油酸钠中有机羧酸的GCMS法测定
称取纯化的油酸钠0.10 g,用30 mL超纯水溶解并转移入250 mL分液漏斗中,加入2.5 mol/L盐酸溶液2.0 mL,摇匀后用三氯甲烷萃取4次,萃取液定容到25 mL容量瓶中。移取1.00 mL萃取溶液用三氯甲烷定容到10 mL容量瓶中成待测萃取液。对未纯化的油酸钠做同样的实验操作,进行对照。
GCMS测试条件:色谱柱Rxi®-5Sil MS;氦气流速1.7 mL/min;进样体积1 μL,不分流;进样室温度280 ℃;柱温箱升温程序见表1;接口温度280 ℃;离子源温度280 ℃;质谱采集方式Scan。

表1 柱温箱升温程序
1.4.3 油酸Ka值的测定
移取0.20%的油酸钠溶液10.00 mL到150 mL高型烧杯中,加入40 mL超纯水,将烧杯置于20 ℃恒温水浴中,用0.01 mol/L的盐酸标准溶液电位滴定油酸钠溶液,记录油酸钠溶液电位与滴定液体积数据的同时记录油酸钠溶液相应的pH值。
1.4.4 油酸钠溶液的pH值测定
移取0.20%的油酸钠溶液40 mL到50 mL烧杯,置于20 ℃的恒温水浴中,恒温后用校正过的pH计测量溶液的pH值。
精密移取0.20%的油酸钠溶液20 mL至100 mL容量瓶中,用超纯水定容。移取40 mL至50 mL的烧杯中,置于20 ℃的恒温水浴中,溶液恒温后用校正过的pH计测量其pH值。
2 结果与讨论
2.1 待测物纯度的影响
测定油酸钠常数时,待测物的纯度应达到一定的级别,测得的数据才有意义。第60页图1为油酸钠酸化提取物以GCMS法测试的总离子流图。从图1中可知,油酸钠的主要杂质是14.873 min处的正十六酸钠。对于结构相似的化合物,不饱和脂肪酸皂较饱和脂肪酸皂易溶于水[4],熔点高的有机物较熔点低有机物在极性溶剂中的溶解度低[5]。正十六酸钠熔点为270 ℃,油酸钠熔点为232 ℃,所以,采用无水乙醇作油酸钠的纯化溶剂。纯化后油酸钠中正十六酸钠含量降为3.87%,油酸钠的含量提升到95.30%(详见第60页表2)。
一般pH电极的读数误差为±0.01,由95.30%的油酸钠代替100%含量的油酸钠在pH计上造成的误差已经与pH计的读数误差相同,故含量95.30%的油酸钠已达到纯化的目的。
2.2 油酸Ka值的测定结果
第60页图2为盐酸溶液滴定油酸钠溶液的电位与pH关系图,滴定体系在滴定液滴入2.00 mL时变浑浊,此时,溶液中油酸的浓度为3.99×10-4mol/L(0.010 38×2/52,0.010 38为盐酸标准溶液浓度),可知此时油酸的溶解度约为0.012 g,这与文献[2]所述相符。电位突跃点为6.36 mL处,相应的一半体积处为3.18 mL,对应的pH值为8.79。此时,依据公式(7)pH=pKa,即,油酸的pKa=8.79,Ka=1.62×10-9(20 ℃)。
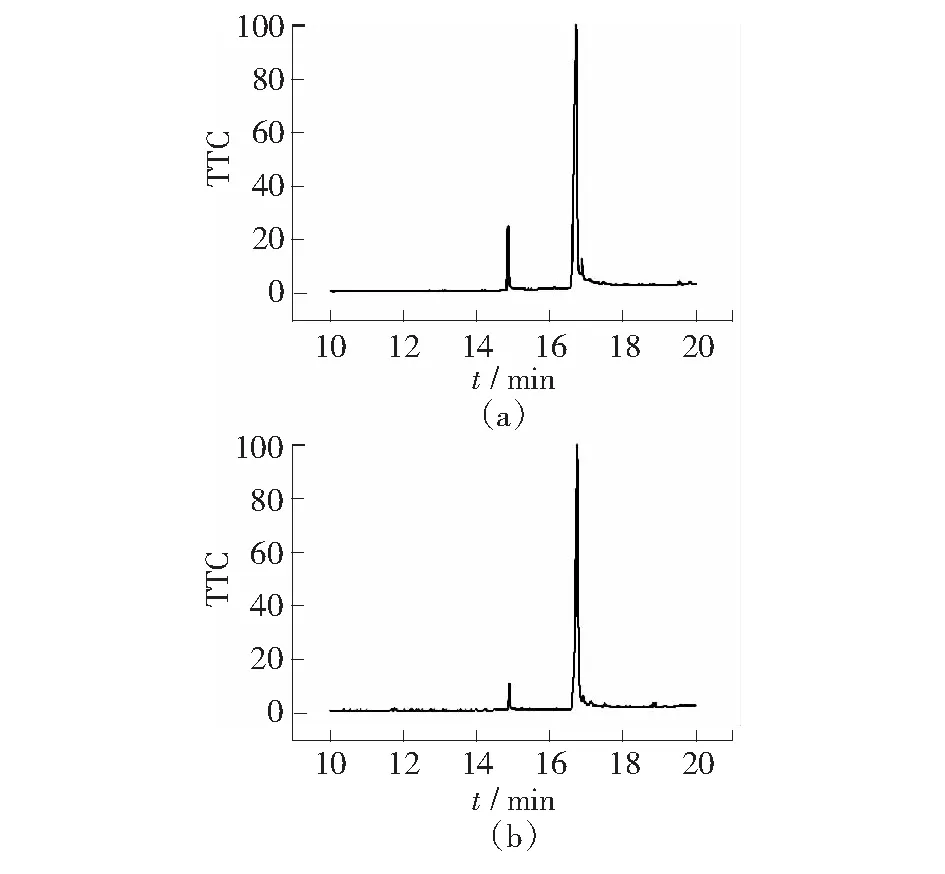
图1 油酸钠纯化前(a)和纯化后(b)有机羧酸的GCMS总离子流图
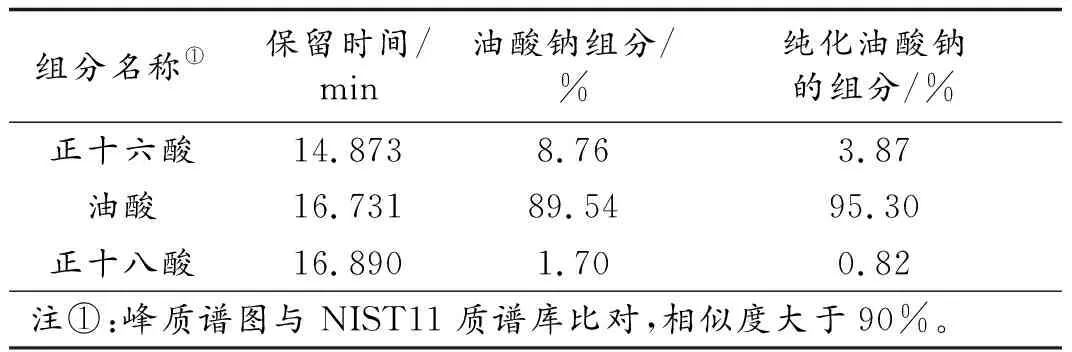
表2 油酸钠中有机羧酸纯化前、后的组成(面积归一法)
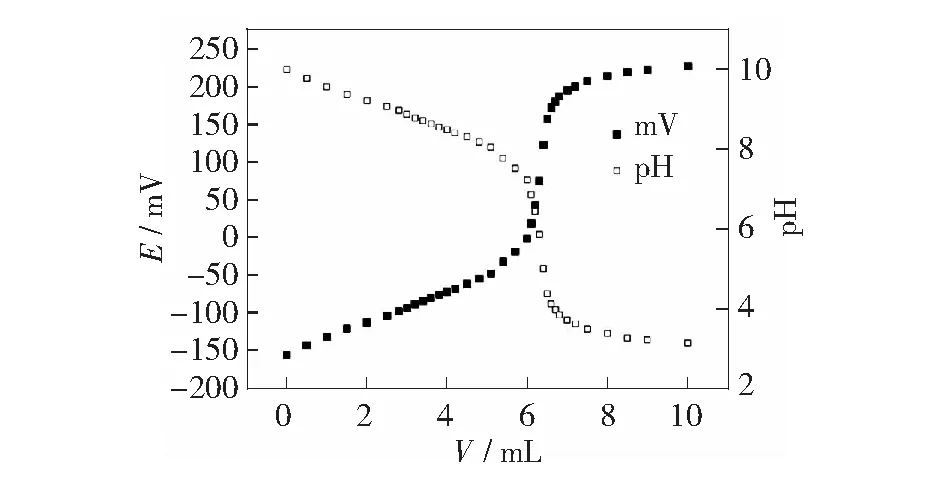
图2 油酸钠的盐酸电位滴定曲线与溶液pH关系图
2.3 油酸钠溶液的pH值测定结果
溶液的pH值实际是溶液中氢离子活度的负对数值,溶液浓度高时,浓度与活度的差值较大,需要由活度系数修正浓度值来得到活度值。考虑活度系数后,0.200%油酸钠溶液的pH值由Ka值算出的理论值为10.26,这与实测值10.22基本吻合;0.040%油酸钠溶液的pH值由Ka值算出的理论值为9.95,实际溶液的pH值为9.97,也基本吻合。这些均较好地证明了油酸Ka值的准确性。相关数据见表3。

表3 油酸钠溶液的推导pH值与实测值
3 结论
1) 无水乙醇是纯化油酸钠的有效溶剂,可将油酸钠纯化到95%以上。
2) 盐酸滴定油酸钠的水溶液体系中溶液的pH值与油酸Ka值的关系符合公式 。
3) 通过电位滴定法测得的油酸Ka值为1.62×10-9(20 ℃)。
