整合素α5β1、HPA在PSTT和绒癌中的表达及意义*
2018-07-24齐洁敏白兴武石晓虹
齐洁敏,白兴武,石晓虹
(1.承德医学院病理学教研室,河北承德 067000;2.承德护理职业学院)
研究发现,肿瘤细胞粘附力的改变,以及细胞外基质(ECM)、基底膜(BM)的破坏是肿瘤恶性发展过程中的首要步骤[1]。因此,能够破坏ECM和BM的乙酰肝素酶(HPA)及作为细胞粘附分子的整合素α5β1在肿瘤发生发展过程中的功能非常重要。目前,国内关于整合素α5β1、HPA在胎盘原位滋养细胞肿瘤(PSTT)和绒癌组织中的表达情况未见报道。为此,本研究采用蛋白印迹技术检测了绒癌组织、PSTT组织和正常绒毛组织中整合素α5β1和HPA蛋白的表达水平,以探讨二者在PSTT和绒癌发生发展过程中的作用。
1 资料与方法
1.1 一般资料 2012年7月-2016年12月,承德医学院附属医院、承德市中心医院、中国人民解放军第266医院、秦皇岛人民医院等多家医院经手术切除并经术后病理确诊的正常绒毛40例、PSTT 15例、绒癌20例。所有患者临床资料完整,在术前均未接受放疗、化疗。
1.2 主要试剂 兔抗人整合素α5β1、HPA单克隆抗体,美国Abcam公司;PageRuler预染蛋白Ladder,美国Thermo公司;BCA蛋白浓度测定试剂盒(增强型),中国上海碧云天生物技术有限公司;RIPA组织/细胞裂解液,中国北京索莱宝生物科技有限公司;PVDF转印膜,美国Millipore公司;兔抗β-actin多克隆抗体,美国Bioworld公司;羊抗兔IgG二抗,美国KPL公司。
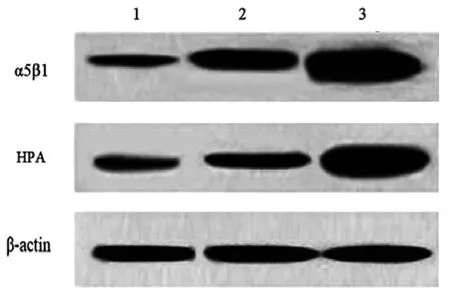
1.3 Western blot法检测整合素α5β1和HPA蛋白的表达情况 提取正常绒毛组织、PSTT组织和绒癌组织中的总蛋白,BCA法测定总蛋白浓度。12% SDS-PAGE凝胶电泳,蛋白上样量为40μg,湿转法转膜,采用ECL化学发光法观察。一抗工作浓度:整合素α5β1(1:300),HPA(1:300),β-actin(1:2000)。应用Image-J软件对目的条带和内参条带的灰度值进行分析,计算目的蛋白与内参蛋白灰度值的比,作为目的蛋白的相对含量。
1.4 统计分析 采用SPSS 19.0软件进行统计学分析,结果用(±s )表示,组间比较采用单因素方差分析和q检验,P<0.05为差异有统计学意义。
2 结果
2.1 整合素α5β1蛋白在正常绒毛、PSTT及绒癌组织中的表达情况 绒癌组织中整合素α5β1蛋白的相对表达量明显高于正常绒毛组织和PSTT组织(P<0.05);PSTT组织中整合素α5β1蛋白的相对表达量明显高于正常绒毛组织(P<0.05)。见附图,附表:
附表 整合素α5β1和HPA蛋白的表达情况(±s )
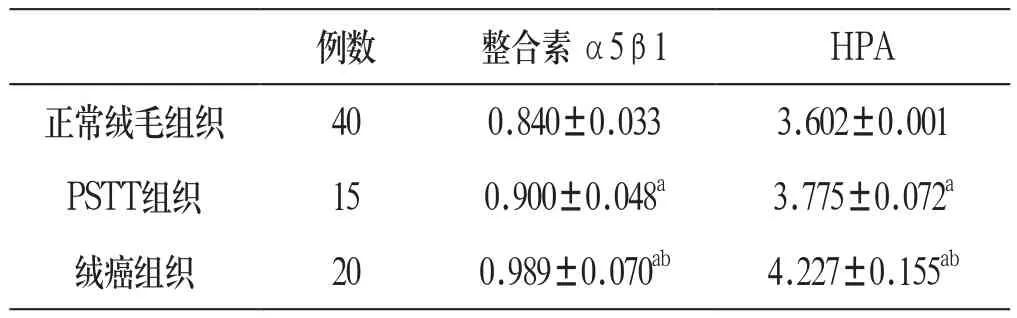
附表 整合素α5β1和HPA蛋白的表达情况(±s )
与正常绒毛组织比较:aP<0.05;与PSTT组织比较:bP<0.05
例数 整合素α5β1 HPA正常绒毛组织 40 0.840±0.033 3.602±0.001 PSTT组织 15 0.900±0.048a 3.775±0.072a绒癌组织 20 0.989±0.070ab 4.227±0.155ab
2.2 HPA蛋白在正常绒毛、PSTT及绒癌组织中的表达情况绒癌组织中HPA蛋白的相对表达量明显高于正常绒毛组织和PSTT组织(P<0.05);PSTT组织中HPA蛋白的相对表达量明显高于正常绒毛组织(P<0.05)。见附图,附表。
3 讨论
3.1 整合素α5β1与PSTT和绒癌 整合素α5β1高表达在肿瘤的发生、发展过程中具有重要作用。迟福生等[2]应用RT-PCR技术检测整合素α5β1 mRNA在贲门癌中的表达情况,发现整合素α5β1 mRNA在癌旁正常黏膜中的表达显著低于贲门癌,且与贲门癌的淋巴结转移、临床病理分期有关;Arboleda等发现[3],整合素α5β1蛋白的高表达可加强肝癌细胞的侵袭性;白兴武等[4]的研究结果也显示,整合素α5β1蛋白及mRNA在胃癌中的高表达与胃癌的生长、浸润和转移密切相关;王闯等[5]采用组织芯片结合免疫组化SP法检测发现,整合素α5β1在宫颈鳞癌中的表达水平明显高于宫颈正常黏膜,且与宫颈鳞癌的生物学行为(分化程度、临床分期、浸润深度、淋巴结转移)有密切关系。此外,整合素α5β1还能调节基质金属蛋白酶(MMP)的分泌和活化,促进肿瘤的浸润、转移[6];并且整合素α5β1还能加强肿瘤的异质性粘附、降低肿瘤的同质性黏附,这在肿瘤的发生发展,尤其是浸润、转移过程中起着非常重要的作用。上述研究结果均表明,整合素α5β1可能参与了胃癌、肝癌、宫颈癌等多种肿瘤发生发展的复杂过程,但整合素α5β1在PSTT和绒癌中的表达变化及意义在国内未见报道。本研究采用蛋白印记技术从蛋白水平检测了整合素α5β1蛋白在绒癌、PSTT及正常绒毛中的表达情况,结果显示绒癌组织整合素α5β1的表达明显高于PSTT和正常绒毛、PSTT明显高于正常绒毛,说明整合素α5β1可能参与了绒癌和PSTT的发生发展。
3.2 HPA与PSTT和绒癌 ECM和BM结构的破坏是恶性肿瘤生长、局部浸润和转移开始的一个重要标志。HPA是近年来发现的一种非常重要的功能酶,能破坏BM和ECM的结构、参与ECM和BM结构的降解和重塑,与肿瘤的发生、侵袭、转移,以及炎症的发生发展密切相关[7-8]。王新等[9]采用免疫组化法检测观察组(口腔鳞癌组织)和对照组(正常口腔黏膜组织)HPA的表达情况,发现口腔鳞癌HPA的表达明显升高,可能与口腔鳞癌的侵袭、转移及预后差有关;郑晓东等[10]利用免疫组化法检测了HPA在乳腺浸润性导管癌和乳腺纤维腺瘤中的表达情况,结果显示乳腺浸润性导管癌中HPA的阳性表达显著高于乳腺纤维腺瘤,提示HPA可能促进乳腺浸润性导管癌的生长、浸润和转移;高辉等[11]应用SABC免疫组化法检测了胰腺癌、癌旁组织和正常胰腺组织HPA的表达情况,发现癌旁及正常胰腺组织HPA的阳性表达明显低于胰腺癌,且胰腺癌有淋巴结转移组HPA蛋白的阳性表达明显高于无淋巴结转移组,说明HPA与胰腺癌的发生、转移有关。上述研究结果均提示,HPA与口腔鳞癌、乳腺癌、胰腺癌等多种肿瘤的发生发展和浸润转移有关,但HPA在PSTT和绒癌中的表达及意义的研究在国内未见报道。本研究采用蛋白印记技术检测了HPA蛋白在绒癌、PSTT及正常绒毛中的表达情况,结果发现HPA在正常绒毛、PSTT及绒癌中的表达呈逐渐上升趋势,两两比较差异有统计学意义,表明HPA蛋白与绒癌的发生密切相关,且亦有可能参与了PSTT的发生发展。
综上所述,整合素α5β1和HPA在绒癌、PSTT中的异常表达与绒癌和PSTT的发生发展有关。但由于PSTT组织的例数有限,本研究得出的只是初步结论,二者在滋养细胞肿瘤中发生过程中的作用及详细机制还有待于进一步研究。
