软枣猕猴桃黄酮对过氧化氢诱导HaCaT细胞损伤的保护作用
2018-07-23王仁才吴小燕
石 浩,王仁才,吴小燕,刘 琼
(湖南农业大学园艺园林学院,国家植物功能成分利用工程技术研究中心,湖南 长沙 410128)
软枣猕猴桃(Actinidia arguta Sieb.et Zucc.)为猕猴桃科猕猴桃属多年生落叶藤本植物,是9 种光果猕猴桃之一[1]。在我国主要分布于东北地区、华北地区、长江流域及山东省,在朝鲜、日本、俄罗斯亦有分布[2]。据相关研究报道,软枣猕猴桃中含有大量的功效成分物质,如黄酮类[3]、生物碱类[4]、多酚类、花色苷类[5]、多糖类[6]、萜类[7-8]、脂肪酸类[9]等。其中黄酮类物质主要有檞皮素-3-O-芸香糖苷、异檞皮素-3-O-β-D-葡萄糖苷、5,7,3’,4’-四羟基黄酮醇等[10]。黄酮类物质是一种天然抗氧化剂,对自由基具有一定的清除作用,能起到抗氧化[11-12]、防止动脉粥样硬化[13]、延缓衰老[14-15]等作用。自由基属于体内的一种高能分子,能够破坏细胞膜,降低细胞活性,加速细胞内沉积物的生成,引发各种并发症[16-17]。同时,当前生态环境污染的日益严重以及精神、物质生活压力的增加直接或间接地导致了人体内自由基含量的增加[18-19];因此,对控制机体内自由基数量的研究是非常必要的。人永生化表皮细胞(HaCaT细胞)保留了表皮全层的分化能力,与正常人角质细胞非常接近,且其培养方法与原代细胞培养相比相对简单,可以不限次数的传代[20-21],故选取HaCaT细胞建立过氧化氢(H2O2)氧化损伤模型,并用此模型进行抗氧化物质的相关评价与研究。本研究以湖南省浏阳市大围山软枣猕猴桃为原料,运用噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)法,以细胞内超氧化物歧化酶(superoxide dismutase,SOD)活力、活性氧簇(reactive oxygen species,ROS)水平为评价指标,考察软枣猕猴桃黄酮类物质对HaCaT细胞的抗氧化作用,为软枣猕猴桃天然抗氧化功能产品的开发提供依据。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃为湖南浏阳市大围山野生嫁接驯化品种。
芦丁、亚硝酸钠、硝酸铝、氯仿、正丁醇、VC国药集团化学试剂有限公司;HaCaT细胞 长沙湘雅医院;1640高糖培养基、胎牛血清、二甲基亚砜(dimethyl sulfoxide,DMSO)、Gibco胰酶消化液 美国Thermo Fisher Scientific公司;MTT 美国Sigma公司;二辛可酸(bicinchoninic acid,BCA)蛋白定量试剂盒康为世纪生物科技有限公司;SOD检测试剂盒 南京建成生物科技有限公司;ROS检测试剂盒 碧云天生物技术研究所。
1.2 仪器与设备
全自动酶标洗板机、多功能酶标分析仪 深圳市汇松科技发展有限公司;自动平衡离心机 湖南湘仪实验室仪器开发有限公司;直热式二氧化碳培养箱 上海三腾仪器有限公司;倒置生物显微镜 北京中显恒业仪器仪表有限公司;FACSCalibur流式细胞分析仪 美国BD公司;冷冻干燥仪 美国Thermo Fisher Scientific公司;低速离心机、摇床、精密电子天平 常熟市双杰测试仪器厂。
1.3 方法
1.3.1 供试样的制备
软枣猕猴桃果实干燥粉末经体积分数70%的乙醇溶液超声提取,提取液经浓缩后加入1/3体积的Sevag试剂(氯仿∶正丁醇=4∶1,V∶V)混合振荡20 min后静置15 min,除去水层与溶剂交界处的变性蛋白质;滤液经X-5大孔吸附树脂和聚酰胺层析柱相继洗脱,得到初步纯化的黄酮溶液,将其冷冻干燥成粉末,其纯度为80.43%。
1.3.2 VC、黄酮质量浓度的筛选
参考文献[13,22]进行VC、黄酮质量浓度的筛选。使用无菌的磷酸盐缓冲液(phosphate buffered saline,PBS)溶解VC和黄酮粉末,室温下避光存放24 h,混匀后使用0.22 μm针头滤器过滤除菌,贮存于4 ℃待用。有效期4 周。其中黄酮设0.1、0.2、0.3、0.4、0.6、0.8、1.0 mg/mL 7 个质量浓度组,VC设0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08 mg/mL 8 个质量浓度组,每个质量浓度组设5 个复孔。
1.3.3 H2O2诱导HaCaT细胞氧化损伤模型的建立
参考文献[23]建立H2O2诱导的HaCaT细胞氧化损伤模型。将H2O2稀释成2、5、10、15、20、30、40、50、60 μmol/L 9 个浓度组,每个浓度组设5 个复孔。
1.3.4 黄酮对H2O2诱导的细胞氧化损伤的预保护作用
在1.3.2节实验结果基础上,筛选出5 个质量浓度的黄酮类物质对HaCaT细胞进行预保护,再加入最佳浓度H2O2诱导损伤,考察黄酮对HaCaT细胞氧化损伤的预保护作用。
1.3.5 MTT实验
从-18 ℃冰箱中取出已配制好的MTT溶液,置于37 ℃水浴。自培养箱中取出培养板,向每孔加入20 μL MTT溶液,避光,置于培养箱中继续孵育4 h。每孔加入150 μL的DMSO,置于振荡器上振荡5 min后,于酶标仪上读数,波长为490 nm。按式(1)计算细胞相对存活率。

1.3.6 DCFH-DA荧光探针染色实验
采 用2’,7’-二 氯 荧 光 黄 双 乙 酸 盐 ( 2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA)标记法[24]。按照体积比1∶1 000用无血清培养液稀释DCFH-DA,使其工作液终浓度为10 μmol/L。去除细胞培养液,消化离心(1 000 r/min、5~10 min),收集细胞,加1 mL DCFH-DA工作液,37 ℃细胞培养箱内孵育20 min。孵育后用PBS洗两次,充分去除细胞外DCFH-DA以降低背景荧光的干扰,于1 000 r/min离心5 min,收集沉淀,用流式细胞仪在激发波长488 nm、发射波长525 nm处测定荧光强度。
1.3.7 SOD活力测定
1.3.7.1 BCA法测定蛋白质量浓度
用与待测蛋白样品一致的稀释液稀释牛血清白蛋白(albumin from bovine serum,BSA)得到标准品,计算BCA工作液总量,根据计算出的BCA工作液需要量,将BCA-A和BCA-B两种试剂按照50∶1的体积比配制BCA工作液。将稀释好的BSA标准品和待测蛋白样品各25 μL分别加到做好标记的96 孔板微孔中,每孔加入200 μL BCA工作液,充分混匀,盖上96 孔板盖,37 ℃孵育30 min,冷却至室温,用酶标仪在562 nm波长处测定每个样品及BSA标准品的OD值,绘制标准曲线。由标准曲线计算样品中蛋白质量浓度。
1.3.7.2 SOD活力的测定
将细胞悬液置于-80 ℃冷冻30 min后,37 ℃水浴5 min,按此操作反复冻融细胞4 次,以充分破坏细胞并使其释放出细胞SOD活性成分,2 500 r/min离心20 min,小心收集上清液。取样品溶液加入96 孔板中,设对照孔、对照空白孔、测定孔、测定空白孔4 种。按照SOD试剂盒说明书要求操作,使用酶标仪在波长490 nm处读取OD值,并计算SOD抑制率和活力(式(2)、(3))。
1.3.8 ROS水平的测定
按照体积比1∶1 000用无血清培养液稀释DCFH-DA,使其终浓度为10 μmol/L。去除细胞培养液,加入适当体积(以能充分盖住细胞为宜)稀释好的DCFH-DA。37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3 次以充分去除未进入细胞内的DCFH-DA,用胰酶消化并收集于流式细胞仪观察检测。
1.4 数据分析
数据采用Origin软件制图,运用SAS 9.0统计软件进行分析。满足正态性分布且方差齐的两组之间差异的比较用两组独立样本的t检验,多组之间差异的比较用单因素方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 黄酮及VC质量浓度筛选结果
2.1.1 黄酮质量浓度的筛选结果

图1 不同质量浓度黄酮对HaCaT细胞活性的影响Fig. 1 Effects of different concentrations of A. arguta flavonoids on the viability of HaCaT cells
不同质量浓度的黄酮对HaCaT细胞活性的影响存在一定的差异。由图1可知,在0.1~1.0 mg/mL质量浓度范围内,与空白组(0.0 mg/mL)相比,0.1、0.3、0.4、0.6、0.8 mg/mL的黄酮对细胞活性影响较小,细胞相对存活率均保持在100%左右,所以选择这5 个黄酮质量浓度进一步研究其对H2O2诱导的细胞氧化损伤的预保护作用。
2.1.2 VC质量浓度的筛选结果
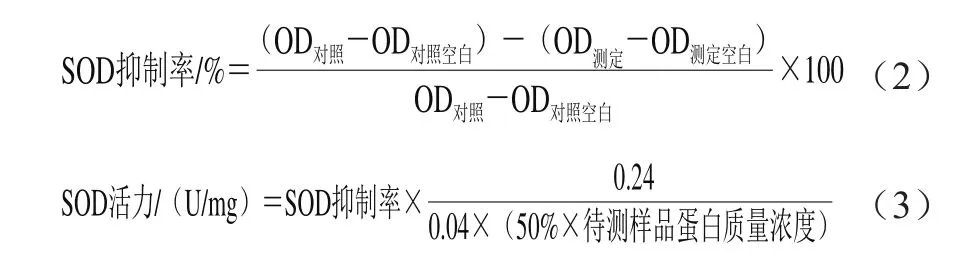
不同质量浓度的VC对HaCaT细胞生物活性的影响具有一定差异性。由图2可知,在0.01~0.08 mg/mL质量浓度范围内,与空白组(0.00 mg/mL)相比,0.07 mg/mL VC相对于其他质量浓度而言对细胞活性影响最小,细胞相对存活率更接近100%,所以选择此VC质量浓度进一步研究其对H2O2诱导的细胞氧化损伤的预保护作用。
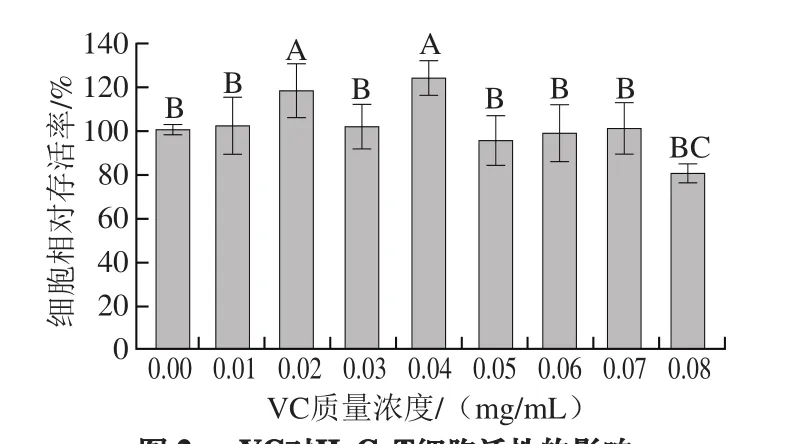
图2 VC对HaCaT细胞活性的影响Fig. 2 Effect of VC on the viability of HaCaT cells
2.2 H2O2氧化损伤模型的建立结果
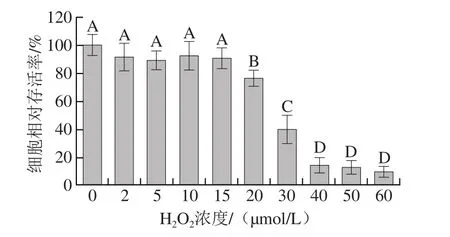
图3 H2O2对HaCaT细胞活性的影响Fig. 3 Effect of H2O2 on the viability of HaCaT cells
不同浓度的H2O2对HaCaT细胞生物活性的影响有所不同。由图3可知,在2~15 μmol/L浓度范围内,随着H2O2浓度的增加,细胞活性总体呈现缓慢下降趋势,但不明显。当H2O2浓度达到20 μmol/L时,对细胞造成了一定的损伤,此时细胞相对存活率为80%左右。当H2O2浓度为30 μmol/L时,细胞的损伤率已十分明显,此时细胞相对存活率小于40%,故选用此浓度诱导HaCaT细胞的氧化损伤模型,以进行进一步的预保护研究。
2.3 黄酮及VC对H2O2氧化损伤模型的预保护作用
图4 不同质量浓度黄酮对H2O2氧化损伤模型的预保护作用Fig. 4 Protective effect of different concentrations of A. arguta flavonoids on H2O2-induced oxidative damage model
在30 μmol/L H2O2诱导的氧化损伤模型中,不同质量浓度黄酮及VC对HaCaT细胞的预保护作用存在差异。由图4可知,当黄酮质量浓度分别为0.3、0.6 mg/mL时,对H2O2诱导的HaCaT细胞氧化损伤的预保护作用最强,其细胞相对存活率均为60%左右。0.07 mg/mL VC产生的预保护效果稍强于黄酮,细胞相对存活率达69%左右。选择黄酮物质量浓度0.3、0.6 mg/mL分别作为黄酮低、高质量浓度组,与0.07 mg/mL VC组进行后续的相关研究。
2.4 黄酮及VC对细胞内SOD活力的影响
不同处理组间SOD活力表现出较大的差异。如表1所示,当采用30 μmol/L H2O2诱导细胞产生氧化损伤后,SOD活力非常低,大约只有空白对照组SOD活力(10.14 U/mg)的1/3。当加入VC及黄酮对细胞进行预保护后,细胞内的SOD活力有所增加,两者相对于模型组均表现出显著性差异,其中VC组增加了139.30%,黄酮低质量浓度组增加了85.63%,这表明黄酮及VC对H2O2造成的HaCaT氧化损伤有较好的预保护作用,VC抗氧化活性稍强于黄酮。黄酮高质量浓度组与黄酮低质量浓度组对HaCaT细胞的保护作用不具有显著性差异,也间接说明较低质量浓度黄酮对HaCaT细胞同样具有较强的抗氧化活性。
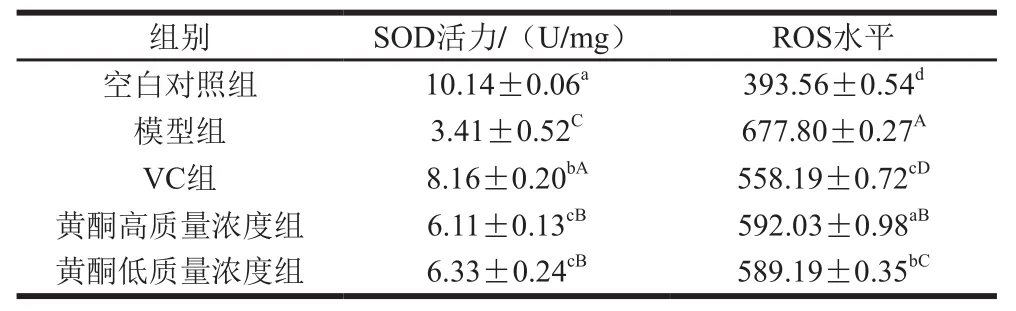
表1 H2O2损伤及抗氧化物质对细胞内SOD活力、ROS水平的影响Table1 Effect of H2O2 damage and antioxidant on intracellular SOD and ROS levels
2.5 黄酮及VC对细胞内ROS水平的影响
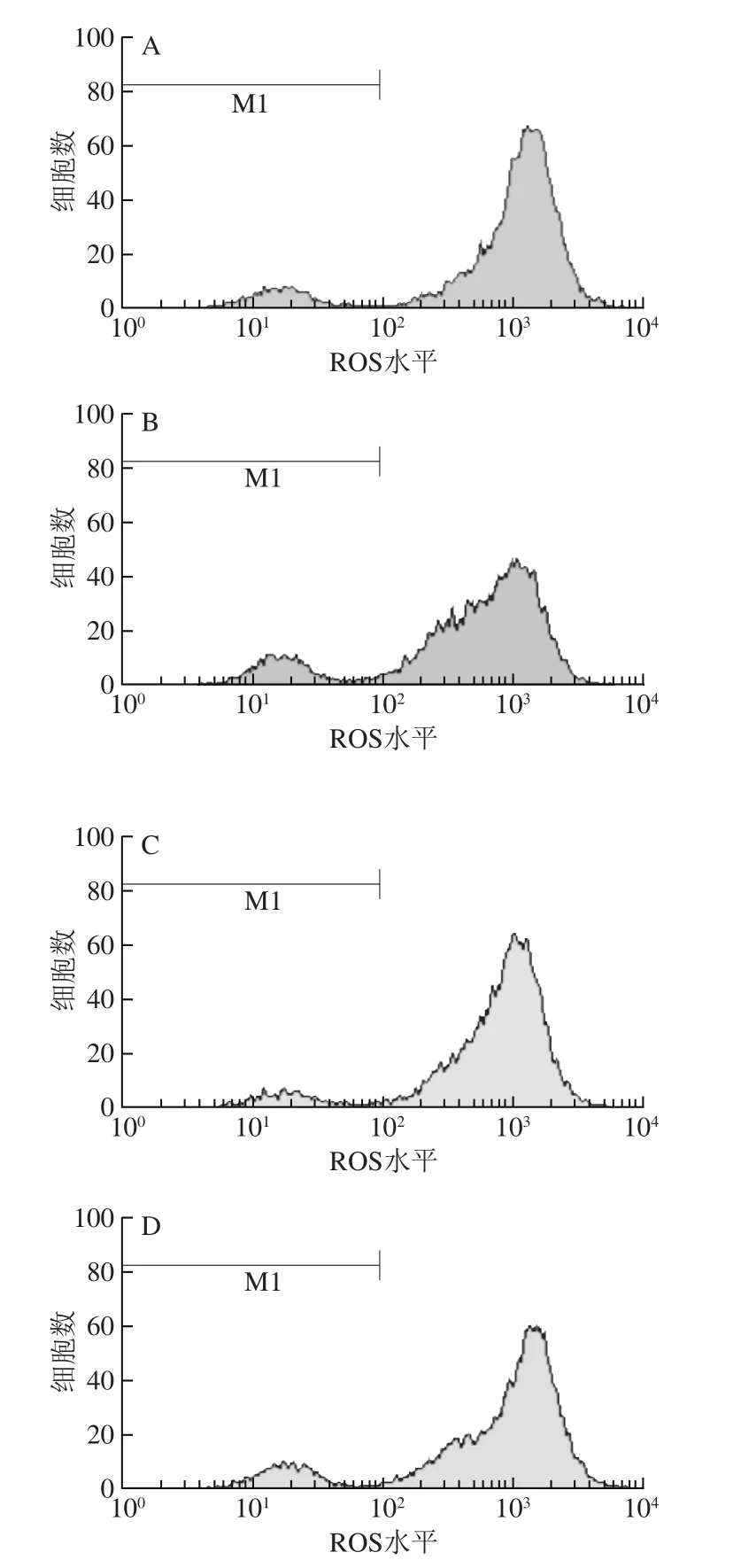
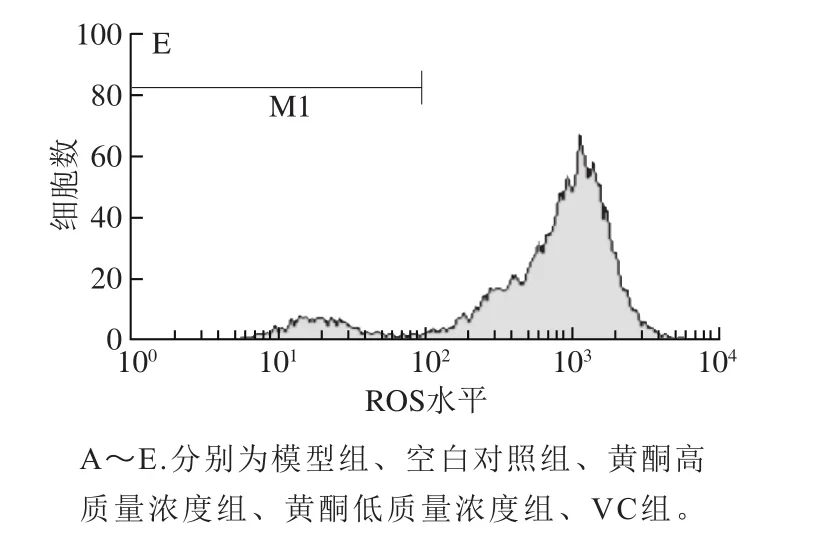
图5 细胞ROS测定流式图Fig. 5 Flow cytometric analysis of ROS in cells
不同处理组间ROS水平同样表现出较大的差异。由表1、图5可以看出,用30 μmol/L H2O2诱导氧化损伤模型后,细胞内的ROS水平明显增高,相对于空白对照组(393.56),模型组的ROS水平(677.80)增加了近1 倍;当加入抗氧化物质黄酮、VC进行预保护后,细胞内的ROS水平较模型组均有一定程度的降低,黄酮高质量浓度组降低了12.65%、VC组降低了17.65%,表明黄酮及VC对H2O2诱导的HaCaT细胞氧化损伤有一定的预保护作用。但相对于空白对照组,黄酮及VC组ROS水平均具有一定程度的升高,从而说明两者对H2O2诱导的HaCaT细胞氧化损伤的预保护作用并不完全。黄酮对HaCaT细胞的预保护作用稍低于VC,黄酮高质量浓度组与黄酮低质量浓度组对HaCaT细胞的预保护作用效果相差不大。
3 讨 论
本研究以HaCaT细胞为研究对象,以VC作为对照,全面分析了软枣猕猴桃中黄酮类化合物对H2O2诱导的HaCaT细胞损伤的预保护作用。MTT实验结果表明,在样品实验质量浓度(0.1~1.0 mg/mL)范围内,0.3、0.6 mg/mL的黄酮及0.07 mg/mL的VC对HaCaT细胞影响较小,且这两个质量浓度的黄酮对细胞抗氧化活性的保护效果最好,相对于模型组(H2O2处理组),细胞相对存活率均提高了20%左右,略低于VC组。黄酮高、低质量浓度组对细胞抗氧化能力的影响差异小于3%,说明较低质量浓度黄酮(0.3 mg/mL)对细胞依然具有较强的抗氧化作用。在ROS水平检测实验中,高质量浓度组黄酮及VC可有效地降低细胞中ROS水平,相对于模型组,其ROS水平分别降低了12.65%、17.65%;在SOD活力检测实验中,黄酮低质量浓度组及VC可有效地增加细胞中SOD的活力,相对于模型组,SOD的活力分别增加了85.63%、139.30%。这表明黄酮及VC对H2O2诱导的氧化损伤有一定的预保护作用。这与高扬[12]、步犁[25]等研究的利用HaCaT细胞和原代人皮肤成纤维细胞筛选抗氧化物质的结果大致相似。
本研究结果表明,黄酮对HaCaT细胞具有一定的抗氧化预保护作用,软枣猕猴桃中黄酮类物质具有较好的抗氧化活性。抗氧化活性的评价方法包括传统的化学方法、细胞方法、动物模型法和人体志愿者法[26]。目前以细胞为基础的筛选模型在天然产物抗氧化活性评价研究中逐步得到应用,其中人体皮肤细胞常被选用为测试对象,以经氧化损伤诱导后抗氧化物质清除体内自由基的能力来评价其抗氧化活性的强弱[27-28]。细胞法可以对氧化应激所造成的损伤进行分子水平的分析,对于抗氧化物质的评价也更接近人体环境[29-30]。软枣猕猴桃中黄酮提取物是一种较强的氧化损伤保护剂,本研究为今后相关天然抗氧化性保健食品的开发和利用提供了一定的理论依据。但本研究结果仍处于细胞水平,尚且不能全面反映药物在人体内的吸收代谢过程,后续可通过动物实验及相关的药理学、药效实验,进一步推断其具体的抗氧化活性损伤体内保护机制。
