不同热加工方式对核桃蛋白致敏性的影响
2018-07-23姜松松韩诗雯车会莲
姜松松,赵 博,韩诗雯,车会莲
(北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083)
食物过敏已经成为一个世界范围内严重的公共卫生问题,严重影响人们的生活质量。有研究指出,超过90%的食物过敏都是由小麦、花生、大豆、坚果类、牛奶、鸡蛋、鱼和甲壳类这8 类食物引起的[1],其中核桃引起的过敏是一种严重的坚果过敏,常常伴随着严重的临床症状,甚至导致休克和死亡[2-3]。目前,不少研究证实,核桃过敏主要是免疫球蛋白(immunoglobulin,Ig)E介导的速发型过敏反应[4-6],而利用核桃过敏患者血清发现的核桃过敏原包括Jug r 1、Jug r 2、Jug r 3、Jug r 4[7-9],其中Jug r 1可以被80%以上的核桃过敏患者血清所识别,被认为是核桃中的主要过敏原蛋白[10]。
通过不同的加工方式能够改善食物的功能、营养、感官等性质,在加工过程中,食物蛋白的物理特性和化学结构常常会发生变化。此前有研究发现,将鱼煮熟后食用能够引发过敏反应,而生鱼不能[11],这引起了人们对加工能否影响食物蛋白致敏性的关注。有研究发现,对牛奶中β-乳球蛋白进行加热处理可显著降低其致敏性[12];Alvarez-Alvarez等[13]发现,高压处理羽扇豆能够通过降低其IgE结合能力来降低其致敏性;而Maleki等[14]发现,烤花生可以增强其IgE结合能力,从而增强其致敏性。这些研究结果提示不同的加工方式对不同蛋白的致敏性影响不同,这主要是因为不同的加工方式对食物蛋白结构等性质的影响不同。大多数的物理过程(加热、加压、辐射和超声)主要通过改变食物蛋白的二级和三级结构来影响构象表位(破坏、掩盖、暴露),而生物化学加工方式一般通过酸水解、酶水解或者剧烈的美拉德反应来改变食物蛋白的线性表位从而影响食物蛋白致敏性。Cabanillas等[15]发现核桃蛋白经高压处理后Jug r 4的IgE结合能力显著降低,提示高压处理能够有效降低核桃蛋白抗原性。但其他一些常用的加工方式对核桃蛋白致敏性的影响仍缺少相关研究。
热处理是食品中应用最普遍的加工技术,能够通过改变分子内、分子间的共价键或非共价键的相互作用,破坏二级结构和三级结构,影响构象表位,改变食物蛋白致敏性。本研究首先对核桃蛋白进行粗提取,然后分别对其进行煮沸、烘烤、高温高压以及微波等不同的热处理,通过对核桃蛋白可提取质量浓度、核桃过敏患者血清IgE结合能力及兔多克隆抗体IgG结合能力的变化,分析不同热处理方式对核桃蛋白抗原性、致敏性的影响,旨在探索能够有效降低核桃蛋白致敏性的热处理方法,从而为研发低致敏性或无致敏性核桃制品提供科学依据,保障核桃过敏患者的安全。
1 材料与方法
1.1 材料与试剂
本实验所用血清来自于6 个对核桃过敏的患者,筛选条件为:具有摄食核桃之后发生系统过敏反应的病史,或者在医院进行皮肤点刺实验对核桃产生阳性反应。过敏原特异性IgE抗体筛查定量检测显示其血清中核桃特异性IgE水平在0.6~2.7 kU/L之间。采用两个对鸡蛋过敏而非核桃过敏的受试者血清样本作为对照组,本研究获得中国农业大学人体研究伦理委员会批准(批准号:0312150129),均取得血清提供者的知情同意。
核桃(Juglans regia)产自中国天津蓟县。二辛可酸(bicinchoninic acid,BCA)蛋白定量试剂盒美国Novagen公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔IgG抗体 美国Cell Signaling Technology公司;牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;四甲基联苯胺显色液美国Promega公司;乙二胺四乙酸 北京蓝弋公司。
1.2 仪器与设备
5804 R型低温高速离心机 德国Eppendoff公司;多功能旋转摇床 海门市其林贝尔仪器制造有限公司;DYY-6C-电泳仪 北京六一仪器厂;电转仪 美国Bio-Rad公司;GelDoc-ItTM影像系统 美国UVP公司;Varloskan Flash多功能酶标仪 美国Thermo Scientific公司;MSL-3750高压灭菌锅 日本Sanyo公司。
1.3 方法
1.3.1 核桃蛋白粗提取及热处理
去除核桃外硬壳并去皮,液氮研磨成细粉末。称取l0 g所得核桃粉,加入100 mL正己烷溶液,于4 ℃磁力搅拌脱脂2 h,然后于4 ℃ 8 000×g离心30 min,弃上清液,将所得沉淀再重复脱脂1 次,置于通风橱内晾干备用。
对上述获得的核桃蛋白粗提取物进行不同方式的热处理,包括湿热、干热、高温高压、微波加热[16],详见表1。处理后样品分别使用磷酸盐缓冲液(phosphate buffer saline,PBS)溶解(1∶20,m/V),4 ℃搅拌过夜,将溶液10 000×g离心20 min,取上清液使用BCA蛋白定量试剂盒进行蛋白质量浓度测定。
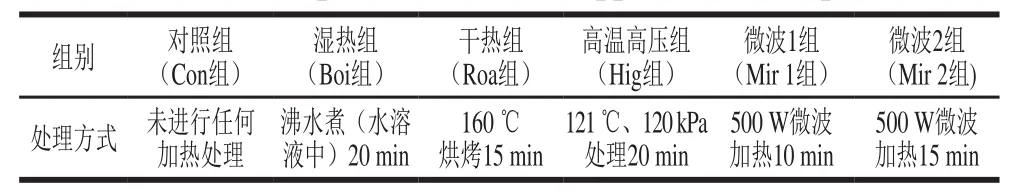
表1 不同热处理方式Table1 Description of treatments applied to walnut powders
1.3.2 Jug r 1多克隆抗体制备
使用凝胶过滤层析以及阴离子交换层析的方法[17]纯化出核桃致敏蛋白Jug r 1。以此作为抗原,制备多克隆抗体[18]:基础免疫以500 μg Jug r 1抗原溶于2 mL弗氏完全佐剂中,使之充分乳化,皮下多点注射新西兰家兔。加强免疫时用弗氏不完全佐剂,抗原剂量为首次的1/2。每2~3 周加强免疫1 次。在每次加强免疫之后1 周,从耳缘静脉取血2~3 mL,分离血清,用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)方法检测抗体效价,直至抗体效价在1∶10 000以上。大量采血,室温凝固后4 ℃冷藏4 h,离心分离血清,使用正辛酸-硫酸铵两步沉淀法纯化多克隆抗体,-20 ℃冷冻保存。
1.3.3 SDS-PAGE分析
采用电泳仪进行不连续双垂直板十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析热处理对不同核桃蛋白质量浓度的影响。将核桃蛋白粗提取物与样品缓冲液(pH 6.8、0.5 mol/L Tris-HCl缓冲液2.0 mL、无水丙三醇2.0 mL、20%十二烷基硫酸钠2.0 mL、质量分数0.1%溴酚蓝0.5 mL、β-巯基乙醇1.0 mL、去离子水2.5 mL)按1∶1的体积比混合,100 ℃煮沸5 min,离心,上样20 μL,分离胶质量浓度12 mg/100 mL,浓缩胶质量浓度3.9 mg/100 mL。开始电流10 mA,进入分离胶后电流为20 mA,电泳时间2.5~3.5 h。考马斯亮蓝R-250染色过夜,放入脱色液中脱色,直至胶片背景蓝色变为完全透明状,电泳自动成像仪拍照,使用Image J软件进行半定量分析。
1.3.4 血清学分析
1.3.4.1 Dot blot实验
采用斑点印迹(Dot blot)实验分析不同热处理方式对核桃蛋白IgE结合能力的影响。使用0.01 mol/L PBS(pH 7.4)稀释上述各处理组的3 mg/mL蛋白溶液,取2 μL点于硝酸纤维素膜上,置于37 ℃恒温箱中干燥20~30 min,使蛋白吸附至膜上;使用TBST/5% BSA封闭1 h,使用6 个对核桃过敏患者血清(每两个分为一组,混合成3 个血清池)以体积比1∶10稀释进行孵育,4 ℃过夜;一抗孵育后,用TBST洗涤6 次,加入质量比1∶8 000生物素标记的羊抗人IgE抗体,37 ℃孵育1 h,用TBST洗涤6 次;再加入质量比1∶500 HRP标记的链霉亲和素37 ℃孵育1 h,TBST洗涤6 次后使用二氨基联苯胺(diaminobezidin,DAB)染液避光孵育显色,去离子水冲洗终止反应。分析核桃蛋白粗提取物与过敏患者血清IgE的结合能力。
1.3.4.2 Western blot实验
采用免疫印迹(Western blot)实验进一步分析核桃中主要过敏原Jug r 1的IgE、IgG结合能力的变化。对各处理组的核桃粗提取物进行SDS-PAGE分析后,在80 V下恒压电转2 h,将蛋白条带印迹到硝酸纤维素膜上。采用TBST(5% BSA)封闭1 h,加入制备的抗Jug r 1蛋白的兔多抗血清或过敏病人血清孵育过夜。一抗孵育完后,用TBST洗涤6 次,用HRP标记羊抗兔IgG抗体或羊抗人IgE抗体孵育1 h,用TBST洗涤8 次。加DAB显色液孵育5 min,显色后去离子水冲洗,照相。
1.4 数据分析
2 结果与分析
2.1 热处理方式对核桃蛋白质量浓度的影响
使用BCA试剂盒对不同热处理后核桃蛋白的可提取质量浓度进行分析,如图1A所示,与对照组相比,干热、湿热及高温高压处理后,可提取核桃总蛋白的质量浓度显著降低(P<0.05),其中高温高压处理的效果最为显著,可提取总蛋白质量浓度降为(6.84±0.10)mg/mL,降低了32.3%,这可能是由于高温高压引起部分蛋白质变性凝固,从而降低了其可提取蛋白质量浓度。与对照组相比,微波处理组反而在一定程度上增加了核桃蛋白的可提取质量浓度,这可能与微波加热的作用方式有关。
核桃主要过敏原为Jug r 1,其分子质量约为16 kDa[10]。采用SDS-PAGE进一步分析不同热处理方式对Jug r 1质量浓度的影响。如图1B所示,在16 kDa处,与对照组相比,干热处理的电泳条带灰度未发生显著变化;湿热、高温高压处理组的电泳条带灰度显著降低;微波处理组的蛋白条带灰度略有加深。这提示干热处理对核桃中Jug r 1的质量浓度没有显著影响,湿热和高温高压处理显著降低了Jug r 1的可提取质量浓度,而微波处理增加了核桃中Jug r 1的可提取质量浓度,这与上述BCA法测定蛋白质量浓度结果基本一致。
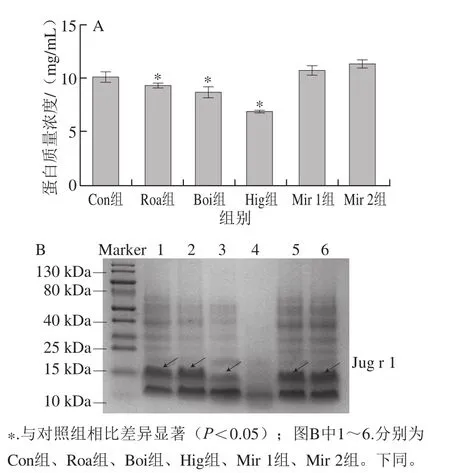
图1 不同热处理提取核桃蛋白质量浓度(A)和SDS-PAGE分析(B)Fig. 1 Walnut protein concentration (A) and SDS-PAGE (B) of protein extracts walnuts from subjected to different thermal treatments
2.2 热处理方式对核桃蛋白IgE结合能力的影响
绝大多数的核桃过敏反应由IgE介导,IgE与肥大细胞等效应细胞表面的Fc受体结合,过敏原再次进入机体后,与肥大细胞表面的IgE抗体结合,形成桥联,引起脱颗粒反应,释放出炎性介质,从而引起临床症状[19]。为探究不同热处理方式对核桃蛋白IgE结合能力的影响,对收集的6 个核桃过敏患者的血清进行Dot blot实验。结果如图2A所示,干热处理对核桃蛋白与IgE结合程度没有明显影响,湿热和高温高压处理显著降低了核桃蛋白与病人血清池中IgE的结合程度,尤其经高温高压处理后,核桃蛋白几乎已不能与患者血清池中IgE结合,而微波处理在一定程度上增强了核桃蛋白与患者血清池中IgE的结合程度。
为了对其结合程度进行精确量化,使用Image J软件对Dot blot实验的结果进行半定量分析,结果如图2B所示。以患者血清池与对照组蛋白结合的灰度作为基准,与对照组相比:干热处理对核桃蛋白与IgE的结合能力没有显著影响(P>0.05);湿热和高温高压处理显著降低了核桃蛋白与核桃过敏患者血清中IgE的结合能力(P<0.05),分别降低了约50%、90%;而微波处理使核桃蛋白的IgE结合能力显著增强了约30%(P<0.05),这提示高温高压能够显著降低核桃蛋白的抗原性,而微波处理能够显著增强其抗原性。
由于Dot blot实验使用的是核桃粗蛋白,因此,采用Western blot实验进一步探究核桃蛋白中主要发挥致敏性作用的蛋白。结果如图2C所示,所选取的两名核桃过敏患者的血清都在10~17 kDa以及20~30 kDa处有结合条带,根据分子质量推测前者为核桃中主要过敏原Jug r 1,而后者的电泳迁移规律与过敏原数据库中已知的4 种核桃致敏原蛋白并不相符,因此推测这可能是一种并未被鉴定与表征的核桃过敏原蛋白。结果显示,湿热和高温高压处理显著降低了核桃主要过敏原Jug r 1与核桃过敏患者血清IgE的结合能力(P<0.05),其中高温高压处理效果最显著,而干热处理对Jug r 1的IgE结合能力没有显著影响,微波处理一定程度上增强了Jug r 1的IgE结合能力,这和Dot blot实验的结果基本一致。
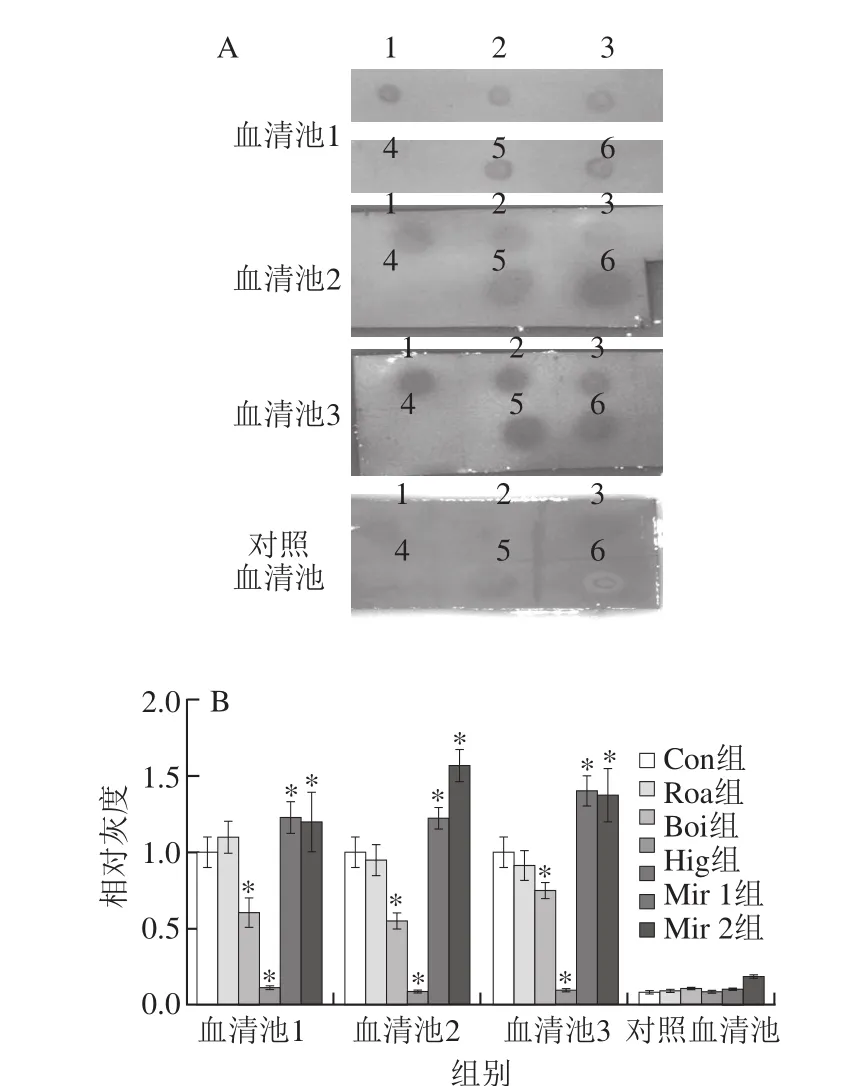
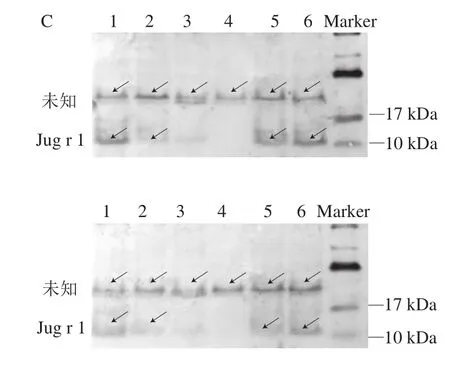
图2 Dot blot实验(A)、相对灰度分析(B)以及IgE免疫印迹实验(C)Fig. 2 Results of dot blot tests (A), relative gray value analysis (B) and IgE immunoblotting tests (C)
2.3 热处理方式对核桃蛋白IgG结合能力的影响

图3 IgG免疫印迹结果(A)和相对灰度分析(B)Fig. 3 Results of IgG immunoblotting tests (A) and relative gray value analysis (B)
本研究中收集了6 名核桃过敏患者的血清以分析不同热处理方式对核桃蛋白抗原性的影响,但其血清中IgE浓度相对较低,为进一步确定不同热处理方式对核桃蛋白抗原性的影响,使用核桃主要过敏原Jug r 1制备的特异性多克隆抗体进行Western blot实验。如图3所示,在分子质量约为15 kDa处有明显的结合条带(箭头指示),与Jug r 1约16 kDa的表观分子质量相吻合,除了80 kDa左右存在少量非特异性条带外,蛋白与多克隆抗体的特异性结合能力很强。结果显示:干热处理对核桃蛋白的IgG结合能力没有显著影响(P>0.05);湿热和高温高压处理显著降低了核桃蛋白IgG的结合能力(P<0.05),分别降低了40%、80%;而微波处理一定程度上提高了核桃蛋白的IgG结合能力。这说明湿热和高温高压处理显著降低了核桃蛋白的IgG结合能力,提示这两种处理方式能够有效降低核桃蛋白抗原性,这与利用核桃过敏患者血清研究的结果一致。
3 讨 论
核桃是蛋糕和饼干等烘焙产品重要的添加原料,同时也是一类主要的坚果过敏源[20],无意添加或者加工过程中的交叉污染可能会危及核桃过敏者的健康甚至生命[21]。热处理是一种常用的蛋白改性手段,也是食品加工过程中常规的工艺流程,能够影响食物蛋白的溶解度和结构等理化性质,既而可能影响其致敏性。
本研究选取常用的几种热处理方式,探究了不同方式对核桃蛋白致敏性的影响。首先检测了不同热处理后核桃蛋白可提取质量浓度的变化,随后使用核桃过敏患者血清检测不同方式对核桃IgE结合能力的变化,分析其对核桃蛋白抗原性的影响。但是,由于核桃过敏患者血清不易收集,本研究中只收集到了6 名核桃患者的血清,且其血清中IgE水平较低,样本的数量及IgE水平可能会限制核桃蛋白抗原性变化检测的准确性;因此,本研究制备了Jug r 1多克隆抗体以研究其IgG结合能力,进一步分析不同热处理方式对核桃蛋白抗原性的影响。
干热和湿热是热处理中常用的两种方式。有研究显示,花生中的过敏原Ara h1和Ara h2的致敏性在经过烘烤后会增加,但是经过水煮后显著降低[14,22]。本研究发现,干热处理对核桃蛋白的IgE结合能力、IgG结合能力都没有显著影响,而湿热处理显著降低了核桃蛋白的IgE和IgG结合能力,提示相比于干热处理,湿热处理能更显著地降低核桃蛋白抗原性。这可能是由于两种加热方法的升温和热处理模式不同,水分含量也不一样,导致蛋白质分子发生某些化学反应(疏水、共价)的速率不同,从而影响了其抗原性。干热处理通过脱水干燥使蛋白质氧化、变性、炭化,相比于干热处理,湿热处理穿透性更强,更易于传递热量,与水的直接接触也更易破坏保持蛋白质稳定性的氢键等结构[23-24]。因此,湿热处理更易使蛋白质变性并发生凝固,破坏蛋白化学结构,从而破坏过敏原的表位,降低蛋白致敏性。
高温高压处理是一种热处理与非热处理相结合的方式。高压处理通过影响蛋白分子的非共价相互作用(氢键、离子键和疏水键)从而影响其二级和三级结构[25-27]。本研究发现,高温高压处理在降低核桃蛋白质量浓度和抗原性上均具有最显著的效果,这提示高温高压处理能够有效降低核桃蛋白致敏性。推测高温高压处理严重破坏了核桃中过敏原的原有结构和抗原表位,从而显著降低了核桃过敏原的IgE、IgG结合能力,有效降低核桃蛋白抗原性。
此外,在本研究中还采用了微波加热的处理方式,发现和干热、湿热、高温高压这3 种热处理方式相比,微波加热处理不但没有降低核桃蛋白的可提取质量浓度,反而在一定程度上使其增加,这可能是因为微波作用可使核桃表里同时吸收微波能量,温度升高,内部水分迅速汽化并向外迁移,形成无数条微小孔道,使样品结构蓬松,增加其溶解度。此外,本研究还发现,微波处理略微提高了核桃蛋白的IgE、IgG结合能力,这可能是由于微波加热的处理方式可以使蛋白的某些折叠结构被不同程度的打开,但由于加热均匀,其表面温度不高,不足以产生足够的美拉德反应,因此会暴露或者形成更多的抗原表位,从而有利于抗体的结合,提高了核桃蛋白的抗原性。有研究指出,一些加工处理方式使蛋白形成新的稳定结构后,分子表面某些局部区域会形成新的抗原决定簇[28],这可能也是本研究中微波加热后核桃蛋白抗原性增强的原因。
值得注意是,在利用Western blot方法探究不同热处理对核桃蛋白IgE结合能力的影响时,只在10~17 kDa以及20~30 kDa两处发现结合条带,尚未发现其他的结合条带。这提示本研究中收集的核桃过敏患者血清只能够识别这两种核桃蛋白。目前,核桃过敏原蛋白已被鉴定的有Jug r 1、Jug r 2、Jug r 3、Jug r 4,本研究中第一个结合条带根据分子质量可以推测为Jug r 1,而第二个结合条带电泳迁移规律与已知的4 种核桃致敏原蛋白均不相符。说明本研究收集的核桃过敏患者血清只识别出了Jug r 1,并未识别出Jug r 2、Jug r 3、Jug r 4,这可能与收集的核桃患者血清相关。一方面可能由于本研究收集的血清样本数量有限;另一方面,可能是由于在我国其他3 种核桃过敏原不是引起核桃过敏的主要过敏原。大量研究发现,食物过敏具有地区和人群差异性[29-31],本研究结果进一步提示核桃过敏具有地区差异性,不同地区引起核桃过敏的过敏原可能不一样。而本研究中发现的20~30 kDa处的结合条带,推测是一种并未被鉴定的核桃过敏原,在核桃过敏中可能发挥重要作用,但这仍需要进一步研究;同时,由于本研究中采用的几种热处理方式均不能够影响其抗原性,提示其结构相对稳定,具有较好的耐热性。
综上,湿热和高温高压这两种热处理方式不仅能够显著降低核桃蛋白质量浓度,同时还能显著降低核桃蛋白抗原性,这提示湿热和高温高压这两种热处理方式能够有效降低核桃蛋白致敏性,其中高温高压处理的效果最为显著。本研究的结果为寻找降低核桃蛋白致敏性的加工方式提供了参考,同时也为其他坚果类食品降低致敏性的加工方法提供借鉴。
