两种放牧方式对绒山羊肉抗氧化系统的影响
2018-07-23罗玉龙王柏辉李文博苏日娜侯艳茹赵丽华田建军
罗玉龙,刘 畅,王柏辉,李文博,苏日娜,侯艳茹,杨 蕾,赵丽华,苏 琳,田建军,靳 烨
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
内蒙古绒山羊为优良的绒、肉兼用型品种,主要以放牧、半放牧、舍饲等方式养殖。目前对绒山羊的研究主要集中在产绒性能、瘤胃代谢以及营养代谢等方面:牛一兵等[1]对放牧条件下绒山羊的绒毛生长规律进行研究,发现牧草种类和光照时长均能影响绒毛质量;乔灵等[2]研究了不同饲养方式下绒山羊瘤胃的形态学变化;柴贵宾等[3]则通过在日粮中增加能量水平、蛋白水平,发现日粮中能量和蛋白水平分别高于8.6 MJ/kg和9.4%时,可以满足产绒质量的要求;但目前对绒山羊肉的抗氧化能力鲜有研究。绒山羊的绒、肉品质不仅受动物品种、年龄、性别、饲养方式等因素的影响,而且与其抗氧化能力密切相关[4-5]。不合理的饲养方式会使机体过度氧化,加快绒山羊的衰老,使其产绒、产肉的质量下降,绒山羊肌肉抗氧化能力能够反映其抵抗刺激、疾病等的能力,间接反映机体生长发育情况,提高肌肉抗氧化能力能够在一定程度上提高绒毛以及肉品的质量。
本实验通过对草场放牧和山地放牧绒山羊的肉色、氧化状态以及抗氧化能力相关指标的检测,对比研究两种放牧条件对绒山羊抗氧化防御机能的影响,分析肉色稳定性、脂质、蛋白氧化状态、抗氧化酶活力和抗氧化能力之间的联系,为绒山羊饲养的科学化发展提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
绒山羊的饲养实验选择在阴山山脉中部的大青山地区,气候类型为典型的温带大陆性气候,年降雨量约为380 mm,当地草原类型为典型荒漠化草原。山地放牧选择在大青山山腰处,牧草类型包括沙棘、秦艽、黄芩等。草场放牧选择在大青山地区的草原上,牧草类型包括芨芨草、蒺藜、碱韭等。从内蒙古土默特左旗大青山牧区随机选择草场放牧和山地放牧条件下发育正常、健康无病的3.5 岁绒山羊各10 只,将该20 只实验羊现场屠宰,取绒山羊的背最长肌为实验材料,于-20 ℃保藏待用。
磷酸氢二钠、磷酸二氢钠、氯化钠(均为分析纯)北京国药试剂有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒 南京建成生物工程研究所;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS) 美国Amresco公司。
1.2 仪器与设备
XHF-DY型高速分散器 宁波新芝生物科技股份有限公司;5810-R型低温台式冷冻离心机 德国Eppendorf公司;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限公司;CR-400型色差仪 日本柯尼卡美能达公司;电热恒温箱 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 色泽的测定
用CR-400色差仪测定绒山羊背最长肌的亮度(L*值)、红度(a*值)以及黄度(b*值)。
1.3.2 Mb含量的测定
将绒山羊的背最长肌用生理盐水冲洗,滤纸吸干表面水分后切碎,准确称取5 g肉样,加45 mL磷酸盐缓冲液(40 mmol/L、pH 6.8),冰浴匀浆(4 000 r/min)20 s后静置5 min,滤纸过滤,滤液在525 nm波长处测吸光度,以磷酸盐缓冲液为空白对照[6]。肌红蛋白(myoglobin,Mb)含量按公式(1)计算。
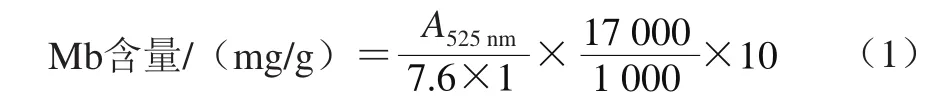
式中:7.6为波长525 nm处Mb的摩尔吸光系数(L/(mol·cm));1为比色皿宽度(cm);17 000为Mb的平均分子质量(Da);10为稀释倍数。
1.3.3 蛋白氧化状态的测定
准确称取5 g肉样加入25 mL磷酸盐缓冲液(40 mmol/L、pH 6.8),冰水浴中匀浆20 s(4 000 r/min)后冰浴静置1 h,在4 ℃条件下3 000 r/min离心25 min,取上清液,再用滤纸过滤,滤液分别在525、545、565、572 nm波长处测吸光度[7],按照Krzywicki[8]的方法计算氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白(metmyoglobin,MMb)的相对含量,如公式(2)、(3)所示。
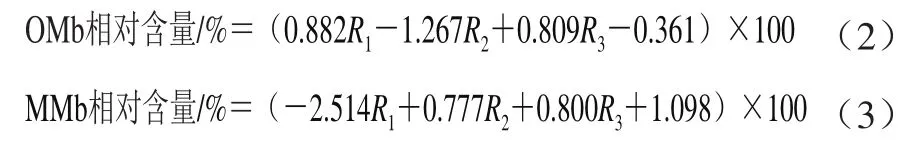
式中:R1、R2、R3分别为572、565、545 nm波长与525 nm波长处吸光度的比值。
1.3.4 MDA含量、抗氧化酶活力和T-AOC的测定
绒山羊背最长肌经预冷的生理盐水漂洗后,取0.5 g左右于离心管中,并加9 倍体积的生理盐水,在冰水浴中高速匀浆30 s(8 000 r/min)制成10%的组织匀浆,然后在4 ℃条件下4 000 r/min离心10 min,取上清液,并按照试剂盒说明书分别测上清液中SOD活力、GSH-Px活力、CAT活力、MDA含量以及T-AOC。
1.3.5 RSA的测定
自由基清除率(radical scavenging ability,RSA)的测定参照文献[9]。将25 mL 14 mmol/L的ABTS溶液与等体积的2.45 mmol/L过硫酸钾溶液混合并在黑暗条件下反应16 h,使ABTS完全氧化而形成ABTS+·反应液。使用时用磷酸盐缓冲液(pH 7.4)将ABTS+·反应液稀释,使其在734 nm波长处的吸光度为0.750±0.020。取肌肉提取液50 μL与6 mL ABTS+·反应液混合,30 ℃水浴6 min后在734 nm波长处测吸光度。用等体积的去离子水代替组织提取液作为空白对照,RSA按公式(4)计算。

式中:A0为空白溶液吸光度;A1为样品溶液吸光度。
1.4 数据统计分析
2 结果与分析
2.1 肉色的分析结果

表1 两种放牧方式下绒山羊的肉色分析Table1 Effect of two grazing conditions on color of cashmere goat meat
肉色是用来衡量肉品品质和新鲜度的重要指标。研究表明,肉色与肉中Mb的含量及氧化状态直接相关,并且随着Mb被氧化,肉的a*值下降[10-11]。由表1可知,草场放牧绒山羊肉L*值和b*值显著低于山地放牧(P<0.05),但a*值高于山地放牧(P<0.05)。山地放牧绒山羊肉的L*值高于草场放牧,可能与肌内脂肪的分布有关,肌内脂肪含量越高,L*值越高[12]。a*值的高低可能与绒山羊肉含有的肌纤维类型有关,苏琳等[13]的研究表明,肉中慢收缩氧化型肌纤维比例越高,Mb含量就越高,肉色评分越高;快收缩酵解型肌纤维比例越高,ATP酶和糖原含量就越高,导致肌肉氧化代谢加快,肉色较差,而绒山羊肉色的稳定性是抗氧化能力与氧化能力之间的角力,是决定肉色的主要因素[14]。
2.2 Mb含量和脂质氧化状态分析结果

表2 两种放牧方式下绒山羊肉的氧化状态Table2 Effect of two grazing methods on oxidation of cashmere goat
畜肉的鲜红色是消费者喜欢的颜色,这主要是肉中OMb积累形成的;而畜肉色泽的劣变是由组织中MMb积累导致的[15]。由表2可知,草场放牧绒山羊肉Mb含量和OMb相对含量高于山地放牧,但差异不显著;草场放牧绒山羊肉的MMb相对含量显著低于山地放牧(P<0.05)。草场放牧和山地放牧的绒山羊肉MMb相对含量在25%~30%之间。研究表明,当肉品中的MMb相对含量高于20%时,肉的红色逐渐变暗,达到50%时肉品呈现红褐色,若高于70%则肉品变为褐色而失去销售价值[16]。
草场放牧绒山羊肉OMb相对含量高于山地放牧,而MMb相对含量低于山地放牧,这也验证了草场放牧绒山羊的肉色较山地放牧好。绒山羊肉中蛋白氧化与脂质氧化也有很大关系,山地放牧绒山羊肉脂质氧化程度高于草场放牧,进而导致Mb受到脂质氧化过程中产生的自由基和次级代谢产物的攻击而被氧化,脂质氧化程度越高,Mb越容易被氧化[17]。
脂类氧化能产生小分子次级代谢产物,如醛、酮及环氧衍生物等,这些物质能与Mb结合,促进Mb氧化为MMb,从而失去运输氧的能力[18];而MDA是主要的脂质过氧化产物,其含量通常可以反映组织内脂质过氧化的程度[19]。由表2可知,草场放牧绒山羊肉的MDA含量显著低于山地放牧(P<0.05),其脂质氧化程度较山地放牧低,原因可能是在天然草场内,一些天然牧草中含有大量的抗氧化活性物质,比如生育酚、类胡萝卜素、酚类化合物等,绒山羊长期采食后,这些抗氧化活性物质沉积于肌肉组织中,有效抑制了组织内的过氧化反应[20]。
2.3 抗氧化酶活力和抗氧化能力分析结果

表3 两种放牧方式下绒山羊肉的抗氧化酶活力和抗氧化能力Table3 Effect of two grazing conditions on antioxidant enzymes activities and antioxidant capacity of cashmere goat meat
抗氧化酶活力能反映组织内清除自由基的能力[21]。其中SOD能够催化超氧阴离子发生歧化反应,生成H2O2和O2,CAT继续将H2O2分解为H2O和O2,GSH-Px则能清除胞液和线粒体中的脂质过氧化物以及自由基,避免氧化损伤[22]。由表3可知,在草场放牧条件下,绒山羊肉的SOD、CAT和GSH-Px活力均高于山地放牧,其中,CAT和GSH-Px活力显著高于山地放牧(P<0.05)。草场放牧绒山羊肉的抗氧化酶活力高于山地放牧的原因可能是,草场放牧的绒山羊在长期摄入含有大量抗氧化活性物质牧草的同时有适宜的运动量,这促进了相关抗氧化酶活力的提高[23],而草场放牧绒山羊的高抗氧化酶活力也进一步抑制了MMb在组织内的累积。
自由基能引发脂质氧化链式反应,也能使Mb中的Fe2+氧化为Fe3+,而RSA则反映肌肉组织中所有抗氧化物质组成的抗氧化系统对自由基的清除能力,T-AOC是衡量肌肉总抗氧化能力的主要指标[24]。由表3可知,T-AOC在两种放牧方式上没有显著性差异(P>0.05),均在1.3 U/mg左右,但草场放牧绒山羊肉的RSA显著高于山地放牧(P<0.05)。整体上,草场放牧绒山羊肉在抑制氧化方面具有优势,这可能与其含有相对更丰富的抗氧化活性物质有关,这些抗氧化活性物质能清除组织内的氧自由基,并且能降低组织中MDA含量及由氧化应激造成的细胞损伤[25-26]。
2.4 绒山羊肉的抗氧化指标相关性分析结果
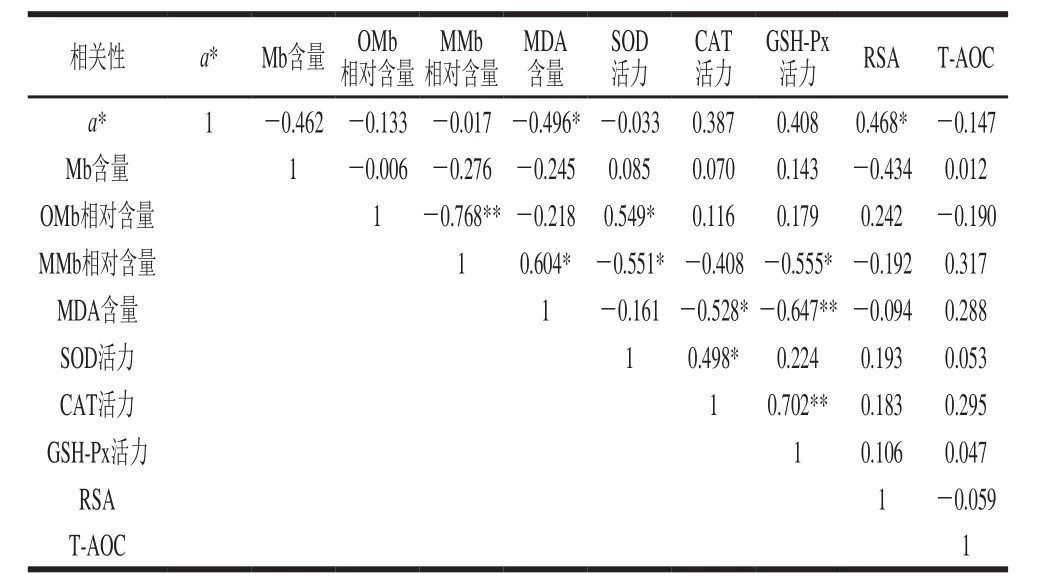
表4 绒山羊肉的抗氧化指标相关性Table4 Correlation coefficients among antioxidant parameters of cashmere goat meat
由表4可知,绒山羊肉中SOD活力与CAT活力之间呈显著正相关(P<0.05),GSH-Px活力与CAT活力之间的呈极显著正相关(P<0.01),说明绒山羊肉中GSH-Px、SOD与CAT能够协同促进活力升高,这与Gatellier等[27]的研究一致。MDA含量与MMb相对含量之间呈显著正相关(P<0.05),随着脂肪氧化程度的加快,产生的自由基和次级代谢产物促使组织内Mb的氧化加速,并造成MMb的积累,这与Lee等[18]的研究结果一致。SOD活力与OMb相对含量之间呈显著正相关(P<0.05),SOD能清除组织内的自由基,避免了OMb向MMb转化,使得OMb的相对含量增加。RSA与a*值之间呈显著正相关(P<0.05),表明内源抗氧化剂抗氧化能力能影响到肉的色泽,其通过协同作用清除组织内的自由基,进而影响Mb的氧化状态[13]。
绒山羊肉中MDA含量与a*值之间呈显著负相关(P<0.05),当肉中的MDA含量过高时,脂质氧化程度增强,会促进Mb的氧化,从而破坏肉色的稳定性,使肉的红度降低。SOD、GSH-Px活力与MMb相对含量之间呈显著负相关(P<0.05),SOD和GSH-Px活力的增强使得组织内的MMb相对含量下降,而组织内MMb相对含量的增加则能抑制SOD和GSH-Px活力,使组织内蛋白氧化呈现出动态的平衡。MMb与OMb相对含量之间呈极显著负相关(P<0.01),表明机体内的OMb与MMb的相对含量呈相互抑制关系,一种机制激活时,另一种可能处于被抑制状态[28]。CAT活力与MDA含量之间呈显著负相关(P<0.05),GSH-Px活力与MDA含量之间呈极显著负相关(P<0.01),说明抗氧化酶活性增加会及时清除脂质氧化产物产生的自由基,继而降低脂质氧化产物含量。总之,组织内抗氧化能力、脂质氧化、蛋白氧化状态以及抗氧化酶活力之间可能存在着一些特定的生理机能关系,脂质氧化能加速蛋白氧化,而组织内的抗氧化能力增强能抑制脂质氧化和蛋白氧化[29]。
3 结 论
草场放牧绒山羊肉的a*值显著高于山地放牧(P<0.05),Mb含量和OMb相对含量高于山地放牧,MMb相对含量、MDA含量显著低于山地放牧(P<0.05)。说明草场放牧绒山羊肉氧化程度较低,肉色较好。
在草场放牧条件下,绒山羊肉3 种抗氧化酶活力均高于山地放牧,其中CAT和GSH-Px活力显著高于山地放牧(P<0.05)。反映抗氧化能力的指标为T-AOC和RSA,T-AOC在放牧方式上没有显著性差异(P>0.05),但草场放牧绒山羊肉的RSA显著高于山地放牧(P<0.05)。整体上,草场放牧绒山羊肉中抗氧化酶的活力较高,有效抑制了组织内的脂质氧化和蛋白氧化,从而使其抗氧化能力高于山地放牧。
通过对绒山羊肉的色泽、氧化程度、抗氧化能力以及抗氧化酶活力的相关性分析可知:绒山羊肉SOD活力-CAT活力、SOD活力-OMb相对含量、MDA含量-MMb相对含量、RSA-a*值之间存在显著正相关关系(P<0.05),GSH-Px活力-CAT活力之间呈极显著正相关(P<0.01);MDA含量-a*值、SOD活力-MMb相对含量、CAT活力-MDA含量、GSH-Px活力-MMb相对含量之间存在显著负相关关系(P<0.05),而MMb相对含量-OMb相对含量、GSH-Px活力-MDA含量之间存在极显著负相关关系(P<0.01)。绒山羊肉的肉色、抗氧化能力、氧化状态以及抗氧化酶活力之间有可能存在着一些特定的生理机能关系,脂质氧化能加速蛋白氧化,而组织内的抗氧化能力增强能抑制脂质氧化和蛋白氧化,从而维持肉色的稳定。
